
Тут есть жесткость воды
.pdf
4.3.ВОДОПОДГОТОВКА
Этапы, техническое оснащение, а также использование вспомогательных материалов в подготовке воды определяются, главным образом, сферой ее использования. Как уже было описано выше, вода может быть широко использована в промышленности и в быту. В зависимости от целевого назначения воду различают на питьевую и промышленную.
Подготовка питьевой воды заключается, главным образом, в удалении патогенных микроорганизмов, поэтому большое значение имеют методы обеззараживания воды. В свою очередь, подготовка промышленных вод зависит требований к качеству предъявляемых на конкретных производствах.
Рисунок 4.9. Этапы водоподготовки
При этом большое значение уделяется удалению солей жесткости и предназначенным для этого методам. Как видно из схемы, представленной на рис 4.9, подготовка питьевой и промышленной воды начинается с механической очистки. Затем при необходимости на станциях подготовки питьевой воды используют методы устранения повышенной жесткости, а для подготовки промышленной воды – это ключевой и обязательный этап. Далее осветленная вода на станции подготовки питьевой воды в обязательном порядке подвергается обеззараживанию, в то время как для подготовки промышленной воды предназначена дегазация.
4.3.1. Механическая очистка
Механическая очистка начинается на стадии водозабора пресной воды. Водозабор является первым звеном сложной системы водоснабжения, обеспечивающим питание всех водопотребителей. Занимая головное положение в системе, водозабор играет определяющую роль в ее функционировании.
Современный водозабор для водоснабжения крупного города представляет собой сложный комплекс инженерных сооружений, оснащенных энергетическим и механическим
160

оборудованием, системой автоматического и телемеханического управления. Такой водозабор должен работать бесперебойно при любых условиях забора воды, существенно изменяющихся по сезонам года. В общем виде система водоснабжения включает водозаборные сооружения, насосные станции, сооружения водоподготовки, емкости для хранения и водоводы.
Механическая очистка, т. е. удаление
нерастворенных примесей,
взвешенных частиц глины,
песчинок,
ржавчины и т. п.
Механическая очистка может осуществляться методами
отстаивания
осаждения
фильтрации
Отстаивание
Рис.4.10. Механизм отстаивания: 1- частицы с плотностью, большей плотности воды; 2 - частицы с плотностью, меньшей плотности воды
Рис.4.11. Процесс осаждения
плотности, размера и формы частиц
Процесс отстаивания нашел широкое применение. Практически на всех станциях подготовки питьевых вод в городах существуют отстойники.
Отстаивание - это процесс выделения из воды под действием гравитационных сил взвешенных веществ
(рис.4.10.).
При этом частицы с плотностью, большей плотности воды, движутся вниз, а с меньшей - вверх
Осаждение
Осаждение - принудительное удаление твердых веществ. Механизм процесса осаждения приведен на рис.4.11. В отличие от процесса отстаивания, в котором применяется естественное удаление осадка, в процессе осаждения для удаления осадка используют конструкционные особенности для увеличения скорости или для осаждения более мелких частиц. В качестве таких конструкционных особенностей могут быть использованы перегородки. Скорость осаждения зависит от
Фильтрация
Фильтрация составляет последний этап осветления воды и производится после предварительного осветления воды в отстойниках или осветлителях.
Процесс заключается в пропускании воды через слой мелкозернистого фильтрующего материала: речного или карьерного песка; дробленого антрацита.
161
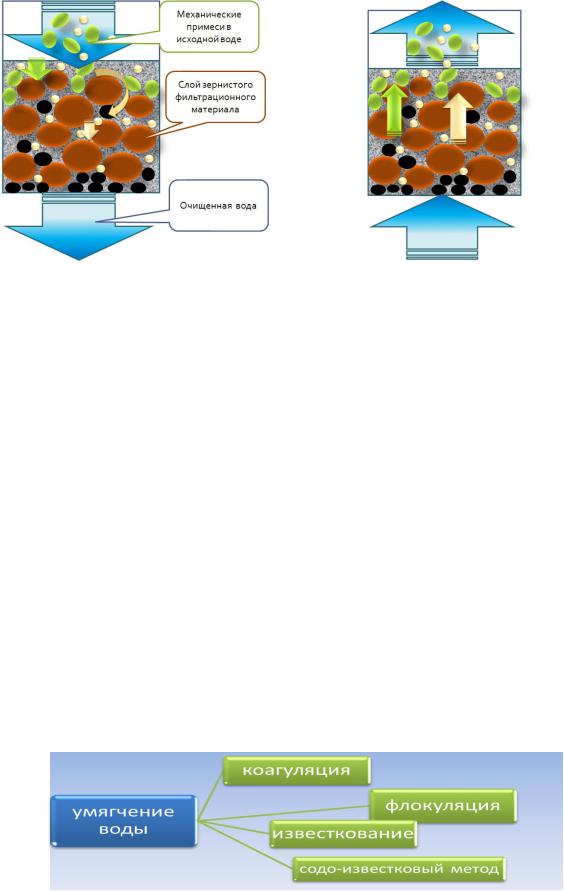
Рис.4.12. Фильтр в режиме фильтрации |
Рис.4.13. Фильтр в режиме регенерации |
|
Принцип работы фильтра в режиме фильтрации представлен на рис.4.12. Примеси задерживаются в слое зернистого материала, создавая новый фильтрационный слой. В определенный момент времени примесей становится очень много на поверхности фильтрационного материала и возникают неполадки в работе фильтра:
проскок примесей. Причина - фильтрационный материал не задерживает примеси на своей поверхности и они оказываются в очищенной воде, нарушая ее качество;
увеличение гидравлического сопротивления внутри слоя фильтрационного материала.
Для очистки примесей с поверхности фильтрационного материала применяют промывку чистой водой. Для этого противотоком, отключив предварительно подачу исходной воды, подают промывную воду (снизу вверх) для взрыхления фильтра. Взрыхление способствует не только удалению накопленных примесей, но и выравниванию слоя фильтрующего материала. Принцип работы фильтра в режиме регенерации или промывки представлен на рис.4.13.
4.3.2. Умягчение и обессоливание
Вода, прошедшая предочистку, практически не содержит в себе грубодисперсных примесей и в значительной степени освобождена от коллоидных. Однако основная часть примесей в истинно-растворенном состоянии остается в этой воде и должна быть удалена из неё. Многие соли жесткости имеют низкую растворимость. Методы умягчения приведены на рис.
4.14.
Рис.4.14. Методы умягчения
162

При введении в раствор некоторых реагентов увеличивается концентрация анионов, которые образуют малорастворимые соли с ионами жесткости Ca2+ и Mg2+. Такой процесс называют реагентным умягчением воды - это процесс слипания твердых частиц при их соприкосновении. Очистка воды коагуляцией представляет собой обработку воды коагулянтами — реагентами, под действием которых коллоиды загрязнителя слипаются, образуя хлопья. При этом возможно использование различных коагулянтов для очистки воды. Образование хлопьевидного осадка представлено на рис. 4.15.
Очистка воды коагуляцией, по сути, представляет собой процесс так называемого «укрупнения» мельчайших частиц загрязнителей, что обеспечивает эффективность
осаждения примесей либо же задержания их механическими фильтрами. Частицы загрязнений, сталкиваясь с хлопьями коагулянта, прилипают к ним и вместе с хлопьями выпадают в осадок.
Применяется коагуляция во многих технологических процессах, в том числе для очистки воды от мелких частиц ила, глин и бактерий.
Осветление и обесцвечивание воды коагулированием обычно включает следующие процессы: приготовление раствора коагулянта и его дозирование, смешение раствора с очищаемой жидкостью, гидролиз коагулянта с образованием золя и адсорбцией на нем примесей, коагуляцию золя, отстаивание и фильтрование.
Технология этих процессов должна обеспечивать максимально точное дозирование реагентов, хорошее смешивание, оптимальные условия гидролиза, образование хлопьев и освобождение очищаемой жидкости от взвесей.
Описание методов представлено в учебном объекте «Технологическая схема подготовки питьевой воды»
4.3.3.Ионный обмен.
Внастоящее время для умягчения применяют ионный обмен, а также мембранный и термический методы. Последние методы для получения воды необходимого качества чаще всего используют в комплексе с ионным обменом.
Сущность ионного метода заключается в использовании способности некоторых специальных материалов (ионитов) обменивать свои ионы (Na+, H+, Cl-, OH-) на ионы находящиеся в воде (Ca2+, Mg2+, SO42-, и др).
Способность ионитов к ионному обмену объясняется их строением. Любой ионит состоит из твердой основы – матрицы (рис.4.16.), на которую тем или иным способом нанесены специальные функциональные группы, способные при помещении ионита в раствор к образованию на поверхности ионита потенциалообразующих ионов, т.е. к возникновению заряда.
Вследствие этого вокруг твердой фазы создается диффузионный слой из противоположно заряженных ионов (противоионов).
163

Появление потенциалообразующих ионов может происходить либо адсорбцией функциональными группами ионита из раствора ионов какого либо знака заряда, либо диссоциацией функциональных групп под действием молекул воды. В последнем случае противоионами, образующими диффузный слой, являются ионы, переходящие в раствор в процессе диссоциации.
В технологии водоподготовки для удаления ионов из воды применяют два процесса:
|
|
катионирование - удаление катионов |
|
|
|
анионирование - удаление анионов. |
|
|
В зависимости от обменного иона процессы и |
||
|
аппараты получают названия: |
|
|
|
|
Н-катионирование, Н-катионитный фильтр; |
|
|
|
ОН-анионирование, |
ОН-анионитный |
|
|
фильтр; |
|
Рис.4.16. Матрица ионита |
|
Na-катионирование, |
Na-катионитный |
фильтр
Классификация методов ионного обмена приведена на рис.4.17. При умягчении воды обычно применяют два ионообменных метода: натрий (Na) – и водород (Н) – катионитовый.
и
Рис.4.17. Виды ионного обмена
Умягчение воды методом катионного обмена осуществляется путём пропуска жёсткой воды через слой загруженного в фильтр твёрдого, трудно растворимого материала, способного к обмену катионов в растворе и носящего название катионита. При этом находящиеся в воде Ca2+и Mg2+, и другие катионы поглощаются катионитом, а вместо них в раствор переходят Na+ и H+, ранее содержащиеся в катионите. В результате фильтрования воды через катионит вода практически полностью освобождается от Ca2+и Mg2+ и становится мягкой.
164

Na-катионирование
Na-катионирование применяется для умягчения воды и имеет самостоятельное значение при подготовке воды с малой щелочностью для котлов низкого давления и подпитке воды теплосетей. Умягчение воды методом Na – катионирования осуществляется путем пропуска жесткой воды через слой загруженного в фильтр специального материала (катионита): сульфоугля, искусственных смол, способных к обмену катионов, и др.
Сульфоуголь – это каменный уголь, обработанный крепкой серной кислотой (рис.4.18). Насыпная
Рис.4.18. Сульфоуголь плотность воздушно-сухого сульфоугля 0,55 т/м3 , размер зерен 0,3 – 1,2 мм, динамическая обменная
емкость 280 – 360 г-экв/м3 . Сульфоуголь практически нерастворим в воде. Засыпанный в фильтр катионит сначала насыщают ионом натрия. Это достигается промываением материала раствором поваренной соли. Затем через фильтр пропускают умягченную воду.
При Na-катионировании воду пропускают через слой катионита, находящегося в исходном состоянии в Na-форме. При этом процессе происходит удаление из воды Са2+ и Mg2+ в обмен на эквивалентное количество ионов Na+ согласно следующим реакциям:
2R/Na+ + Ca2+ = R2/Ca2+ + 2Na+
2R/Na+ + Mg2+ = R2/Mg2+ + 2Na+
где R обозначает комплекс матрицы и функциональной группы без обменного иона (его принято считать одновалентным).
Из приведённых реакций видно, что анионный состав воды при Na-катионировании остается постоянным, поэтому и суммарная концентрация катионов, участвующих в этом процессе, также остается постоянной. Однако массовая концентрация катионов в растворе несколько возрастает, поскольку эквивалентная масса иона натрия выше эквивалентных масс ионов кальция и магния. Таким образом, солесодержание Na-катионированной воды несколько выше солесодержания исходной. Поскольку при Na-катионировании не происходит изменения анионного состава примесей воды, щелочность её не изменяется. Остаточная жесткость фильтра определяется условиями регенерации катионита и в лучшем случае составляет не более 5 мкг/экв-кг.
Н - катионирование
Обработка воды методом Н- катионирования заключается в фильтрации через слой катионита содержащего в качестве обменных ионов катионита водорода.
2H R Ca2 Ca2 R2 2H 2H R Mg 2 Mg 2 R2 2H
Изменение солевого раствора воды в процессе Н-катионирования может быть изображено следующими уравнениями:
соли карбонатной жёсткости:
Ca(HCO3 )2 2HR CaR2 2H2O 2CO2
165
Mg(HCO3 )2 2HR MgR2 2H2O 2CO2
соли не карбонатной жёсткости:
2HR CaSO4 CaR2 2H2SO4
HR CaCl2 CaR 2HCl
2HR CaSiO3 CaR2 H2 SiO3
2HR MgSO4 MgR2 2H2 SO4
2HR MgCl2 MgR2 2HCl
2HR MgSiO3 MgR2 H2 SiO3
В процессе Н-катионирования происходит также обмен катионов водорода на катионы натрия, присутствующие в умягчённой воде.
2H R Na Na R2 2H
В процессе Н-катионирования воды происходит изменение солесодержания воды, и таким образом, происходит истощение Н-катионита, теряющего способность умягчать воду.
Н- катионовая вода – кислая. Н- катионовую воду сочетают с Naкатионовой водой ,кислотность нейтрализуется и уменьшается щёлочность обрабатываемой воды до необходимой величины:
H HCO2 CO2 H2O
Регенерация ионитов
Регенерация - это насыщение катионита ионами, при пропускании через фильтр разбавленного раствора серной кислоты. Реагенты, используемые для регенерации ионообменных фильтров, представлены на рис.4.19.
Регенерацию истощённого Н-катионита обычно осуществляют 1,3-1,8% раствором Н2SO4. При большей концентрации Н2SO4 может произойти отрастание зёрен Н-катионита
отложениями сульфата Ca 2 (СаSO4) из-за малой его растворимости (т.е. может произойти «загипсование» угля). В этом случае катионит теряет ионообменную способность. Реакции регенерации Н-катионитовых фильтров:
CaR2 H2SO4 2H / R CaSO4
2NaR H2SO4 2H / R Na2SO4
Регенерация истощенного поваренной соли. Реакции следующей форме:
катионита производится пропуском через него раствора регенерации катионита раствором NaCl можно записать в
R2/Ca2+ + nNa+ = 2R/Na+ + Ca2++ (n-2) Na+
R2/Mg2+ + nNa+ = 2R/Na+ + Mg2++ (n-2) Na+
где n - избыток NaCl против его стехиометрического количества.
166

Рис.4.19. Регенерация ионитов.
Так для регенерации используют технические реагенты, содержащие посторонние примеси (в нашем случае Ca2+ и Mg2+), то хорошо регенерировать фильтр не удается. Кроме того, качество регенерации существенно зависит от появления, так называемого противоионного эффекта. При ограниченном расходе соли на регенерацию лучше будут восстановлены участки слоя катионита, встречающиеся со свежим раствором. По мере прохождения раствора вглубь слоя условия регенерации будут ухудшаться вследствие повышения ионов Ca2+ и Mg2+ в регенерационном растворе и его обеднения по ионам Na+. Это явление носит название противоионного эффекта. Такой эффект возникает и в процессе умягчения исходной воды. Если регенерационный раствор и вода проходят слой катионита в одном направлении, то говорят о прямоточной регенерации.
4.3.4. Дегазация
Дегазация - процесс удаления из воды растворенных в ней газов (углекислый газ,
кислород, сероводород, хлор, реже метан), обуславливающих или усиливающих коррозионные свойства воды, придающие ей неприятный запах. Выбор метода дегазации определяется в основном видом и содержанием удаляемого газа в исходной воде.
В практике водоподготовки известны следующие методы дегазации воды, в основу классификации которых положен принцип воздействия на обрабатываемую воду:
физический
изменение температуры воды или парциального давления удаляемого газа;
отдувка или аэрация
химический
связывание растворенных газов путем добавления реагентов;
удаление кислорода с помощью гидразина
Гидразин применяется только как средство удаления кислорода остающегося после основного дегазационного устройства
биохимический - использование окислительной способности микроорганизмов;
сорбционно-обменный - извлечение удаленных газов путем фильтрования через сорбционно-обменные материалы
167
Термическая деаэрация универсальна по отношению к отдельным газам, присутствующим в воде. Она обеспечивается в условиях парообразования воды или водяного пара.
Гидразин-гидрат N2H4*H2O – бесцветная жидкость, легко поглощает воду, углекислый газ и кислород из воздуха. Гидразин-гидрат хорошо растворим в воде и спирте, обладает сильными восстановительными свойствами, токсичен.
Реакции между гидразином и водой протекают с образованием иона гидразония N2H5+
N2H4+H2O=N2H5++ OH-
Растворы гидразина в воде обладают основными свойствами. При повышенных температурах гидразин разлагается с образованием аммиака и азота.
3N2H4=4NH3+N2, или
3N2H4=2NH3+3H2+2N2
С повышением температуры увеличивается интенсивность реакции разложения гидразина. С повышением рН термическое разложение гидразина замедляется.
Гидразин вводят в конденсат, что позволяет снижать коррозию сталей, но не влияет на концентрацию кислорода. При вводе гидразина в конденсатно-питательный тракт происходят реакции:
6Fe2O3+N2H4=N2+2H2O+4Fe3O4
2Fe3O4+N2H4+4H2O=N2+6Fe(OH)2
2Cu2O+N2H4=N2+2H2O+4Cu
2CuO+N2H4=N2+2H2O+2Cu
При введении его в воду происходит связывание кислорода и выделение инертного азота:
N2H4 + O2 = 2H2O + N2.
Применяются химические и физические методы дегазаций воды.
Сущность химических методов заключается в использовании определенных реагентов, которые связывают растворенные в воде газы. Например, обескислороживание воды может быть достигнуто путем введения в нее сульфита натрия, сернистого газа или гидразина. Сульфит натрия при введении его в воду окисляется растворенным в воде кислородом до сульфата натрия:
2Na2SO3 + О2 = 2Na2SO4.
В случае применения сернистого газа образуется сернистая кислота:
SO2 + Н2О = H2SO3,
Затем сернистая кислота кислородом, растворенным в воде, окисляется до серной кислоты:
2H2SO3 + O2 = 2H2SO4.
168
Химическим реагентом, при помощи которого удается достичь практически полного обескислороживания воды, является гидразин. Последний химический способ обескислороживания воды является наиболее совершенным, но вместе с тем и наиболее дорогим ввиду высокой стоимости гидразина. Поэтому этот способ применяют в основном для окончательного удаления кислорода из воды после физических методов ее обескислороживания.
Примером химического метода удаления из воды сероводорода может служить обработка воды хлором:
H2S + Cl2 = S + 2HC1;
H2S + 4С12 + 4Н2О = H2SO4 + 8HC1
Эти реакции (так же как промежуточные реакции образования тиосульфатов и сульфитов) протекают параллельно в определенных соотношениях, зависящих в первую очередь от дозы хлора и рН воды. Химическим методам газоудаления свойственны следующие недостатки:
а) необходимость применения реагентов, усложняющих и удорожающих процесс обработки воды;
б) возможность ухудшения качества воды при нарушении дозировки реагентов. Вследствие этого химические методы газоудаления применяются значительно реже физических.
Физические методы удаления из воды растворенных газов могут осуществляться двумя способами:
1)вода, содержащая удаляемый газ, приводится в соприкосновение с воздухом, если парциальное давление удаляемого газа в воздухе близко к нулю;
2)создаются условия, при которых растворимость газа в воде становится близкой к нулю.
При помощи первого способа, т. е. при помощи аэрации воды, обычно удаляются свободная углекислота и сероводород, поскольку парциальное давление этих газов в атмосферном воздухе близко к нулю.
Ко второму способу обычно приходится прибегать при обескислороживании воды, так как при значительном парциальном давлении кислорода в атмосферном воздухе аэрацией воды кислород из нее удалить нельзя. Для удаления из воды кислорода ее доводят до кипения, при котором растворимость всех газов в воде падает до нуля. Вода доводится до кипения либо ее нагреванием (термические деаэраторы), либо путем понижения давления до такого значения, при котором вода кипит при данной ее температуре (вакуумные дегазаторы)
Деаэрационная колонна состоит из корпуса, кольцевого приемного короба, смесительного устройства, верхнего и нижнего блоков, колекторов подвода греющего пара и горячих потоков дренажей.
Корпус представляет собой стальной цилиндр (рис.4.20.) сварной конструкции с внутренним диаметром 2408 мм, изготовленный из листовой стали толщиной 12 мм, к которому приварена сферическая крышка. Корпус колонки приварен к деаэраторному баку (14). В верхней части корпуса расположен кольцевой приемный короб (2) для приема холодных потоков конденсата. Внутренняя обечайка короба в нижней части имеет прямоугольные окна, через которые конденсат поступает в смесительное устройство. Смесительное устройство (3) предназначено для смешения холодных потоков конденсата, равномерного распределения их по периметру колонки и представляет собой короб, образованный
169
