
Тут есть жесткость воды
.pdfповышать температуру для эндотермической реакции;
повышать давление в реакциях, идущих с уменьшением объёма (числа моль газообразных веществ);
понижать давление в реакциях, идущих с увеличением объёма (числа моль газообразных веществ);
повышать концентрацию исходных реагентов;
снижать концентрацию продуктов реакции.
Необходимо также учитывать, что для смещения равновесия следует менять (когда это возможно) одновременно несколько факторов, приводящих к увеличению выхода продукта.
3.4.СКОРОСТЬ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
Цель любого химико-технологического процесса состоит в том, чтобы получить целевой продукт из имеющегося сырья с возможно более низкой себестоимостью. Для этого необходимо обеспечить минимальные расходные коэффициенты сырья, материалов, электроэнергии, воды, топлива. Для снижения расходных коэффициентов сырья технологический процесс необходимо вести так, чтобы степень превращения, выход целевого продукта и селективность (для сложных реакций) были возможно более высокими и достигались в возможно более короткое время, т.е. скорость процесса должна быть возможно более высокой. Это объясняется тем, что скорость характеризует интенсивность процесса, а интенсивность является одним из основных показателей, определяющих экономичность химического производства. Поэтому окончательный выбор условий можно сделать только после изучения кинетики процесса, которая изучает вопросы скорости химических превращений. Учитывая кинетику процесса, можно выбрать такие условия, при которых реакция будет протекать не только с высоким выходом продукта, но и с большой скоростью.
Для химической технологии важен конечный результат кинетических исследований - конкретный вид уравнения, позволяющего рассчитывать скорость химической реакции при различных условиях ее проведения. Кинетические уравнения, содержащие необходимую информацию об основных закономерностях химических превращений, являются первоосновой математической модели химического реактора. Без знания кинетических закономерностей невозможно правильно выбрать тип реактора и рассчитать его конструктивные размеры.
Вопросы изучения кинетики химических реакций, определения кинетических параметров подробно рассматриваются в руководствах по физической химии и химической кинетике. Здесь основное внимание будет обращено на практические приложения результатов кинетических исследований.
3.4.1. Скорость гомогенных химических реакций
Скорость химической реакции – это изменение концентрации одного из реагентов или продуктов реакции в единицу времени в единице объёма.
Скорость реакции υ принято выражать количеством (моль) n одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени τ в единице реакционного пространства.
90

Для гомогенной химической реакции
(3.36)
где V – реакционный объём.
Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции. Она всегда положительна, поэтому знак перед производной dni/dτ определяется тем, является ли вещество исходным реагентом (тогда dni/dτ отрицательна) или продуктом (тогда dni/dτ положительна).
Если реакция протекает при постоянном объёме, скорость определяют как изменение молярной концентрации ci в единицу времени:
(3.37)
Рис. 3.1. Типичные кривые изменения концентраций веществ во времени для простых реакций типа А→B (возрастание концентрации продукта и уменьшение концентрации исходного вещества).
Изменение концентрации исходного вещества и продукта реакции в течение процесса характеризуется кривыми, которые различны для простых и сложных реакций (рис. 3.1.). Для простых реакций, протекающих по схеме А→B, концентрация исходного вещества сА уменьшается во времени от начальной сАо до нуля для необратимых процессов и до равновесной сА* для обратимых процессов. Соответственно концентрация продукта сB увеличивается от нуля до соответствующей степени превращения х=1 для необратимых процессов и до концентрации сВ*, соответствующей равновесной степени превращения х* для обратимых процессов.
Если химическая реакция описывается стехиометрическим уравнением
aA + bB → rR + sS
то изменение количеств реагентов и продуктов Δni в результате её протекания связаны между собой соотношениями
Скорости реакции, определённые по изменению количества различных веществ в соответствии с уравнениями (3.36) или (3.37), количественно различаются между собой, если не равны стехиометрические коэффициенты у этих веществ. Для устранения этого неудобства скорость реакции определяют по уравнению:
(3.38.)
где i – стехиометрический коэффициент у вещества, по которому рассчитывают скорость реакции.
91

Тогда скорость приводится к общему знаменателю и независимо от того, по изменению какого конкретного реагента или продукта она определялась, будет численно одинакова, т.е.
Так, скорость реакции
N2(г) + 3H2(г) → 2NH3(г)
может быть выражена соотношением:
Экспериментально скорость химической реакции определяют, изучая изменение во времени концентрации некоторого реагента или продукта.
Численно скорость реакции выражают в единицах концентрации, отнесённых к единице времени, например в кмоль/(м3·ч); моль/(л·с) и т.д.
Большинство химических реакций относится к сложным, т.е. состоит из нескольких элементарных. Скорость таких процессов зависит не только от скорости прямой реакции, но и от скорости обратной и побочных реакций.
Скорости отдельных реакций различаются чрезвычайно сильно. Известны реакции, протекающие очень быстро, например, взаимодействие водорода с хлором на свету, реакции крекинга углеводородов. Другие же реакции, например, окисление железа, идут очень медленно.
92

3.4.2. Влияние различных факторов на скорость химической реакции
Скорость химической реакции зависит от различных факторов, прежде всего от природы реагирующих веществ. Под природой реагирующих веществ понимают тип химических связей в молекулах реагентов, прочность связей, строение кристаллической решётки, строение электронной оболочки атома, прочность связывания внешних электронов и др. Кроме того, на скорость реакции существенно влияют концентрация реагентов, температура, давление, катализатор, степень перемешивания веществ.
Законы химической кинетики основаны на двух принципах (постулатах):
скорость химической реакции пропорциональна концентрациям реагентов;
суммарная скорость нескольких последовательных превращений, широко различающихся по скорости, определяется скоростью наиболее медленной стадии.
Влияние концентрации взаимодействующих веществ
Функциональная зависимость скорости химической реакции от концентраций компонентов
называется кинетическим уравнением реакции.
В химической кинетике принято делить химические реакции на элементарные (одностадийные) и неэлементарные (сложные).
Элементарные реакции связаны с преодолением одного энергетического барьера при переходе от исходных веществ к продуктам реакции. Механизм такой реакции соответствует её стехиометрическому уравнению.
Кинетическое уравнение необратимой элементарной реакции
aA + bB → rR + sS
в соответствии с первым постулатом, основанном на законе действующих масс, имеет вид
(3.39.)
где k – константа скорости химической реакции; a и b – порядки реакции по реагентам соответственно А и В. Их сумма a + b = n называется общим порядком реакции. Для элементарных реакций частные порядки (порядки реакций по отдельным реагентам) равны соответствующим коэффициентам в уравнении реакции.
Сложную реакцию иногда удобно рассматривать как формально простую, т.е. считать, что она протекает в одну, а не в несколько стадий. Так можно поступить, если в условиях рассматриваемой задачи промежуточные продукты не обнаруживаются. Для формально простой реакции
aA + bB + dD → rR + sS + qQ
кинетическое уравнение можно записать в следующем виде:
93

где частные порядки α, β и δ находят экспериментально. В общем случае α≠a, β≠b и δ≠d, т.е. молекулярность и порядок реакции не совпадают.
Наряду с неэлементарными реакциями, которые можно рассматривать как формально простые, существует много сложных реакций, которые явно распадаются на стадии (продукты различных стадий образуются в значительных количествах). Простейшими типами сложных реакций являются параллельные и последовательные. В качестве примера параллельных реакций можно привести окисление аммиака, продуктами которых могут быть или оксид азота (II) NO, или оксид азота (I) N2O , или азот N2. В последовательных реакциях продукт первой реакции является реагентом для второй и т.д. Примером таких реакций могут служить реакции расщепления углеводородов с длинной углеродной цепочкой на более мелкие молекулы.
В случае, если известен механизм сложной реакции (элементарные стадии, через которые она протекает), то
скорость реакции по одному из веществ – её участников – равна алгебраической сумме скоростей тех элементарных стадий, в которых это вещество принимает участие.
Влияние давления
Концентрация вещества, находящегося в газообразном состоянии, увеличивается с повышением давления. Поэтому для реакций, протекающих с участием газообразных веществ, увеличение давления (равнозначное увеличению концентрации) приводит к повышению скорости реакции. Влияние давления увеличивается с возрастанием порядка реакции (υ ~ pn). Всегда благоприятно применение давления для процессов, протекающих с уменьшением газового объёма, так как согласно принципу Ле Шателье – Брауна, повышение давления вызывает увеличение выхода продукта. Повышение давления уменьшает объём газовой смеси, в результате чего снижаются размеры аппаратов и сечения газопроводов. Небольшое повышение давления мало влияет на скорость процессов в жидкой фазе, однако скорости многих реакций в жидкой среде сильно увеличиваются при довольно высоких давлениях. Например, при высоких давлениях (несколько сотен МПа) скорость процессов полимеризации некоторых мономеров увеличивается в десятки раз.
Влияние температуры
Для вступления в реакцию молекулы (атомы, радикалы) реагента должны обладать определённой минимальной энергией, называемой энергией активации.
Энергия активации элементарной реакции Еа – это минимальный избыток энергии над средней внутренней энергией молекул, необходимый для того, чтобы произошло химическое взаимодействие (энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния
реакционной системы в другое).
Рис. 3.2. Энергия активации в экзотермической реакции
Доля активных молекул возрастает при увеличении температуры. Зависимость скорости реакции от температуры описывается уравнением Аррениуса:
94

(3.40.)
где k – константа скорости реакции; ko – предэкспоненциальный множитель (коэффициент, учитывающий частоту соударений, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры).
Химические реакции более чувствительны к изменению температуры в области более низких температур. Согласно правилу Вант Гоффа повышение температуры на 10 градусов увеличивает скорость реакции в 2-4 раза.
Чем выше энергия активации реакции, тем более чувствительна она к изменениям температуры.
Для сложных реакций увеличение температуры не только повышает их скорость, но и меняет ход процесса. Рассмотрим это на примере параллельных реакций:
А→ В (целевая реакция)
А→ D (побочная реакция)
Если энергия активации целевой реакции превышает энергию активации побочной реакции, то с ростом температуры скорость целевой реакции будет расти быстрее, чем скорость побочной реакции. Таким образом, при повышении температуры выход продукта В (за определённый период времени) возрастёт больше, чем выход продукта D, т.е. изменится соотношение между содержанием конечных продуктов B и D, или что тоже самое, увеличится селективность процесса. Наоборот, если энергия активации целевой реакции меньше, чем энергия активации побочной реакции, то для увеличения селективности температуру нужно понижать. Это необходимо учитывать, когда стремятся повысить выход того или иного продукта в сложной реакции.
Рассмотрим, почему нагревание вызывает столь значительное ускорение химических превращений. Взаимодействие частиц делится на два этапа: активация и собственно превращение.
Активация – это сообщение частицам такого количества энергии, что при их соударении происходит разрыхление связей и образование веществ в активированном состоянии.
Превращение – образование из веществ в активированном состоянии продуктов реакции.
Переходное состояние (активированный комплекс) – группировка атомов, участвующих в элементарном акте химической реакции в момент преодоления системой энергетического барьера, разделяющего её начальное и конечное состояния.
Протекание элементарного акта может быть рассмотрено на примере газовой бимолекулярной реакции
A2 + B2 → 2AB
Образование активированного комплекса требует затраты энергии (рис. 3.3.).
95
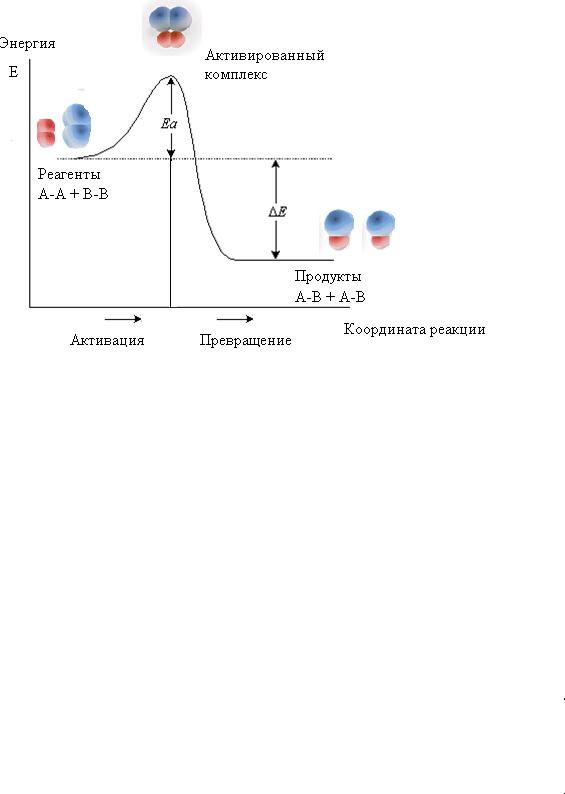
Рис. 3.3. Энергетическая диаграмма бимолекулярной реакции
Энергия активации является тем фактором, посредством которого на скорость реакции влияет природа реагирующих веществ. Для одних реакций она мала, для других - велика.
Если Еа < 40 кДж/моль, то бóльшая часть столкновений между частицами реагирующих веществ приводит к реакции. Скорость таких реакций велика, реакция протекает практически мгновенно.
Если Еа > 120 кДж/моль, то лишь очень малая часть столкновений между частицами приводит к реакции. Скорость таких реакций мала.
Если значение энергии активации находится в интервале 40 < Еа < 120 кДж/моль, то реакция протекает с вполне измеримой скоростью.
Таблица 3.2. Энергия активации реакций
Скорость реакции |
Значение энергии активации |
|
Примеры |
|
Медленные реакции |
Еа > 120 кДж/моль |
|
С2Н4 + Н2 → С2Н6, |
|
|
|
|
Ea = 180,5 кДж/моль |
|
|
|
|
|
|
Реакции со средней |
40 < Еа < 120 кДж/моль |
|
N2O4 → 2NO2 |
|
скоростью |
|
|
Ea = 54,4 кДж/моль |
|
Быстрые реакции |
Еа < 40 кДж/моль |
|
NO + Cl2 → 2NOCl |
|
|
|
|
Ea = 15,5 кДж/моль |
|
|
|
|
|
|
|
|
|
Реакции между ионами |
|
Таким образом, реагировать будут только те молекулы, энергия которых для этого достаточна. Такие молекулы называются активными. Энергия активации Еа [кДж/моль]– энергия, которую нужно сообщить молекулам, чтобы превратить их в активные. Чем меньше энергия активации, тем больше скорость, и наоборот. Чем больше в системе активных молекул, тем скорость реакции больше. Один из путей увеличения числа активных молекул
– нагревание.
96

Следует отметить, что для реакции между двумя молекулами с достаточной энергией активации необходима их определенная взаимная ориентация при соударении. Этот фактор действует во многих случаях, особенно при реакциях между сложными молекулами. Необходимость ориентации может заметно тормозить даже сравнительно простые реакции. Хорошо изученным примером является реакция H2 + I2 2HI. Реакция происходит при простом соударении молекулы водорода и молекулы иода с одновременным образованием двух молекул иодоводорода. Однако, для того, чтобы такое простое соударение привело к образованию продукта, надо, чтобы ориентация молекулы была сходна с той, которая изображена на рис.3.4.а.
Рис. 3.4. Благоприятная (а) и неблагоприятная (б, в) ориентация молекул водорода и иода при столкновении.
Энергия активации этой реакции невелика, но скорость довольно мала. Это вызвано сравнительно жесткими геометрическими требованиями.
Влияние катализатора
Из уравнения Аррениуса (3.5) видно, что принципиально возможен ещё один путь управления скоростью химической реакции – изменение величины энергии активации.
Высота энергетического барьера тесно связана с механизмом реакции. Если изменить путь реакции, направив её к конечным продуктам через некоторые новые промежуточные комплексы, то можно изменить и значение энергии активации. Такой путь возможен при применении катализаторов (рис. 3.5.).
Катализаторы могут не только ускорять химическую реакцию, но и направлять ход реакции. Например, из оксида углерода СО и водорода Н2 в зависимости от применённого
катализатора можно получить различные Рис.3.5.Энергетическая диаграмма вещества: метанол, жидкие углеводороды. некаталитической и каталитической
реакции
97
3.5.ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ГОМОГЕННЫХ ПРОЦЕССОВ
3.5.1. Характеристика гомогенных химических процессов
Гомогенные процессы, т.е. процессы, протекающие в однородной среде, сравнительно редко встречаются в промышленности. Чисто гомогенную систему получить трудно, так как любое вещество содержит следы различных примесей, находящихся в другой фазе. Например, воздух из-за наличия в нём пылинок, капелек влаги и т.п. является гетерогенной средой. Поэтому лишь условно можно принять за гомогенные те процессы, которые протекают в газовой или жидкой фазе.
В гомогенных системах реакции, как правило, проходят гораздо быстрее, чем в гетерогенных. Для гомогенизации системы в промышленности нередко используют поглощение газов жидкостями, конденсацию паров, растворение или плавление твёрдых материалов и получают, таким образом, жидкую среду, в которой быстро протекают реакции. Иногда применяют испарение жидкостей или выделение из них в газовую фазу нужных компонентов и проводят реакции в газовой фазе. Так проводят многие реакции синтеза (полимеризация, обмен, присоединение, замещение), разложения (крекинг, пиролиз) и некоторые другие.
Гомогенные процессы в газовой фазе широко используют в технологии органических веществ и горении газообразного (парообразного) топлива. Гомогенно в газообразной фазе осуществляют хлорирование углеводородов для получения органических растворителей, ядохимикатов и разнообразных продуктов органического синтеза. В производстве моющих средств используется сульфохлорирование, т.е. одновременное действие оксида серы (IV) SO2 и хлора Cl2 на предельные углеводороды. Эта реакция также осуществляется в газовой фазе. Гомогенно в жидкой или паровой фазе осуществляют процессы нитрования. В газовой фазе протекают процессы пиролиза природных газов, нефтепродуктов.
Гомогенные процессы в жидкой фазе характеризуются большей интенсивностью, чем в газовой. В качестве примеров процессов, идущих в жидкой фазе, можно привести процессы нейтрализации водного раствора кислоты водным раствором щёлочи в технологии минеральных солей, образование сложных эфиров, процессы гидролиза. Жидкофазная полимеризация в растворах применяется в производстве органического стекла, лаков и некоторых смол.
3.5.2. Скорость гомогенных процессов
При проведении гомогенных процессов химические реакции протекают во всём объёме реакционной смеси. Если реагенты хорошо перемешаны, то диффузия не лимитирует общей скорости процесса. Гомогенные процессы, как правило, идут в кинетической области, т.е. общая скорость процесса определяется скоростью химической реакции.
Как было сказано выше (раздел 3.4.2.), на скорость химической реакции влияют:
природа реагирующих веществ;
концентрация реагентов;
температура;
давление (для процессов, протекающих в газовой фазе).
Влияние концентрации реагентов. Количественно скорость реакции описывается законом действующих масс:
98

Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ с учётом коэффициентов уравнения реакции. Скорость реакции и концентрации связывает кинетическое уравнение.
Для необратимой элементарной реакции
aA + bB → rR + sS
кинетическое уравнение имеет вид
(3.41.)
где k – константа скорости химической реакции;
a и b – порядки реакции по реагентам соответственно А и В. Для элементарных реакций порядки реакций по отдельным реагентам равны соответствующим коэффициентам в уравнении реакции.
Скорость гомогенных процессов зависит от концентраций тех реагирующих веществ, которые входят в наибольшем количестве в уравнение реакции. Например, для реакции
2A + B → R
кинетическое уравнение можно записать как
Повышение концентрации вещества В в 3 раза увеличивает скорость реакции тоже в 3 раза (31=3), а повышение концентрации вещества А в 3 раза позволяет повысит скорость реакции в 9 раз (32=9).
Влияние температуры. Температура оказывает сильное влияние на скорость химических реакций: с нагреванием скорость большинства реакций возрастает. Так, синтез воды из водорода и кислорода
2H2 + O2 → 2H2O
при 20 С не идёт, при 500 С реакция протекает быстрее, а при 700 С осуществляется мгновенно, со взрывом.
При проведении необратимых реакций температура должна быть максимально допустимой (она ограничивается неустойчивостью материалов, разложением продуктов и сырья при повышенных температурах).
Для обратимых эндотермических реакций
С повышением температуры растут равновесный выход продукта и скорость реакции. Поэтому обратимы эндотермические реакции следует проводить при максимально возможной температуре.
Для обратимых экзотермических реакций
99
