
- •1. Статистические закономерности и задачи статфизики.
- •2.2 Вероятность случайного события
- •2.3 Основные теоремы теории вероятностей
- •Теорема сложения вероятностей
- •Теорема умножения вероятностей
- •Формула полной вероятности и формула Байеса
- •2.4 Случайные величины и случайные функции
- •2.5 Функция распределения и плотность распределения случайной величины
- •2.6 Математическое ожидание случайной величины
- •2.8 Законы распределения вероятностей случайных событий и случайных величин
- •Глава 3 Информационная оценка неопределенности и энтропия как мера неопределенности
- •Распределение Бозе-Эйнштейна
- •Распределение Ферми - Дирака
- •Статистическая термодинамика
- •Общее выражение
Общее выражение
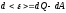 - соответствует
первому началу термодинамики по типу
dA
- соответствует
первому началу термодинамики по типу
dA
Связав
во 2-ом способе
изменение энергии системы (по типу dA)
с изменением её внешних координат
 (объём, поверхность, потенциальное
силовое поле и т.д.), а также силами
(объём, поверхность, потенциальное
силовое поле и т.д.), а также силами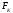 ,
связанными с этими изменениями по
соотношению:
,
связанными с этими изменениями по
соотношению:

где
 - среднее значение
силы
- среднее значение
силы
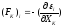 - её (вероятностные
силы) составляющие, связанные с изменением
- её (вероятностные
силы) составляющие, связанные с изменением
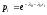 состояния
состояния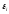 частиц системы при изменении координат
частиц системы при изменении координат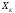 ,
но
,
но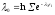 сохранении распределения вероятностей
сохранении распределения вероятностей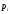 как и в равновесном
как и в равновесном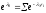 состоянии, т.е. при обратимом
протекании процессов совершения работы(без трения)
состоянии, т.е. при обратимом
протекании процессов совершения работы(без трения)
Тогда

Так
как
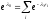 ,
то
,
то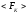 можно записать в виде
можно записать в виде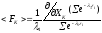
или
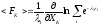 ,
которое согласно уравнению
,
которое согласно уравнению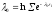 приводится к легко запоминающейся
форме:
приводится к легко запоминающейся
форме:
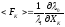
Статическая “средняя” сила в макросистеме идеального газа. Статическое вычисление силы давления и вывод уравнения состояния
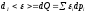 - по первому способу
- по первому способу
Итак, рассматривая
2-ой способ изменения энергии системы
через
совершение работы dA:
 (при сохранении распределения вероятностей
(при сохранении распределения вероятностей и изменении уровней
и изменении уровней )
с изменением её внешних координат
)
с изменением её внешних координат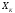 (объёма, поверхности, потенциального
силового поля и т.п.) и действующей
«средней» статической силой
(объёма, поверхности, потенциального
силового поля и т.п.) и действующей
«средней» статической силой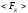 ,
т.е.
,
т.е.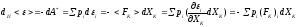
где
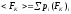 - среднее значение (мат.ожидание)
действующей силы
- среднее значение (мат.ожидание)
действующей силы
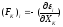 - вероятностные
составляющие этой силы, связанные с
изменением уровней энергии системы
- вероятностные
составляющие этой силы, связанные с
изменением уровней энергии системы
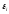 при изменении её внешней координаты
при изменении её внешней координаты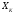 ,
но при сохранении распределения
вероятностей
,
но при сохранении распределения
вероятностей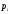 как и в равновесном состоянии, т.е. при
протекании обратимых процессов совершения
работы
как и в равновесном состоянии, т.е. при
протекании обратимых процессов совершения
работы
Поскольку как было показано ранее
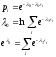
то
для средней силы можно записать
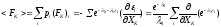 ,
,
Так
как
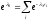 ,
то
,
то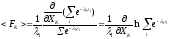
С
учетом равенства
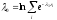 ,
, ,
получим легко запоминающуюся форму для
“средней” действующей силы
,
получим легко запоминающуюся форму для
“средней” действующей силы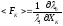 ;
; ,
,
Теперь, рассматривая давление Р в системе идеального газа как среднюю статическую силу, связанную с изменением его объёма V, получим:
 ,
,
где
согласно прежним вычислениям
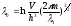 - для одной частицы или
- для одной частицы или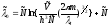 - для 1-го моля частиц с числом частиц -
- для 1-го моля частиц с числом частиц -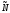
Последнее выражение получено исходя из аддитивности энтропии:
 - для 1-ой частицы,
где
- для 1-ой частицы,
где
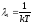
и
 - для 1-го моля
частиц с числом частиц -
- для 1-го моля
частиц с числом частиц -
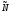 ,
где
,
где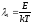
Если
рассматривать систему из неразличимых
частиц, то полная неопределенность
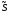 включает в себя такую величину
включает в себя такую величину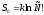 возникающую в следствии того, что
возникающую в следствии того, что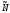 неразличимых частиц могут быть
представлены
неразличимых частиц могут быть
представлены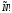 способами, т.е. состояния, которые
отличаются друг от друга только заменой
тождественных частиц на самом деле
неотличимы друг от друга и должны
считаться одним состоянием. Следовательно,
для системы
способами, т.е. состояния, которые
отличаются друг от друга только заменой
тождественных частиц на самом деле
неотличимы друг от друга и должны
считаться одним состоянием. Следовательно,
для системы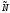 тождественных различимых частиц.
Неопределенность части суммы
тождественных различимых частиц.
Неопределенность части суммы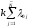 будет меньше чем в случае неотличимых
частиц, т.е. должна быть уменьшена на
будет меньше чем в случае неотличимых
частиц, т.е. должна быть уменьшена на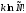 ,
т.к. эта поправка не сказывается на
энергии
,
т.к. эта поправка не сказывается на
энергии .
В результате получим:
.
В результате получим:
 ,
где
,
где

Тогда
для 1-го моля частиц
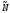 :
:
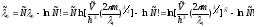
Используя
формулу Стирлинга для
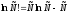 ,
получим
,
получим
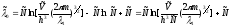
Отсюда
нужная нам производная
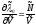 ,
и следовательно
,
и следовательно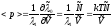 с учетом
с учетом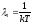
Так
как для 1-го моля вещества
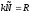 (универсальная
газовая постоянная), то в итоге получаемуравнение
состояния идеального газа в статическом
виде:
(универсальная
газовая постоянная), то в итоге получаемуравнение
состояния идеального газа в статическом
виде:
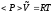
Полученное статическое распределение частиц по энергиям позволяет рассчитать среднее изменение количества движения частиц при их упругом взаимодействии со стенкой, образующей газовый объём V, т.е. рассчитать то, что называется давлением газа.
Для этого вернемся к взаимосвязи энергии и импульса (ограничиваясь движением в одном направлении i, перпендикулярном стенке)
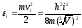 ,
,
причем
вероятность обладания этой скоростью
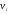 составляет
составляет
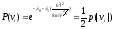 ,
,
Где
учтено, что частица может двигаться
либо вправо, либо влево при одной и той
же абсолютной скорости
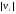 .
.
Так как за промежуток
времени
 частицы находящиеся на расстоянии
частицы находящиеся на расстоянии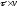 от стенки и имеющие скорость
от стенки и имеющие скорость по направлению, перпендикулярном к ней,
при ударе о неё передающей свой импульс
по направлению, перпендикулярном к ней,
при ударе о неё передающей свой импульс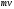 и отскакивают от неё с той же энергией
(той же абсолютной скоростью), тополное
изменение количества движения
в расчете на одну частицу будет равно
и отскакивают от неё с той же энергией
(той же абсолютной скоростью), тополное
изменение количества движения
в расчете на одну частицу будет равно
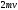 ,
а в расчете на все частицы, находящие в
объёме
,
а в расчете на все частицы, находящие в
объёме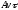 ,
гдеA
–площадь стенки, при их средней плотности
,
гдеA
–площадь стенки, при их средней плотности
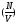 в ограждённом стенкой газовом объёмеV,
составляет:
в ограждённом стенкой газовом объёмеV,
составляет:
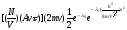
Так как давление
есть сила, равная изменению количества
движения на единицу площади стенки в
единицу времени, то поделив предыдущее
выражение на
 и просуммировав его по всемi,
получим:
и просуммировав его по всемi,
получим:
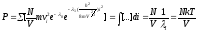
Для
одного моля вещества
 произведение
произведение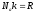 и в итоге получим:
и в итоге получим:
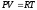 - уравнение состояния
идеального газа
- уравнение состояния
идеального газа
Для одной частицы (на ящик приходится одна частица):
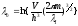
Математическое ожидание энергии:
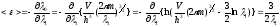
“Острота” распределения вероятностей задается дисперсией:
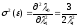
Относительное отклонение (для одной частицы) будет равно:
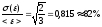 ,
,
т.е.
хотя вероятность выпадения герба при
бросании монеты равна
 ,
предсказание для одного броска довольно
часто может быть ошибочным.
,
предсказание для одного броска довольно
часто может быть ошибочным.
Для N частиц средняя энергия равна энергии одной частицы умноженной на N:

(здесь
использована аппроксимация Стирлинга
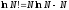 )
)
Дисперсия
для N
частиц:

Относительное
отклонение для N~6*1023
(одного моля вещества):
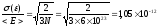
Рассмотрим в общем виде изменении энтропии:
 ,
где
,
где
 ,
,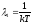 ,
,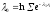
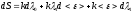
Так как по первому закону термодинамики:
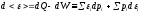

где
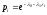 ;
;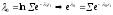 зависит только от
зависит только от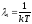 (для первого способа изменения энергии),
а также от внешних условий
(для первого способа изменения энергии),
а также от внешних условий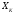 (деформации координаты, объёма,
поверхности, под действием внешней силы
(деформации координаты, объёма,
поверхности, под действием внешней силы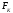 (силового поля) для второго способа
изменения энергии), то в общем случае
можно записать:
(силового поля) для второго способа
изменения энергии), то в общем случае
можно записать:
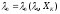 ,
,
т.е.
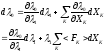

где
 - обозначено некоторое значение силы
- обозначено некоторое значение силы
Тогда для общего изменения энтропии получим:
 - второе начало
термодинамики, где
- второе начало
термодинамики, где
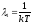 ,
,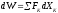 ,
,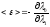
Константу K, которая в своё время была введена как произвольная постоянная в неопределенности S положим равной постоянной Больцмана K=k, тогда получаем второй закон термодинамики:
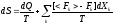
- физическая энтропия, связанной с (теплообменом) передачей теплоты dQ и производством работы dA при температуре системы T.
Это выражение позволяет физически оценить меру неопределенности информационной энтропии, с помощью измерения некоторых физических параметров
Есть ещё одна интересная интерпретация энтропии как меры неопределенности, известная как третий закон термодинамики
Как следует из
информационного определения энтропии: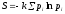
при условиях:
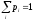
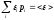
вероятность
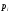 являются функцией
являются функцией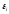 иT,
т.е.
иT,
т.е.
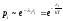 (без переноса частиц вещества т.е.
учитывая
(без переноса частиц вещества т.е.
учитывая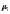 )
)
Рассмотрим
отношение вероятностей двух состояний
с энергиями
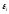 и
и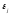 :
:
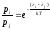
и
проанализируем, что происходит с газом
при уменьшении
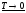 (т.н. вырожденный газ):
(т.н. вырожденный газ):
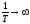 ,
,
 ,
если
,
если
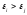
т.е. если температура падает, то только самые нижние энергетические уровни имеют заметную вероятность быть занятыми.
Обозначив
минимальный уровень энергии
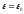 ,
и соответствующую этому состоянию
вероятность
,
и соответствующую этому состоянию
вероятность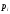 (остальные
(остальные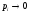 для всех энергетических уровней
для всех энергетических уровней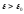 )
)
Если
вероятности этих X
самых энергетически низких состояний
равны, тогда
 - число такихi:
- число такихi:
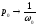
Тогда можно записать:
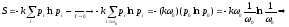
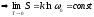 - теорема Нернста
(третье начало термодинамики)
- теорема Нернста
(третье начало термодинамики)
Это соотношение определяет важную связь между физической энтропией и вероятность наиболее предпочтительного энергетического состояния, указанную Больцманом и увековеченную на его могильной плите.
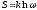 ,
,
 - число состояний
- число состояний
Это утверждение
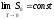 при
при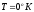 известно кактеорема
Нернста,
согласно которой энтропия газа при T=0
K
является величиной постоянной.
известно кактеорема
Нернста,
согласно которой энтропия газа при T=0
K
является величиной постоянной.
Распределение
частиц при
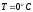 на низких энергетических уровнях в
статистиках Бозе-Эйнштейна и Ферми-Дирака
показаны на рис., где для определения
принято что все
на низких энергетических уровнях в
статистиках Бозе-Эйнштейна и Ферми-Дирака
показаны на рис., где для определения
принято что все
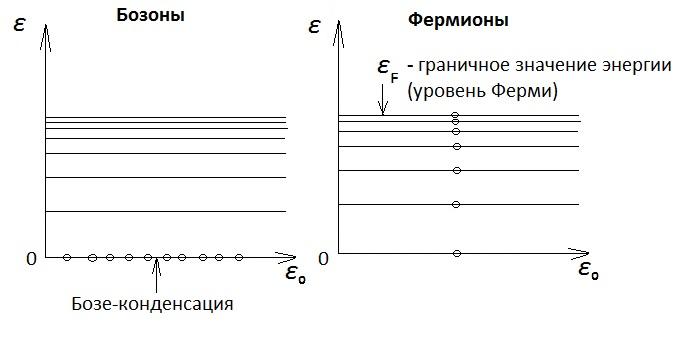
Ферми совпадает с предельным значением химического потенциала
Последнюю
картинку для фермионов можно представить
(изобразить) и в другом виде. В виде
ступенек, отражающие зависимость числа
частиц
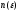 приT=0
приT=0

Если
несколько повысить температуру, то
тепловая энергия
 будет сообщаться вначале только частицам,
имеющим энергию близкую к
будет сообщаться вначале только частицам,
имеющим энергию близкую к .
Поэтому на более высокий уровень могут
перейти только такие частицы, для которых
разность соседних уровней
.
Поэтому на более высокий уровень могут
перейти только такие частицы, для которых
разность соседних уровней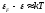 .
Частицы, расположенные на более глубоких
уровнях, не изменят своего состояния.
Таким образом с повышением температуры
происходит “размывание” уровня Ферми
.
Частицы, расположенные на более глубоких
уровнях, не изменят своего состояния.
Таким образом с повышением температуры
происходит “размывание” уровня Ферми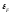 ,
и эта зона размыва имеет ширину порядка
,
и эта зона размыва имеет ширину порядка .
.
