
Кератоконус
.pdfМинистерство здравоохранения и социального развития РФ Государственное образовательное учреждение дополнительного профессионального образования Уральская государственная медицинская академия дополнительного образования
Севостьянов Е.Н., Горскова Е.Н., Экгардт В.Ф.
КЕРАТОКОНУС (этиология, патогенез, медикаментозное лечение)
Учебное пособие
Челябинск 2005
Кафедра офтальмологии, лаборатория контактной коррекции областной клинической больницы
Авторы: Е.Н. Севостьянов – доктор медицинских наук, сотрудник лаборатории контактной коррекции ОКБ, Е.Н. Горскова – доктор медицинских наук, зав. лабораторией контактной коррекции ОКБ, В.Ф. Экгардт – доктор медицинских наук, профессор кафедры офтальмологии УГМАДО.
Рецензент: Рыкун В.С. – зав. курсом глазных Челябинской государственной медицинской академии, доктор медицинских наук.
Для врачей-офтальмологов, слушателей академии, врачей-ординаторов, врачей-интернов
3
Кератоконус - невоспалительное заболевание, которое характеризуется асимметричным прогрессирующим истончением, растяжением, конусовидным выпячиванием и заканчивается помутнением оптической зоны роговицы.
Сегодня большинством ученых признается роль генетических факторов в возникновении конусовидной деформации роговицы. Подтверждением тому служат частое сочетание кератоконуса с некоторыми наследственными заболеваниями и синдромами человека: амавроз Лебера, синдром Крузона и голубых склер, болезнь Элерса-Данлоса, пигментная дегенерация сетчатки, [Mitsui M. et al.,1996; Pouliquen Y. et al,1980; Elder M.J.,1994; Perlman I.M., Zaidman G.W.,1994], а также выявленная семейная концентрация случаев этой патологии органа зрения [Горскова Е.Н.,1998; Driver P.J. et al,1994] с установленными особенностями течения заболевания между монозиготными и дизиготными близнецами [McMahon T.T. et al., 1999].
Кроме того, современными иммуногистохимическими и иммуногенетическими методами в различных популяциях населения установлена взаимосвязь кератоконуса с антигенами главного комплекса гистосовместимости - HLA I (А, В, С) и II (DR) классов [Горскова Е.Н.,1998; Adachi W. et al.,2002], обнаружена повышенная экспрессия генных продуктов - трансмембранной фосфотирозинфосфатазы (LAR) и фактора транскрипции Sp1, имеющих регулирующее влияние на дифференцировку клеток стромы роговицы [Maruyama Y. et al.,2001], что также научно подтверждают наличие определенных генетических основ кератоконуса.
Тип наследования кератоконуса исследователями характеризовался поразному: по аутосомно-рецессивному [Pouliquen Y. et al.,1980], аутосомнодоминантному типу [Rabinowitz Y.S.,1998] и по типу, сцепленному с полом [Jacobs D.S., Dohlman C.H.,1993]. Ученые были едины в одном - кератоконус генетически неоднороден, а его фенотипическое разнообразие означает, что генетический анализ остается сложным процессом и идентификация возможного гена должна продолжаться.
4
Висследованиях на мышах-мутантах, выведенных в имбридинге с проявлениями кератоконуса, Tachibana M. с соавторами, 2002 отметили, что роговицы мышей напоминают таковые у человека с конусовидной дистрофией
изафиксировали аутосомно-рецессивный тип наследования данного заболевания исключительно у мужских особей. Исследователи установили локус предрасположенности к кератоконусу, который располагается на 17 хромосоме мыши в МНС регионе, включающем локус гена пола.
Всвоем другом исследовании на диких японских мышах, имеющих коническую форму роговицы, эти авторы сообщают о выявлении ответственных генов в маркерах D13Mit21, D13Mit252, D13Mt279 и D13Mit39,
которые расположены между 21,9 и 34,0см хромосомы 13. Дополнительно было установлено, что у мышей в эту область включены также гены для катепсинов, интерлейкина и хемотоксина. Эти сведения могут объяснить некоторые патогенетические механизмы кератоконуса у человека.
Внастоящее время исследователями уже выявлены гены, названные “кандидатами”, которым отводится роль ответственности за развитие кератоконуса. Например, ген, кодирующий продукцию коллагена IV типа и связанных протеогликанов [Bochert A. et al., 2003].
Финские ученые [Tyynismaa H. et al.,2002], анализируя генотипы 20 финских семей, установили, что локус кератоконуса картирован в пределах q22.3 – q23.1 региона хромосомы 16q.
Вмарте 2004 года Brancati F. с соавторами сообщили о нахождении локуса аутосомно-доминантного наследования кератоконуса у человека, картированном на хромосоме 3p14-q13; и еще больше убеждают в обоснованности наших заявлений о наследственной обусловленности данной дистрофии роговицы.
Если в семидесятых - восьмидесятых годах прошлого века офтальмологи отмечали начало развития конической деформации роговицы в основном с 11 - 16 лет и очень редко в раннем детстве или после 50 лет [Karseras A.G.,Ruben M., 1972], то в последние десятилетия авторы стали сообщать о расширении
5
возрастного диапазона возникновения данной патологии глаз до 89 лет, а средний возраст начала кератоконуса сместился в пределы 21 - 37 лет
[Карапетян Д.Г.,1992; Горскова Е.Н.,1998; Zadnik K. et al.,1996].
Частота встречаемости кератоконуса, по данным различных исследователей, колеблется от 1:250 до 1:500.000 населения [Горскова Е.Н.,1998; Woodward E.G.,1984; Kennedy R.H. et al.,1986]. Некоторыми авторами отмечена зависимость частоты заболевания от географических факторов - кератоконус чаще встречается в горных местностях южных широт
[Карапетян Д.Г.,1992; Itoi M.,1984].
Сравнительное исследование частоты встречаемости кератоконуса среди населения Урала - Пермской, Свердловской, Челябинской и Оренбургской областей выявило наиболее высокую концентрацию данной патологии в Челябинской области. Анализ заболеваемости кератоконусом в различных районах Челябинской области показал повышенную его частоту в горнозаводских районах, связанных с переработкой радиоактивных веществ [Горскова Е.Н.,1998]. Зарубежные офтальмологи также не исключают влияния окружающей среды на фенотипические проявления кератоконуса, сообщая о значительном росте заболеваемости кератоконусом в радиационнонеблагополучных местностях [Дрожжина Г.И. и др.,1998; Edwards M. et al., 2001].
Необходимо отметить, что выполненные исследователями многочисленные современные эпидемиологические, иммуногенетические, иммунологические и биохимические исследования при кератоконусе значительно расширили и углубили круг наших знаний в вопросах патогенеза заболевания.
Некоторые концепции патогенеза кератоконуса базируются на том, что в основе данного заболевания могут лежать патологические изменения в роговичном эпителии [Somodi S. et al.,1996], боуменовой мембране [Sawaguchi S. et al.,1998], коллагеновых волокнах стромы роговицы [Cheng E.L. et al.,2001],
нарушения синтеза протеогликанов [Wentz-Hunter K. et al.,2001], локальное увеличение протеазной активности [Zhou L. et al.,1998].
6
Одной из последних теорий, представляющих механизм патологических нарушений в роговице при ее деформации была выдвинута генетически запрограммированная гибель (апоптоз) кератоцитов - физиологическое явление, универсально распространенное в различных типах тканей, служащее механизмом поддержания постоянства численности и выбраковки дефектных клеток в организме [Kerr J.F.R. с соавт, 1972].
Такую гипотезу высказали Wilson S.E. с соавт. в 1998 году на 13 международном офтальмологическом конгрессе в Париже. Авторы выдвинули предположение, что хроническое повреждение эпителия нарушает баланс между пролиферацией и апоптозом кератоцитов (фибробластов стромы), запуская их программированную гибель и приводя к росту уровня деградирующих ферментов у генетически чувствительных лиц. Данная гипотеза требовала научных доказательств.
С целью изучения современных патогенетических механизмов конусовидной дистрофии роговицы нами проведено гистологическое исследование 48 роговичных дисков, удаленных при проведении сквозной кератопластики у больных кератоконусом II, III и IV стадий (классификация кератоконуса по Amsler M., дополненная Киваевым А.А. с соавт.,1979). Группу сравнения составили 15 роговичных дисков, взятых в соответствующей зоне глаз у лиц того же возраста, погибших от механических травм.
Дополнительно проведена оценка уровня ФНО-α в слезной жидкости у 49
больных кератоконусом (75 глаз) и в контрольной группе из 15 клинически здоровых молодых людей (15 глаз).
В морфологических исследованиях установлено, что характерным признаком кератоконусных дисков является истончение всей толщины роговицы в центральной зоне конуса (табл.1).
Уменьшение слоя переднего эпителия сопровождалось его вакуольной дистрофией и некробиозом отдельных клеток. Зафиксировано неравномерное утолщение боуменовой мембраны, которая местами отсутствовала. Также
7
Таблица 1. Морфометрические показатели толщины разных слоев роговичных дисков в
центральной зоне в контрольной группе и с кератоконусом
Показатели толщины |
Роговичные диски (количество) |
Р |
|
(мкм) |
|
|
|
контрольные (15) |
с кератоконусом (48) |
|
|
|
|
|
|
|
|
|
|
Общей |
504,4 ± 0,6 |
119,4 ± 0, 2 |
< 0,01 |
|
|
|
|
Переднего эпителия |
48,8 ± 0,2 |
22,4 ± 0,2 |
< 0,01 |
|
|
|
|
Стромы |
449,3 ± 0,4 |
93,3 ± 0,05 |
< 0,01 |
|
|
|
|
характерной особенностью кератоконуса являлись контакты эпителия и стромы роговицы. В истонченной строме отмечено изменение тинкториальных свойств коллагеновых волокон и нарушение ортогонального расположения пластинок.
Использование типоспецифических антител с помощью метода иммунофлюоресценции, позволило установить, что в контрольных и роговичных дисках с кератоконусом локализация типов коллагена была одинаковой: волокна, содержащие коллаген I и III типов были выявлены в собственном веществе роговицы, II типа - в боуменовой и десцеметовой мембранах, а коллаген IV типа – в базальной мембране переднего эпителия.
Полученные сведения подтверждают данные литературы о распределении коллагена в строме роговицы при кератоконусе. Однако коллагены изучаемых типов определялись в значительно меньшем количестве, а в отдельных наблюдениях (роговичных дисках, удаленных у больных с терминальной стадией кератоконуса) не обнаруживались вообще.
В связи с этим была проведена оценка объемной доли волокон, содержащих коллаген I, II, III и IV типов в роговичных дисках с кератоконусом и в контроле
(табл.2).
Установлено, что объемная доля всех четырех изучаемых типов коллагена в роговичных дисках с кератоконусом была снижена от 3,6 до 6,0 раз по сравнению с контролем.
8
Таблица 2. Показатели объемной доли волокон (%), содержащих коллаген I-IV типов
в кератоконусных роговичных дисках и в контроле
Волокна, содержащие |
Роговичные диски (количество) |
Р |
|
тип коллагена |
|
|
|
контрольные (15) |
с кератоконусом (48) |
|
|
|
|
|
|
|
|
|
|
I |
24,3 ± 0,1 |
3,9 ± 0,06 |
< 0,05 |
|
|
|
|
II |
6,8 ± 0,05 |
1,8 ± 0,02 |
< 0,05 |
|
|
|
|
III |
5,4 ± 0,06 |
1,2 ± 0,02 |
< 0,05 |
|
|
|
|
IV |
4,0 ± 0,04 |
1,1 ± 0,02 |
< 0,05 |
|
|
|
|
При оценке распределения протеогликанов и гликопротеинов в строме роговицы при кератоконусе выявили их неравномерное расположение, увеличение межфибриллярных промежутков, а объемная доля основного вещества, содержащего гликозаминогликаны, была в 2 раза меньше, чем в контроле.
Такие данные свидетельствуют о значительном нарушении динамического равновесия между биосинтезом и катаболизмом коллагена, патологическом изменении структуральной и регулирующей функции гликозаминогликанов в фибриллогенезе. Подобные процессы приводят к активизации процесса распада основных типов коллагенов, истончению всех слоев и снижению биомеханической прочности роговицы, что влечет за собой ее растяжение и конусовидное выпячивание, клинически проявляющееся в прогрессирующем снижении остроты зрения.
Усилению катаболизма коллагенов способствуют нейтральные лизосомальные и протеолитические ферменты, в том числе кислая фосфатаза, неспецифическая эстераза, коллагеназа и множество других, которые осуществляют в организме гидролиз различных типов мукополисахаридов, включая многочисленные гликопротеиныипротеогликаны[СеровВ.В., ШехтерА.Б.,1981].
9
Впервые в непрямой реакции иммунофлюоресценции была изучена активность коллагеназы в строме контрольных роговичных дисков и при кератоконусе, а также лизосомных ферментов – кислой фосфатазы и неспецифической эстеразы в кератоцитах (фибробластах роговичной стромы) и макрофагах собственного вещества роговиц с кератоконусом. Также определено процентное содержание клеток с сильной активностью данных ферментов (табл.3). При этом активность ферментов оценивалась по общепринятым критериям: а).активность отсутствует, б).очень слабая, в).слабая, г).умеренная, д).сильная, е).очень сильная.
Таблица 3. Показатели объемной доли клеточных элементов (%) с сильной активностью
ферментов в контрольных роговичных дисках и с кератоконусом
Клеточные элементы с |
Роговичные диски (количество) |
Р |
||
сильной активностью |
|
|
||
контрольные |
с кератоконусом |
|||
|
||||
фермента |
(15) |
(48) |
|
|
|
|
|
|
|
|
|
|
|
|
Кислой фосфатазы |
0 |
10,0 ± 0,1 |
< 0,01 |
|
|
|
|
|
|
Неспецифической эстеразы |
0 |
9,6 ± 0,1 |
< 0,01 |
|
|
|
|
|
|
Коллагеназы |
5,3 ± 0,2 |
10,6 ± 0,2 |
< 0,05 |
|
|
|
|
|
|
В срезах роговичных дисков, взятых от больных кератоконусом, объемные доли клеток с сильной активностью кислой фосфатазы и неспецифической эстеразы составляли в среднем по 10,0%. В то же время в контроле объемная доля кератоцитов с сильной активностью протеаз не определялась вообще.
Объемная доля коллагеназы в строме роговицы при кератоконусе была в 2 раза выше, чем в норме.
Из литературы известно, что чувствительность коллагенов I типа к коллагеназе в 5 раз выше, чем у коллагенов II типа и в 15 раз выше, чем у коллагенов III типа [Weiss J.,1976]. Это подтверждается, полученными нами,
10
данными морфометрии - повышение активности коллагеназы в 2 раза влечет за собой 6-кратное снижение объемной доли коллагена I типа при кератоконусе.
Одним из механизмов происходящего процесса прогрессирующего катаболизма коллагена и основного вещества в роговице при кератоконусе может являться преобладание генетически программированной смерти
(апоптоза) кератоцитов над их пролиферацией, которое клинически будет проявляться истончением, а затем конусовидным выпячиванием роговицы.
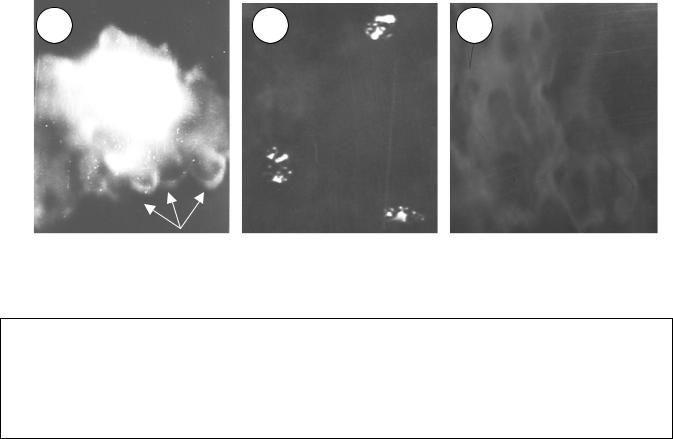
Впервые в непрямой реакции иммунофлюоресценции были исследованы морфологические признаки апоптоза кератоцитов при кератоконусе (рис.1а - 1в.), Кроме того, проведен анализ экспрессии рецептора Fas/АРО-1/CD95, с
основной функцией - индукцией апоптоза и, который конституитивно экспрессируется на поверхности многих клеток, несущих рецептор и чувствительных к данным сигналам. К числу таких клеток относятся и кератоциты (фибробласты стромы), отвечающие за синтез коллагена и ГАГ в роговице.
а |
б |
в |
Рис.1.МорфологическаяхарактеристикаCD95 иапоптозавроговицебольных кератоконусом(а, б) игруппысравнения(в). Реакцияиммунофлюоресценции.
a - апоптоз кератоцита. × 630; б - экспрессия CD95 в кератоцитах. × 160;
в - отсутствие экспрессии CD95 в собственном веществе нормальной роговицы. × 200.
11
