
- •Экзаменационные вопросы/ответы на экзамен по биохимии для стоматологического факультета 2012 года
- •1. Биохимия, ее задачи. Значение биохимии для медицины. Современные биохимические методы исследования.
- •2. Аминокислоты, их классификация. Строение и биологическая роль аминокислот. Хроматография аминокислот.
- •Фолдинг белка. Шапероны.
- •4. Электро-химические свойства белков как основа методов их исследования. Электрофорез белков крови.
- •5. Принципы классификации белков. Характеристика простых белков. Характеристика гистонов и протаминов.
- •6. Хромопротеины. Строение и функции гемоглобина. Типы гемоглобинов. Миоглобин.
- •7. Углевод-белковые комплексы. Строение углеводных компонентов. Гликопротеины и их протеоглиганы.
- •8. Современные представления о структуре и функциях нуклеиновых кислот. Первичная и вторичная структуры днк. Строение мономеров нуклеиновых кислот
- •9. Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его строение. Роль металлов в ферментативном катализе, примеры.
- •10. Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов.
- •11. Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз. Примеры реакций с участием оксидоредуктаз
- •12. Современные представления о механизме действия ферментов. Стадии ферментативной реакции, молекулярные эффекты, примеры.
- •13. Ингибирование ферментов. Конкурентное и неконкурентное ингибирование, примеры реакций. Лекарственные вещества как ингибиторы ферментов.
- •3.Субстратное ингибирование
- •15. Обмен веществ и энергии. Этапы обмена веществ. Общий путь катаболизма. Катаболизм пирувата.
- •16. Цитратный цикл, его биологическое значение, последовательность реакций.
- •22. Сопряжение реакций цикла трикарбоновых кислот с дыхательной цепью ферментов. Написать эти реакции.
- •17.Современные представления о биологическом окислении. Над-зависимые дегидрогеназы. Строение окисленной и восстановленной форм над.
- •18. Компоненты дыхательной цепи и их характеристика. Фмн и фад-зависимые дегидрогеназы. Строение окисленной и восстановленной форм фмн.
- •20. Пути синтеза атф. Субстратное фосфорилирование (примеры). Молекулярные механизмы окислительного фосфорилирования (теория Митчелла). Разобщение окисления и фосфорилирования.
- •1.Мембрана митохондрий не проницаема для протонов.
- •2.Образуется протонный потенциал в процессе транспорта электронов и протонов.
- •3.Обратный транспорт протонов в матрикс сопряжен с образованием атф.
- •21. Потребность человека в белках. Незаменимые аминокислоты. Биологическая ценность белков. Роль белков в питании.
- •22.Превращение белков в органах пищеварительной системы.
- •23. Гниение белков и аминокислот в кишечнике. Пути образования продуктов гниения. Примеры.
- •24. Механизм обезвреживания продуктов гниения белков. Роль фафс и удф-гк в этом процессе (конкретные примеры).
- •25. Переаминирование и декарбоксилирование аминокислот. Химизм процессов, характеристика ферментов и коферментов. Образование амидов.
- •26.Декарбоксилирование аминокислот,роль витамина в6.Образование биогенных аминов
- •27. Дезаминирование аминокислот. Виды дезаминирования. Окислительное дезаминирование. Непрямое дезаминирование аминокислот на примере тирозина.
- •28. Синтез мочевины (орнитиновый цикл), последовательность реакций. Биологическая роль.
- •29. Особенности обмена пуриновых нуклеотидов. Их строение и распад. Образование мочевой кислоты. Подагра.
- •30.Генетический код
- •31. Механизмы репликации днк (матричный принцип, полуконсервативный способ). Условия, необходимые для репликации. Этапы репликации
- •32. Биосинтез рнк (транскрипция). Условия транскрипции.
- •33.Этапы транскрипции
- •34. Биосинтез белка. Этапы трансляции и их характеристика. Белковые факторы биосинтеза белка. Энергетическое обеспечение биосинтеза белка.
- •35. Строение оперона. Регуляция биосинтеза белка у прокариотов. Функционирование лактозного и гистидиновых оперонов.
- •36. Особенности и уровни регуляции биосинтеза белка у эукариотов. Амплификация генов, энхансерные и сайленсерные элементы.
- •38. Виды молекулярных мутаций и их метаболические последствия.
- •39. Основные углеводы организма человека, их строение и классификация, биологическая роль.
- •40. Роль углеводов в питании. Переваривание и всасывание углеводов в органах пищеварительной системы. Написать реакции. Непереносимость дисахаридов.
- •41. Биосинтез и распад гликогена в тканях. Биологическая роль этих процессов. Гликогеновые болезни.
- •42. Катаболизм глюкозы в анаэробных условиях. Химизм процесса, биологическая роль.
- •43. Катаболизм глюкозы в тканях в аэробных условиях. Гексозодифосфатный путь превращения глюкозы и его биологическая роль. Эффект Пастера.
- •44. Гексозомонофосфатный путь превращения глюкозы в тканях и его биологическая роль.
- •45. Пути образования глюкозы в организме. Глюконеогенез. Возможные предшественники, последовательность реакций, биологическая роль.
- •46. Характеристика основных липидов организма человека, их строение, классификация, суточная потребность и биологическая роль.
- •47. Биологическая ценность липидов пищи. Переваривание, всасывание и ресинтез липидов в органах пищеварительной системы.
- •48. Характеристика липопротеинов крови, их биологическая роль. Роль липопротеинов в патогенезе атеросклероза Коэффициент атерогенности крови и его клинико- диагностическое значение.
- •49. Окисление высших жирных кислот в тканях. Окисление жирных кислот с нечетным числом углеродных атомов, энергетический эффект.
- •66. Окисление глицерина в тканях. Энергетический эффект этого процесса.
- •67. Биосинтез высших жирных кислот в тканях. Биосинтез жиров в печени и жировой ткани.
- •51. Холестерол. Его химическое строение, биосинтез и биологическая роль. Причины гиперхолестеринемии.
- •78. Витамин в6 и pp. Роль в обмене аминокислот, примеры реакций, строение.
- •82. Биотин, пантотеновая кислота, их роль в обмене веществ.
- •55. Механизм действия липофильных сигнальных молекул. Механизм действия nо. Действие сигнальных молекул через тирозинкиназные рецепторы. Принципы иммунноферментного анализа уровня сигнальных молекул.
- •57. Гормоны передней доли гипофиза, классификация, их химическая природа, участие в регуляции процессов метаболизма. Семейство пептидов проопиомеланокортина.
- •58. Гормоны задней доли гипофиза, место их образования, химическая природа, влияние на функции органов-мишеней.
- •59. Инсулин, схема строения, участие в регуляции метаболических процессов. Специфика в действии на рецепторы органов мишеней, инсулиноподобные факторы роста (ифр)
- •61. Тиреоидные гормоны, место их образования, строение, транспорт и механизм действия на метаболические процессы.
- •62. Тиреокальцитонин, паратиреоидный гормон. Химическая природа, участие в регуляции обмена веществ.
- •91. Глюкагон и соматостатин. Химическая природа. Влияние на обмен веществ.
- •63. Участие адреналина в регуляции обмена веществ. Место выработки. Структура адреналина,механизм его гормонального действия, метаболические эффекты.
- •64. Кортикостероидные гормоны. Структура, механизм действия, их роль в поддержании гомеостаза. Участие глюкокортикоидов и минералокортикоидов в обмене веществ.
- •65. Гормоны половых желез: эстрадиол и тестостерон, их строение, механизм действия и биологическая роль.
- •95. Простаноиды - регуляторы обмена веществ. Биологические эффекты простаноидов и химическая природа.
- •66. Межклеточный матрикс, его компоненты, функции. Характеристика коллагена, его строение. Полиморфизм коллагеновых белков.
- •67. Этапы синтеза и созревания коллагена. Роль ферментов и витаминов в этом процессе. Катаболизм коллагена.
- •68. Особенности строения и функции эластина. Неколлагеновые структурные белки: фибронектин и ламинин.
- •69. Гликозаминогликаны. Строение, функции.
- •70. Протеогликаны межклеточного матрикса, их состав, функции. Образование надмолекулярных комплексов. Метаболизм протеогликанов.
17.Современные представления о биологическом окислении. Над-зависимые дегидрогеназы. Строение окисленной и восстановленной форм над.
1. Биологическое окисление есть процесс переноса электронов. То вещество, что отдаёт электроны, окисляется, то, что принимает, восстанавливается. Биологическое окисление предполагает ДЕГИДРИРОВАНИЕ с образованием воды.
Если
водород взаимодействует с кислородом
с образованием воды вне организма, то
это сопровождается взрывом.![]()
2. Биологическое окисление - это процесс многоступенчатый - многоступенчатая передача электронов с постепенным выделением энергии, что исключает взрыв.
3. Биологическое окисление - это процесс, требующий много ферментов. Этот комплекс ферментов называется ЦЕПЬЮ ПЕРЕНОСА ЭЛЕКТРОНОВ (ЦПЭ), или дыхательной цепью. ЦПЕ - своеобразный КОНВЕЕР по переносу электронов и протонов от субстрата к кислороду.
НАД-зависимые дегидрогеназы. В качестве кофермента содержат НАД и НАДФ. Пиридиновое кольцо никотинамида способно присоединять электроны и протоны водорода.
СТРОЕНИЕ КОМПОНЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ.
НАД НАДФ.
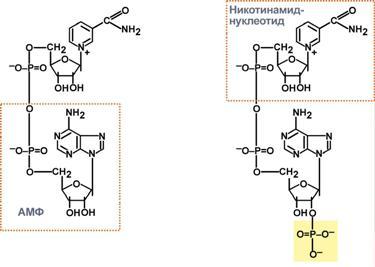
Рабочей частью является витамин РР - НИКОТИНАМИД
(ДОПОЛНИТЕЛНЬО) Альтернативные пути биологического окисления, оксигеназный путь. Микросомальные монооксигеназы.
В организме возможен и ОКСИГЕНАЗНЫЙ путь биологического окисления. Он не снабжает клетку энергией. Ферменты этого пути включают кислород и субстрат.
Стадии ОКСИГЕНАЗНОГО ПУТИ:
1.Связывание кислорода с активным центром фермента.
2.Восстановление кислорода и перенос его на субстрат.
Выделяют 2 типа ОКСИГЕНАЗ:
1.ДИОКСИГЕНАЗЫ - ферменты, включающие в субстрат молекулу кислорода. А + О2 = АО2
В живых тканях этот процесс практически не встречается.
2.МОНООКСИГЕНАЗЫ - они катализируют включение в субстрат 1 атома кислорода, др. атом кислорода восстанавливается до воды. Для реакций катализируемых МОНООКСИГЕНАЗАМИ необходим КОСУБСТРАТ - донор электронов.
А-Н + О2 + ZH2 А-ОН + Z + Н2О, где А-Н – субстрат, ZH2 – КОСУБСТРАТ, А-ОН - окисленный субстрат.
В организме есть несколько видов МОНООКСИГЕНАЗ и прежде всего МИКРОСОМАЛЬНЫЕ МОНООКСИГЕНАЗЫ, содержащие ЦИТОХРОМ Р-450.Т.к. образуется -ОН группа, то это реакции ГИДРОКСИЛИРОВАНИЯ. МИКРОСОМАЛЬНАЯ система участвует в деградации многих умеренно токсических соединений, лекарственных веществ. Восстановленным КОСУБСТРАТОМ в этих реакциях является НАДФ*Н2. Этот путь окисления иногда называют ГИДРОКСИЛАЗНЫМ ЦИКЛОМ.
(ДОПОЛНИТЕЛЬНО)Свободнорадикальное окисление. Токсичность кислорода. Активные формы кислорода. Антиокислительная защита. Роль СРО в патологии.
Свободные радикалы - это молекулярные частицы, у которых на внешней оболочке имеется неспаренный электрон. Они могут образовываться: при окислении (отрывании атома водорода) при восстановлении О2 + е О2-
Атомарный кислород имеет на внешнем электронном уровне 2 неспареных электрона. Он не слишком активный, но может образовывать высоко активные формы. О2+4е + 4Н 2Н2О
О2 + е = 02- - СУПЕРОКСИДНЫЙ АНИОН
2-02 + 2е = 022- - ПЕРОКСИДНЫЙ АНИОН
НО, - ГИДРОКСИЛ РАДИКАЛ
Н2О2, О2-, О22-, ОН, - активные формы кислорода (АФК). Они образуются в организме при различных физиологических и патологических процессах. Все свободные радикалы в организме классифицируют:
1. Первичные радикалы (О2, N,O). Они образуются в результате ферментативных реакций. Они являются физиологическими. Способствуют образованию вторичных радикалов.
2. Вторичные радикалы (ОН, ЛИПИДНЫЕ радикалы – L,, LO,, LOO,). Это патологические продукты.
3. Третичные радикалы (АНТИОКСИДАНТЫ) - образуются под влиянием вторичных радикалов.
СУПЕРОКСИДНЫЙ АНИОН легко присоединяет Н+, е. Он хорошо растворяется в жирах, легко взаимодействует с ЛИПИДАМИ мембран, и с ПОЛИНЕНАСЫЩЕННЫМИ ЖИРНЫМИ КИСЛОТАМИ, отнимая у них водород. Этот процесс называется ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ (ПОЛ). Это патологическое явление, приводящее к нарушению целостности мембран клеток. Поэтому в организме есть система, которая предотвращает ПОЛ - АНТИОКИСЛИТЕЛЬНАЯ СИСТЕМА (АОС), препятствующая образованию свободных радикалов.
Она включает:
1 .Фермент - СУПЕРОКСИДДИСМУТАЗА (СОД), ГЛУТАТИОНПЕРОКСИДАЗА.
2.Альфа- ТОКОФЕРРОЛ (вит. Е) - основной не ферментный АНТИОКСИДАНТ.
3.УБИХИНОН.
4.МОЧЕВАЯ К-ТА.
5.БИЛИРУБИН.
6.ГЛУТАТИОН.
7.КОМПЛЕКСОНЫ ЖЕЛЕЗА.
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация ПОЛ характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей, старении, ишемии.
