
- •Химия (органическая химия)
- •050100.62–«Естественнонаучное образование» профиля «Химия»,
- •Оглавление
- •Предисловие
- •Лекция №1. Введение. Предмет органической химии. Основные этапы ее развития
- •Лекция № 2. Классификация и номенклатура органических соединений
- •Классификация органических соединений:
- •Лекция № 3. Химическая связь. Взаимное влияние атомов в органических соединениях
- •Лекция № 4. Изомерия
- •1. Структурная изомерия
- •2. Пространственная изомерия (стереоизомерия)
- •Лекция № 5. Классификация органических реакций и реагентов. Органические кислоты и основания
- •Кислотно-основные взаимодействия
- •Лекция 6.
- •1. Промышленные способы получения:
- •2. Лабораторные способы получения:
- •1. Реакции радикального замещения (sr)
- •2. Окисление
- •5. Дегидрирование:
- •Лекция 7. Непредельные углеводороды
- •1. Алкены
- •2. Геометрическая:
- •1. Реакции электрофильного присоединения(ае)
- •2. Алкадиены
- •2. Геометрическая изомерия:
- •3. Алкины
- •1. Структурная
- •Лекция 8. Арены (ароматические углеводороды)
- •Лекция № 9. Галогенпроизводные углеводородов.
- •2. Реакции отщепления (е).
- •Лекция 10. Спирты. Фенолы
- •1. Предельные одноатомные спирты (алканолы).
- •2. Многоатомные спирты
- •3. Фенолы
- •4. Простые эфиры
- •Лекция № 11. Карбонильные соединения
- •Лекция № 12. Карбоновые кислоты и их производные
- •Лекция № 13. Гетерофункциональные соединения
- •1. Гидроксикислоты
- •2. Оксокислоты
- •Лекция № 14. Углеводы
- •Лекция № 15. Амины
- •Лекция № 16. Аминокислоты. Пептиды
- •Лекция № 17. Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом:
- •Шестичленные азотсодержащие гетероциклы с одним и двумя гетероатомами:
1. Реакции радикального замещения (sr)
Для реакций данного типа характерен цепной радикальный механизм, который включает в себя стадии:
1. инициирования Х:Х → 2Х.
2. развитияцепи R-Н + Х. → Н-Х + R.
R. + Х:Х → R-Х + Х.
На каждой стадии генерируется радикал, что характерно для цепных реакций.
3. обрыва цепи R. + R. → R-R
R. + Х. → R-Х
Х. + Х. → Х-Х
Стабильность радикалов увеличивается в ряду: метильный < первичный < вторичный < третичный:

К реакциям данного типа относятся реакции галогенирования, нитрования, сульфохлорирование.
а) галогенирование
![]()
Стадией, определяющей скорость реакции, является стадия отщепления водорода атомом галогена.
Реакционная способность галогенов по отношению к алканам уменьшается в ряду:
F2 >Cl2 >Br2 >I2
Фторирование протекает с большим выделением энергии, что приводит к полному разрушению (осмоление, деструкция) органической молекулы.
При хлорировании углеводородов, как правило, образуется смесь монохлорпроизводных, т.е. реакции протекают нерегиоселективно.
Зная относительную реакционную способность С-Н связей (перв-С-Н < втор-C-Н < трет- С-Н = 1,0:3,8:5,0) и количество С-Н связей определенного типа, можно рассчитать состав смеси продуктов хлорирования.
Бромирование алканов, в отличие от хлорирования, протекает региоселективно; в первую очередь образуются третичные бромпроизводные, что соответствует ряду относительной стабильности алкильных радикалов.
Иодирование – процессы эндотермические, обратимые, поэтому на практике их не проводят.
Моно- и полизамещенные галогеналканы широко используются в качестве растворителей (хлороформ, дихлорэтан, четыреххлористый углерод и т.д.) и для органических синтезов.
б) сульфохлорирование
Сульфохлорирование осуществляют действием смеси хлора и диоксида серы (IV) при УФ-облучении:
RH + SO2 + Cl2 → RSO2Cl + HCl
RSO2Cl + 2NaOH → RSO2О-Na+ + NaCl + H2O
Алкилсульфохлориды (далее акилсульфонаты) используются как поверхностно-активные вещества (ПАВ).
в) нитрование
Нитрование алканов проводят в жидкой (10-20% раствор НNО3, 120-1500С) и газовой фазах (концентрированная НNО3 , 450-4750 С).
При нагревании алканов с разбавленной азотной кислотой (реакция Коновалова) происходит образование нитросоединений, в первую очередь у наиболее реакционноспособного третичного атома углерода:
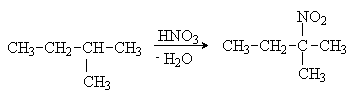
Газофазное нитрование протекает неселективно с образованием смеси как продуктов замещения водорода, так и продуктов расщепления С-С связей:
![]()
Нитроалканы широко используются в качестве растворителей и для органических синтезов.
2. Окисление
При комнатной температуре даже такие сильные окислители, как KMnO4 и K2Cr2O7, не действуют на алканы.
а) полное окисление (горение)
При высоких температурах в присутствии избытка кислорода алканы сгорают с образованием углекислого газа и воды:
2CnH2n+2 + (3n + 1)O2 → 2nCO2 + (2n + 2)H2O + ΔН
Реакция сопровождается выделением большого количества теплоты, вследствие чего алканы широко используются как источники энергии (топливо для бытовых и промышленных нужд, для двигателей различного типа ).
б) неполное окисление
Неполное каталитическое (катализаторы - соединения марганца, кобальта, более низкая температура - не выше 2000С) окисление алканов кислородом сопровождается образованием спиртов, кетонов, карбоновых
кислот:

В реакции в первую очередь принимают участие наиболее реакционноспособные третичные или вторичные атомы углерода. Окисление используется в промышленности для синтеза ценных кислородсодержащих соединений и их смесей.
3. Крекинг (от англ. Сrack - растрескивать, ломать) - расщепление углеводородов нефти.
Крекинг является важнейшим методом химической переработки нефти, дает ценное химическое сырье и различные виды топлива. Осуществляют крекинг при температуре 450-6000С либо в присутствии катализаторов (алюмосиликатов) при более низких температурах. Процесс сопровождается разрывом связей С-Н и С-С с образованием насыщенных и ненасыщенных углеводородов с меньшей длиной цепи:
СН3-СН2-СН2-СН2-СН3 → СН3-СН3 + СН3-СН=СН2
4. Изомеризация (протекает в присутствии катализаторов - кислот Льюиса):

