
- •Химия (органическая химия)
- •050100.62–«Естественнонаучное образование» профиля «Химия»,
- •Оглавление
- •Предисловие
- •Лекция №1. Введение. Предмет органической химии. Основные этапы ее развития
- •Лекция № 2. Классификация и номенклатура органических соединений
- •Классификация органических соединений:
- •Лекция № 3. Химическая связь. Взаимное влияние атомов в органических соединениях
- •Лекция № 4. Изомерия
- •1. Структурная изомерия
- •2. Пространственная изомерия (стереоизомерия)
- •Лекция № 5. Классификация органических реакций и реагентов. Органические кислоты и основания
- •Кислотно-основные взаимодействия
- •Лекция 6.
- •1. Промышленные способы получения:
- •2. Лабораторные способы получения:
- •1. Реакции радикального замещения (sr)
- •2. Окисление
- •5. Дегидрирование:
- •Лекция 7. Непредельные углеводороды
- •1. Алкены
- •2. Геометрическая:
- •1. Реакции электрофильного присоединения(ае)
- •2. Алкадиены
- •2. Геометрическая изомерия:
- •3. Алкины
- •1. Структурная
- •Лекция 8. Арены (ароматические углеводороды)
- •Лекция № 9. Галогенпроизводные углеводородов.
- •2. Реакции отщепления (е).
- •Лекция 10. Спирты. Фенолы
- •1. Предельные одноатомные спирты (алканолы).
- •2. Многоатомные спирты
- •3. Фенолы
- •4. Простые эфиры
- •Лекция № 11. Карбонильные соединения
- •Лекция № 12. Карбоновые кислоты и их производные
- •Лекция № 13. Гетерофункциональные соединения
- •1. Гидроксикислоты
- •2. Оксокислоты
- •Лекция № 14. Углеводы
- •Лекция № 15. Амины
- •Лекция № 16. Аминокислоты. Пептиды
- •Лекция № 17. Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом:
- •Шестичленные азотсодержащие гетероциклы с одним и двумя гетероатомами:
Лекция № 13. Гетерофункциональные соединения
План
1. Номенклатура, изомерия, строение, свойства гидроксикислот.
2. Номенклатура, изомерия, строение, свойства оксокислот.
Гетерофункциональные соединения - производные углеводородов, содержащие различные функциональные группы, причем природа этих групп и их количество могут быть разными.
Некоторые биологически важные гетерофункциональные органические соединения - метаболиты, биорегуляторы, структурные элементы биополимеров, лекарственные средства. Наиболее распространенными гетерофункциональными соединениями являются гидрокси-, оксо- и аминокислоты.
1. Гидроксикислоты
Гидроксикислоты - гетерофункциональные соединения, содержащие карбоксильную и гидроксильную группы. Эти соединения могут быть алифатическими или ароматическими. По взаимному расположению функциональных групп различают α-, ß-, γ-, δ - и т.д. гидроксикислоты. Названия гидроксикислот составляют по общим правилам номенклатуры ИЮПАК (см. «Номенклатура» ) Однако для многих кислот широко используют тривиальные названия:
![]()
![]()
2-гидроксиэтановая кислота 2-гидроксипропановая кислота
гидроксиуксусная кислота α-гидроксипропионовая кислота
гликолевая кислота молочная кислота
![]()
3- гидроксипропановая кислота
β- гидроксипропионовая кислота
В природе широко распространены полигидроксикарбоновые кислоты (содержат несколько гидроксильных групп) и гидроксиполикарбоновые кислоты (содержат несколько карбоксильных групп):
НООС-СН2-СН(ОН)-СООН 2-гидроксибутандиовая, 2-гидроксиянтарная кислота, яблочная кислота
НООС-СН(ОН)-СН(ОН)-СООН 2,3-дигидроксибутандиовая, винная кислота
НООС-СН2- С(ОН))(СООН)-СН2-СООН 3-гидрокси-3-карбоксипентандиовая кислота, лимонная кислота.
Получение:
а) из природного сырья;
б) щелочной гидролиз галогензамещенных кислот (см. «Галогенпроизводные углеводородов»);
в) циангидриный синтез
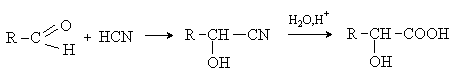
г) взаимодействие аминокислот с азотистой кислотой
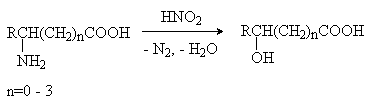
д) присоединение воды к непредельным кислотам
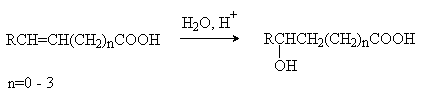
Изомерия. Структурная изомерия гидроксикарбоновых кислот обусловлена изомерией углеродного скелета и изомерией положения гидроксильной группы (например, α-гидроксипропионовая и β- гидроксипропионовая кислоты). Молекулы всех α-гидроксикарбоновых кислот, кроме гликолевой кислоты, содержат асимметрический атом углерода (хиральный центр) и, следовательно, могут существовать в виде пары энантиомеров:

Некоторые кислоты содержат два асимметрических атома углерода (хлоряблочная, винная кислоты) и, следовательно, могут существовать в виде как энантиомеров, так и диастереомеров (см. «Изомерия»).
Химические свойства.
Гидроксикислоты дают реакции, характерные для карбоксильной и гидроксильной групп, при этом могут участвовать как одна, так и обе функции.
1. Кислотность. Благодаря -I- эффекту гидроксильной группы гидроксикислоты по силе превосходят обычные карбоновые кислоты. По мере удаления ОН-группы от карбоксильной ее влияние на кислотные свойства уменьшается.
2. По карбоксильной группе гидроксикислоты образуют соли (соли и эфиры молочной кислоты называются лактатами, винной - тартратами, лимонной - цитратами, яблочной - малатами), сложные эфиры, галогенангидриды; по ОН-группе гидроксикислоты образуют галогензамещенные кислоты (SN-замещение), сложные эфиры (SN-замещение), оксокислоты (окисление).
3. Специфические свойства
Свойства обусловлены присутствием обеих групп и их взаимным расположением.
а) Отношение гидроксикислот к нагреванию.
α-гидроксикарбоновые кислоты при нагревании образуют продукты межмолекулярной дегидратации - циклические сложные эфиры, называемые лактидами:
![]()
ß-гидроксикислоты при нагревании переходят в α,ß-непредельные кислоты:
![]()
γ,δ-гидроксиокислоты претерпевают внутримолекулярное ацилирование с образованием циклических сложных эфиров - лактонов:
![]()
γ-гидроксимасляная кислота γ-бутиролактон
б) Образование комплексных соединений.
α-гидроксикислоты образуют окрашенные хелатные комплексы с ионами переходных металлов (Cu2+ , Fe3+ и др.):
![]()
в) Отношение к серной кислоте.
В присутствии концентрированной серной кислоты α-гидроксикислоты разлагаются с образованием муравьиной кислоты и соответствующего карбонильного соединения - альдегида или кетона:
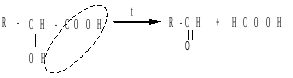
Нахождение в природе и применение кислот:
-Гликолиевая кислота содержится во многих растениях, например, свекле и винограде.
-Молочная кислота широко распространена в природе, является продуктом молочнокислого брожения углеводов, при этом образуется рацемическая D,L-молочная кислота. В мышцах человека при интенсивной работе образуется и накапливается L(+)-молочная (мясо-молочная) кислота - продукт расщепления и дальнейшего превращения полисахарида гликогена.
-Яблочная кислота содержится в незрелых яблоках, рябине, фруктовых соках. Является ключевым соединением в цикле трикарбоновых кислот. В организме образуется путем гидратации фумаровой кислоты и далее окисляется до щавелевоуксусной кислоты.
-Лимонная кислота содержится в плодах цитрусовых, винограде, крыжовнике, листьях табака. Является ключевым соединением в цикле трикарбоновых кислот.
-Винная кислота имеет 3 стереоизомера: D-винную кислоту, L-винную кислоту и оптически неактивную мезовинную кислоту (см. «Изомерия»). D-винная кислота содержится во многих растениях, например в винограде и рябине.
-Сорбиновая кислота (2,4-гексадиеновая) кислота СН3–СН=СН–СН=СН-СООН была получена из ягод рябины (на латыни – sorbus). Эта кислота - прекрасный консервант, поэтому ягоды рябины не плесневеют.
-Салициловая кислота - ароматическая гидроксикарбоновая кислота (фенолкарбоновая кислота), широко распространена в природе
![]()
.
Салициловая кислота и ее сложные эфиры (салол, аспирин) широко используются в медицине, кислота - консервант пищевых продуктов.
