
- •Химия (органическая химия)
- •050100.62–«Естественнонаучное образование» профиля «Химия»,
- •Оглавление
- •Предисловие
- •Лекция №1. Введение. Предмет органической химии. Основные этапы ее развития
- •Лекция № 2. Классификация и номенклатура органических соединений
- •Классификация органических соединений:
- •Лекция № 3. Химическая связь. Взаимное влияние атомов в органических соединениях
- •Лекция № 4. Изомерия
- •1. Структурная изомерия
- •2. Пространственная изомерия (стереоизомерия)
- •Лекция № 5. Классификация органических реакций и реагентов. Органические кислоты и основания
- •Кислотно-основные взаимодействия
- •Лекция 6.
- •1. Промышленные способы получения:
- •2. Лабораторные способы получения:
- •1. Реакции радикального замещения (sr)
- •2. Окисление
- •5. Дегидрирование:
- •Лекция 7. Непредельные углеводороды
- •1. Алкены
- •2. Геометрическая:
- •1. Реакции электрофильного присоединения(ае)
- •2. Алкадиены
- •2. Геометрическая изомерия:
- •3. Алкины
- •1. Структурная
- •Лекция 8. Арены (ароматические углеводороды)
- •Лекция № 9. Галогенпроизводные углеводородов.
- •2. Реакции отщепления (е).
- •Лекция 10. Спирты. Фенолы
- •1. Предельные одноатомные спирты (алканолы).
- •2. Многоатомные спирты
- •3. Фенолы
- •4. Простые эфиры
- •Лекция № 11. Карбонильные соединения
- •Лекция № 12. Карбоновые кислоты и их производные
- •Лекция № 13. Гетерофункциональные соединения
- •1. Гидроксикислоты
- •2. Оксокислоты
- •Лекция № 14. Углеводы
- •Лекция № 15. Амины
- •Лекция № 16. Аминокислоты. Пептиды
- •Лекция № 17. Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом:
- •Шестичленные азотсодержащие гетероциклы с одним и двумя гетероатомами:
Лекция 6.
УГЛЕВОДОРОДЫ. АЛКАНЫ
План
1. Классификация углеводородов.
2. Алканы.
3. Гомологический ряд, номенклатура, получение.
4. Изомерия, строение.
5. Свойства.
Углеводороды - органические соединения, состоящие из атомов двух элементов - углерода и водорода. Поэтому общую формулу углеводородов можно представить в виде СхНy.
Классификацию органических веществ, рассмотренную ранее, можно распространить и на углеводороды. Изучение углеводородов начинается с класса ациклических предельных соединений - алканов.
КЛАССИФИКАЦИЯ УГЛЕВОДОРОДОВ
УГЛЕВОДОРОДЫ
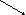

Алифатические Циклические





Предельные Непредельные Ароматические



Алициклические
Алканы Алкены Циклоалканы Арены
Алкины
Алкадиены
АЛКАНЫ
Алканы (парафины) - насыщенные или предельные углеводороды с открытой углеродной цепьюи общей формулой – СnH2n+2.
Гомологический ряд:
метан - СН4
этан - СН3-СН3
пропан - СН3-СН2-СН3
бутан - СН3-СН2-СН2-СН3
пентан - СН3-СН2-СН2-СН2-СН3 и т. д.
Номенклатура. Названия нормальных алканов, за исключением четырех членов ряда (метан, этан, пропан, бутан) образованы от греческих и латинских числительных с добавлением суффикса -ан. Разветвленные углеводороды называют по номенклатуре ИЮПАК.
Общая формула радикалов СnH2n+1. Названия радикалов образуют, заменяя суффикс «ан» в названии соответствующего алкана на суффикс «ил». Например, СН4 – метан, радикал СН3 – метил. Подробно материал по этому разделу представлен в []. При наличии в алкане или алкильном радикале фрагмента СН3-СН(СН3)- к его названию добавляют префикс изо, фрагмента СН3 -С(СН3)2- префикс нео, например,
СН3-СН(СН3)-СН3 - изобутан, СН3-С(СН3)2-СН3 - неопентан.
По рациональной номенклатуре алканам дают названия как производным метана, полученным в результате замещения одного или нескольких атомов водорода на алкильные радикалы. Например, пропан СН3-СН2-СН3 по рациональной номенклатуре будет иметь название - диметилметан.
Нахождение и применение алканов в природе. Алканы широко распространены в природе, являются главными компонентами нефти, природного газа, попутного нефтяного газа, горючих сланцев, природных восков, озокерита.
Основные области применения алканов указываются при рассмотрении свойств этих соединений.
Получение алканов.
1. Промышленные способы получения:
а) переработка различными методами природных источников (перегонка и крекинг нефти, риформинг, пиролиз);
б) гидрирование ненасыщенных углеводородов:

в) синтез Фишера-Тропша:
![]()
2. Лабораторные способы получения:
а) реакция Вюрца:
2RHal + 2Na → R-R + 2NaHal
б) декарбоксилирование солей карбоновых кислот:
![]() в)
электролиз солей карбоновых кислот
(синтез Кольбе):
в)
электролиз солей карбоновых кислот
(синтез Кольбе):
2RCOONa + 2H2O → R-R + 2CO2 + 2NaOH + H2
г) восстановление галогеналканов, карбонильных соединений:
RHal + H2 → R-H + HHal
Изомерия алканов.
1. Структурная изомерия
Для алканов, начиная с бутана, существуют структурные изомеры, отличающиеся строением углеродной цепи. Например, молекулярной формуле С4Н10 соответствует два соединения -
СН3-СН2-СН2-СН3 нормальный бутан и СН3-СН(СН3)-СН3 изобутан (2-метилпропан).
Число изомеров возрастает с увеличением числа атомов углерода в составе молекулы.
Таблица 4.
Количество структурных изомеров алканов
|
Количество |
Количество | ||
|
атомов углерода |
изомеров |
атомов углерода |
изомеров |
|
5 |
3 |
10 |
75 |
|
6 |
5 |
20 |
366317 |
|
8 |
18 |
40 |
624911805891 |
Атомы углерода в молекулах алканов подразделяются на первичные, вторичные, третичные, четвертичные в зависимости от числа соседних С-атомов.
2. Конформационная изомерия
Этот вид изомерии характерен для углеводородов с числом атомов углерода два и более. Например, молекула этана существует в виде двух пространственных конформационных изомеров заслоненной и заторможенной конформаций:
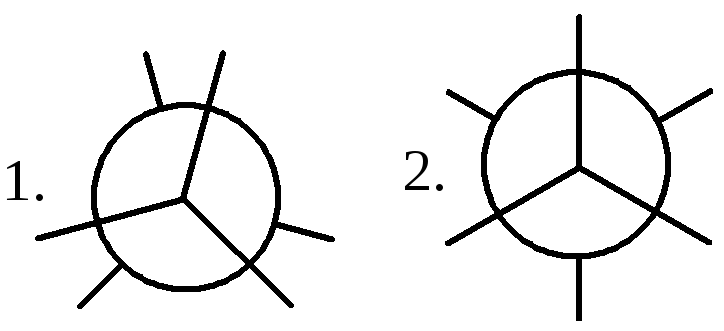
1. заслоненная конформация этана; 2. заторможенная конформация этана.
Молекулы с длинными углеродными цепями существуют, в основном, в форме зигзагообразных конформаций. При этом близко оказываются атомы 1-5 или 1-6, что способствует циклизации углеводородной цепи.
3. Оптическая изомерия
Молекулы разветвленных алканов (С7 и более) могут быть хиральными с одним или несколькими асимметрическими атомами углерода. Например:
1 2 3 4 5 6
СН3 - СН2 – *СН – СН2 – СН2 – СН3 3-метилгексан
│
СН3
Это соединение существует в виде двух оптических изомеров - энантиомеров (R, S-конфигурации).
Строение алканов.
Согласно теории гибридизации для атомов углерода в предельных углеводородах характерна sp3-гибридизация. Поэтому в соединениях данного типа существуют только ковалентные σ-связи: С-С (sp3-sp3 - перекрывание) и С-Н(sp3-s - перекрывание).
Ковалентные связи в алканах мало поляризуемые, неполярные. Дипольные моменты молекул предельных соединений равны нулю. В связи с этим межмолекулярные взаимодействия очень слабые, что и предопределяет физические свойства алканов.
Для σ-связей С-Н и С-С характерна высокая прочность (ЕС-С - 347 кДж/моль; ЕС-Н - 415 кДж/моль), которая зависит от типа атомов углерода. Наименее прочными является связи у третичного атома углерода, что делает такие связи наиболее уязвимыми в химических превращениях.
Пространственное строение алканов обусловлено тетраэдрической конфигурацией атомов углерода (валентный угол – 109028/).
Физические свойства.
Поскольку межмолекулярные взаимодействия в алканах очень слабые, для них характерны низкие температуры кипения и плавления, низкая плотность (меньше воды). В гомологическом ряду физические константы углеводородов закономерно увеличиваются. Разветвления углеродной цепи понижают значения указанных характеристик. Алканы практически нерастворимы в воде, однако легко растворяются в мало полярных и неполярных органических растворителях. Жидкие углеводороды имеют «бензиновый» запах.
Химические свойства.
Алканы обладают низкой реакционной способностью (парафины - «низкое сродство»). Их превращения осуществляются в жестких условиях. Причем гомолитический разрыв связей требует значительно меньших энергетических затрат, чем гетеролитический разрыв, поэтому для алканов характерны радикальные реакции (замещение атомов водорода, расщепление углеродного скелета, окисление). Однако в полярных средах могут происходить гетеролитические реакции. В обычных условиях алканы устойчивы к действию концентрированных кислот и щелочей, окислителей, щелочных металлов.
