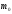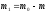- •Федеральное государственное бюджетное образовательное учреждение высшего
- •Рецензент:
- •Общие методические указания
- •Лабораторная работа №1 Тема: Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание
- •1.1 Техника безопасности при работе в лаборатории общей химии
- •1.2 Помощь при несчастных случаях
- •1.3 Правила обращения с реактивами
- •1.4 Химическая посуда и оборудование. Элементы техники лабораторных работ
- •1.4.1 Весы и взвешивание
- •1.4.2 Правила обращения с весами
- •1.4.3 Взвешивание цинка на аналитических весах
- •1.5 Необходимый уровень подготовки студентов
- •1.6 Вопросы для самоконтроля
- •Лабораторная работа №2 Тема: Определение молярной массы эквивалента цинка
- •2.1 Теоретические пояснения
- •2.2 Методика проведения опыта
- •2.3 Обработка результатов опыта
- •2.4 Примеры решения задач
- •2.5 Необходимый уровень подготовки студентов
- •2.6 Задания для самоконтроля
- •Тема: Основные классы неорганических соединений: оксиды, основания и амфотерные гидроксиды
- •3.1 Теоретические пояснения
- •3.2 Методика проведения опытов
- •3.2.1 Оксиды их получение и свойства
- •3.2.2 Гидроксиды, их получение и свойства
- •Лабораторная работа №4 Тема: Основные классы неорганических соединений: кислоты и соли
- •4.1 Теоретические пояснения
- •4.2 Методика проведения опытов
- •4.2.1 Кислоты, их получение и свойства
- •4.2.2 Соли, их получение и свойства
- •Опыт 5: Получение солей взаимодействием двух солей
- •4.3 Необходимый уровень подготовки студентов
- •4. Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
- •4.4 Задания для самоконтроля
- •Лабораторная работа №5 Тема: Кинетика химических реакций
- •5.1 Теоретические пояснения
- •5.2 Методика проведения опытов
- •5.3 Примеры решения задач
- •5.4 Необходимый уровень подготовки студентов
- •5.5 Задания для самоконтроля
- •Лабораторная работа №6 Тема: Химическое равновесие
- •6.1 Теоретические пояснения
- •6.2 Методика проведения опыта
- •6.3 Примеры решения задач
- •6.4 Необходимый уровень подготовки студентов
- •6.5 Задания для самоконтроля
- •Лабораторная работа №7 Тема: Синтез и исследование свойств координационных соединений
- •7.1 Теоретические пояснения
- •7.2 Методика проведения опытов
- •7.3 Необходимый уровень подготовки студентов
- •7.4 Задания для самоконтроля
- •Лабораторная работа №8 Тема: Приготовление растворов заданной концентрации
- •8.1 Теоретические пояснения
- •8.2 Методика проведения опыта
- •8.3 Примеры решения задач
- •8.4 Необходимый уровень подготовки студентов
- •8.5 Задания для самоконтроля
- •Лабораторная работа № 9 Тема: Гидролиз солей
- •9.1 Теоретические пояснения
- •Смещение равновесия в процессах гидролиза солей
- •9.2 Методика проведения опытов
- •8.3 Задания для самоконтроля
- •8.4 Примеры решения задач
- •8.5 Необходимый уровень подготовки студентов
- •Лабораторная работа №10 Тема: Окислительно-восстановительные реакции
- •10.1 Теоретические пояснения
- •10.2 Методика проведения опытов
- •10.3 Необходимый уровень подготовки студентов
- •10.4 Задания для самоконтроля
- •Лабораторная работа №11 Тема: Электрохимический ряд напряжений металлов
- •11.1 Теоретические пояснения
- •11.2 Методика проведения опытов
- •11.4 Задания для самоконтроля
- •Лабораторная работа № 12 Тема:Гальванический элемент
- •12.1 Теоретические пояснения
- •12.2 Методика проведения опыта
- •12.3 Необходимый уровень подготовки студентов
- •12.4 Задания для самоконтроля
- •Лабораторная работа №13 Тема: Изучение свойств азотной, серной и ортофосфорной кислот
- •13.1 Теоретические пояснения
- •13.2 Методика проведения опытов
- •13.3 Необходимый уровень подготовки студентов
- •13.4 Задания для самоконтроля
- •Лабораторная работа №14 Тема: Электролиз солей
- •14.1 Теоретические пояснения
- •14.2 Методика проведения опыта
- •14.3 Необходимый уровень подготовки студентов
- •14.4 Задания для самоконтроля
- •Лабораторная работа № 15 Тема: Коррозия металлов. Защита металлов от коррозии
- •15.1 Теоретические пояснения
- •15.2 Методика проведения опыта
- •Опыт 7: Пассивация алюминия.
- •15.3 Необходимый уровень подготовки студентов
- •15.4 Задания для самоконтроля
- •Лабораторная работа №16 Тема: Криоскопический метод определения молекулярной массы растворенного вещества
- •16.1 Теоретические пояснения
- •16.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •16.3 Примеры решения задач
- •16.4 Необходимый уровень подготовки студентов
- •16.5 Задания для самоконтроля
- •Лабораторная работа №17 Тема: Определение кажущейся степени диссоциации хлорида калия криоскопическим методом
- •17.1 Теоретические пояснения
- •17.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •17.3 Примеры решения задач
- •17.4 Необходимый уровень подготовки студентов
- •17.5 Задания для самоконтроля
- •Содержание
- •Лукашов Сергей Викторович
- •Методические указания по выполнению лабораторных работ
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
17.2 Методика проведения опыта
1. Подготовить термометр Бекмана, так как это было описано в предыдущей работе.
2. Собрать прибор по рис. 1, предварительно заполнив толстостенный стакан охладительной смесью, состоящей из трех частей снега (толченого льда) и одной части поваренной соли. Температура смеси должна быть -5 -7 0С. Ее можно регулировать при помощи изменения соотношения снега (льда) и соли.
3.Отмерить 10 мл Н2О и влить через боковой отросток в пробирку 1 (масса растворителя Н2О 10 г).
4.
Все время, перемешивая воду мешалкой,
определить по температуре замерзания
воды нулевую точку термометра. Нужно
иметь в виду, что жидкость часто
переохлаждается. Поэтому температурой
замерзания воды следует считать
температуру, которая устанавливается
в момент замерзания после некоторого
скачка вверх ( ).
).
5.
Вынуть пробирку 1 из прибора, растопить
лед и еще раз определить температуру
замерзания воды ( ).
).
Рис 1. Прибор для определения кажущейся степени диссоциации электролита криоскопическим методом:
пробирка
отросток
широкая пробирка
4. Толстостенный стакан
термометр Бекмана
6,7. Мешалки
8. Крышка
6.
Взвесить на аналитических весах бюкс,
в котором находится 0,3-0,5 г хлорида калия
( ).
).
7.
Всыпать
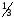 взвешенного хлорида калия через боковой
отросток в пробирку 1 и растворить его
в находящейся там дистиллированной
воде.
взвешенного хлорида калия через боковой
отросток в пробирку 1 и растворить его
в находящейся там дистиллированной
воде.
8.
Взвесить бюкс с остатком хлорида калия
( ).
).
9.
По разнице масс ( )
вычислить массу растворенного хлорида
калия.
)
вычислить массу растворенного хлорида
калия.
10.
Определить температуру замерзания
раствора хлорида калия так, как это было
описано в пункте 4. Измерения повторить
еще раз ( ).
).
11. Рассчитать кажущуюся степень электролитической диссоциации по формуле (4).
12. Результаты опыта представить в виде таблицы:
|
Масса растворителя, г m2 |
Температура замерзания, 0С |
|
Масса бюкса, г |
Масса КСI, г |
Кажущаяся степень электролитической диссоциации, α | ||||||||||||||
|
Воды,
|
Раствора,
|
|
|
| |||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||
13. Выводы.
17.3 Примеры решения задач
Пример 1:
Вычислите молярную концентрацию раствора уксусной кислоты, если известно, что степень диссоциации ее молекул в растворе составляет 1,36%, а константа диссоциации равна 1,74· 10-5.
Решение:
Константа диссоциации связана со степенью диссоциации следующим уравнением:

из которого следует:
 .
.
Пример 2:
Определить активность СаСI2 в его 0,02 М растворе.
Решение:
Так как при диссоциации 1 моль хлорида кальция образуется 2 моль ионов хлора и 1 моль ионов кальция, то при концентрации хлорида кальция 0,02 моль/л молярная концентрация ионов хлора будет 0,04, а ионов кальция 0,02 моль/л.
Рассчитаем ионную силу раствора:

Средний коэффициент активности ионов приближенно найдем по уравнению Дебая-Гюккеля:
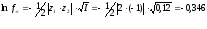

Теперь можно рассчитать активность хлорида кальция:

17.4 Необходимый уровень подготовки студентов
Знать понятия: степень электролитической диссоциации, электролиты и неэлектролиты, константа диссоциации слабого электролита.
Знать физический смысл изотонического коэффициента и его связь со степенью диссоциации.
Иметь представление о кажущейся степени электролитической диссоциации.
Уметь вычислять активность электролита и коэффициент активности при приближенном расчете для разбавленных растворов электролитов через ионную силу.