
- •Федеральное государственное бюджетное образовательное учреждение высшего
- •Рецензент:
- •Общие методические указания
- •Лабораторная работа №1 Тема: Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание
- •1.1 Техника безопасности при работе в лаборатории общей химии
- •1.2 Помощь при несчастных случаях
- •1.3 Правила обращения с реактивами
- •1.4 Химическая посуда и оборудование. Элементы техники лабораторных работ
- •1.4.1 Весы и взвешивание
- •1.4.2 Правила обращения с весами
- •1.4.3 Взвешивание цинка на аналитических весах
- •1.5 Необходимый уровень подготовки студентов
- •1.6 Вопросы для самоконтроля
- •Лабораторная работа №2 Тема: Определение молярной массы эквивалента цинка
- •2.1 Теоретические пояснения
- •2.2 Методика проведения опыта
- •2.3 Обработка результатов опыта
- •2.4 Примеры решения задач
- •2.5 Необходимый уровень подготовки студентов
- •2.6 Задания для самоконтроля
- •Тема: Основные классы неорганических соединений: оксиды, основания и амфотерные гидроксиды
- •3.1 Теоретические пояснения
- •3.2 Методика проведения опытов
- •3.2.1 Оксиды их получение и свойства
- •3.2.2 Гидроксиды, их получение и свойства
- •Лабораторная работа №4 Тема: Основные классы неорганических соединений: кислоты и соли
- •4.1 Теоретические пояснения
- •4.2 Методика проведения опытов
- •4.2.1 Кислоты, их получение и свойства
- •4.2.2 Соли, их получение и свойства
- •Опыт 5: Получение солей взаимодействием двух солей
- •4.3 Необходимый уровень подготовки студентов
- •4. Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
- •4.4 Задания для самоконтроля
- •Лабораторная работа №5 Тема: Кинетика химических реакций
- •5.1 Теоретические пояснения
- •5.2 Методика проведения опытов
- •5.3 Примеры решения задач
- •5.4 Необходимый уровень подготовки студентов
- •5.5 Задания для самоконтроля
- •Лабораторная работа №6 Тема: Химическое равновесие
- •6.1 Теоретические пояснения
- •6.2 Методика проведения опыта
- •6.3 Примеры решения задач
- •6.4 Необходимый уровень подготовки студентов
- •6.5 Задания для самоконтроля
- •Лабораторная работа №7 Тема: Синтез и исследование свойств координационных соединений
- •7.1 Теоретические пояснения
- •7.2 Методика проведения опытов
- •7.3 Необходимый уровень подготовки студентов
- •7.4 Задания для самоконтроля
- •Лабораторная работа №8 Тема: Приготовление растворов заданной концентрации
- •8.1 Теоретические пояснения
- •8.2 Методика проведения опыта
- •8.3 Примеры решения задач
- •8.4 Необходимый уровень подготовки студентов
- •8.5 Задания для самоконтроля
- •Лабораторная работа № 9 Тема: Гидролиз солей
- •9.1 Теоретические пояснения
- •Смещение равновесия в процессах гидролиза солей
- •9.2 Методика проведения опытов
- •8.3 Задания для самоконтроля
- •8.4 Примеры решения задач
- •8.5 Необходимый уровень подготовки студентов
- •Лабораторная работа №10 Тема: Окислительно-восстановительные реакции
- •10.1 Теоретические пояснения
- •10.2 Методика проведения опытов
- •10.3 Необходимый уровень подготовки студентов
- •10.4 Задания для самоконтроля
- •Лабораторная работа №11 Тема: Электрохимический ряд напряжений металлов
- •11.1 Теоретические пояснения
- •11.2 Методика проведения опытов
- •11.4 Задания для самоконтроля
- •Лабораторная работа № 12 Тема:Гальванический элемент
- •12.1 Теоретические пояснения
- •12.2 Методика проведения опыта
- •12.3 Необходимый уровень подготовки студентов
- •12.4 Задания для самоконтроля
- •Лабораторная работа №13 Тема: Изучение свойств азотной, серной и ортофосфорной кислот
- •13.1 Теоретические пояснения
- •13.2 Методика проведения опытов
- •13.3 Необходимый уровень подготовки студентов
- •13.4 Задания для самоконтроля
- •Лабораторная работа №14 Тема: Электролиз солей
- •14.1 Теоретические пояснения
- •14.2 Методика проведения опыта
- •14.3 Необходимый уровень подготовки студентов
- •14.4 Задания для самоконтроля
- •Лабораторная работа № 15 Тема: Коррозия металлов. Защита металлов от коррозии
- •15.1 Теоретические пояснения
- •15.2 Методика проведения опыта
- •Опыт 7: Пассивация алюминия.
- •15.3 Необходимый уровень подготовки студентов
- •15.4 Задания для самоконтроля
- •Лабораторная работа №16 Тема: Криоскопический метод определения молекулярной массы растворенного вещества
- •16.1 Теоретические пояснения
- •16.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •16.3 Примеры решения задач
- •16.4 Необходимый уровень подготовки студентов
- •16.5 Задания для самоконтроля
- •Лабораторная работа №17 Тема: Определение кажущейся степени диссоциации хлорида калия криоскопическим методом
- •17.1 Теоретические пояснения
- •17.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •17.3 Примеры решения задач
- •17.4 Необходимый уровень подготовки студентов
- •17.5 Задания для самоконтроля
- •Содержание
- •Лукашов Сергей Викторович
- •Методические указания по выполнению лабораторных работ
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
6.3 Примеры решения задач
Пример 1: Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций.
При
синтезе аммиака N2
+3H2
= 2NH3
равновесие установилось при следующих
концентрациях реагирующих веществ
(моль/л):
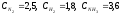 .
Рассчитайте константу равновесии этой
реакции и исходные концентрации азота
н водорода.
.
Рассчитайте константу равновесии этой
реакции и исходные концентрации азота
н водорода.
Решение:
Определяем константу равновесия Кс этой реакции:

Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось 3,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
Сисх(Н2) = 2,5 + 1,8 = 4,3 моль/л
На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, а для получения 3,6 моль аммиака требуется 3∙3,6/2 = 5,4 моль; учитывая равновесную концентрацию водорода, находим его исходную концентрацию:
Сисх(Н2) = 1,8 + 5,4 = 7,2 моль/л.
Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4,3; С(H2) = 7,2.
Пример 2: Вычисление равновесных концентраций реагирующих веществ.
Реакция протекает по уравнению А+В = 2C. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции Кс =50.
Решение:
К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через x моль, то увеличение концентрации вещества С будет равно 2x моль.
Равновесные концентрации реагирующих веществ будут: [A] = (0,5-х) моль/л; [B] = (0,7-х) моль/л; [С] = 2х моль/л.
Кс
=

Решая это уравнение, получаем: x1 = 0,86; x2 = 0,44. По условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: [A] = (0,5-0,44) = 0,06 моль/л; [B] = (0,7-0,44) = 0,26 моль/л; [С] = 0,44∙2 = 0,88 моль/л.
6.4 Необходимый уровень подготовки студентов
1. Знать понятия: химическое равновесие, константа химического равновесия, принцип Ле - Шателье.
2. Уметь на основе принципа Ле-Шателье предсказывать направление смещения химического равновесия при оказании на систему внешнего воздействия.
6.5 Задания для самоконтроля
1. Какое состояние обратимой реакции называют химическим равновесием?
2. Напишите уравнение константы равновесия для каждого из следующих обратимых процессов:
а) 2N02 (г) = 2NO(r) + 02(г)
б) ЗН2(г) + N2(г) = 2NH3(г)
в) Н2(г) + СuО(к) = Н2О(г) + Си(к)
Как сместится равновесие в каждом из указанных случаев при увеличении давления?
3. В каком направлении сместится равновесие при повышении температуры в следующих обратимых реакциях (тепловой эффект реакции рассчитайте по данным приложения [3]):
а) 2S02(г) + О2(г) = 2S03(г)
б) Н2(г) + Вr2(г) = 2НВr(г)
в) N2(г) + 02(г) = 2NO(г)
4. Рассчитайте константу равновесия реакции С25Н2807 + НС1 = С25Н27О6С1 +Н2О если для ее проведения смешали 12 мл 10-2 М раствора С25Н2807 и 15 мл 10-2 М раствора НС1. Полученную смесь разбавили водой до 50 мл. Равновесная концентрация С25Н27О6С1 оказалась равной 2,03∙10 -3 моль/л. Ответ: 3,14∙105.
