
- •Федеральное государственное бюджетное образовательное учреждение высшего
- •Рецензент:
- •Общие методические указания
- •Лабораторная работа №1 Тема: Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание
- •1.1 Техника безопасности при работе в лаборатории общей химии
- •1.2 Помощь при несчастных случаях
- •1.3 Правила обращения с реактивами
- •1.4 Химическая посуда и оборудование. Элементы техники лабораторных работ
- •1.4.1 Весы и взвешивание
- •1.4.2 Правила обращения с весами
- •1.4.3 Взвешивание цинка на аналитических весах
- •1.5 Необходимый уровень подготовки студентов
- •1.6 Вопросы для самоконтроля
- •Лабораторная работа №2 Тема: Определение молярной массы эквивалента цинка
- •2.1 Теоретические пояснения
- •2.2 Методика проведения опыта
- •2.3 Обработка результатов опыта
- •2.4 Примеры решения задач
- •2.5 Необходимый уровень подготовки студентов
- •2.6 Задания для самоконтроля
- •Тема: Основные классы неорганических соединений: оксиды, основания и амфотерные гидроксиды
- •3.1 Теоретические пояснения
- •3.2 Методика проведения опытов
- •3.2.1 Оксиды их получение и свойства
- •3.2.2 Гидроксиды, их получение и свойства
- •Лабораторная работа №4 Тема: Основные классы неорганических соединений: кислоты и соли
- •4.1 Теоретические пояснения
- •4.2 Методика проведения опытов
- •4.2.1 Кислоты, их получение и свойства
- •4.2.2 Соли, их получение и свойства
- •Опыт 5: Получение солей взаимодействием двух солей
- •4.3 Необходимый уровень подготовки студентов
- •4. Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
- •4.4 Задания для самоконтроля
- •Лабораторная работа №5 Тема: Кинетика химических реакций
- •5.1 Теоретические пояснения
- •5.2 Методика проведения опытов
- •5.3 Примеры решения задач
- •5.4 Необходимый уровень подготовки студентов
- •5.5 Задания для самоконтроля
- •Лабораторная работа №6 Тема: Химическое равновесие
- •6.1 Теоретические пояснения
- •6.2 Методика проведения опыта
- •6.3 Примеры решения задач
- •6.4 Необходимый уровень подготовки студентов
- •6.5 Задания для самоконтроля
- •Лабораторная работа №7 Тема: Синтез и исследование свойств координационных соединений
- •7.1 Теоретические пояснения
- •7.2 Методика проведения опытов
- •7.3 Необходимый уровень подготовки студентов
- •7.4 Задания для самоконтроля
- •Лабораторная работа №8 Тема: Приготовление растворов заданной концентрации
- •8.1 Теоретические пояснения
- •8.2 Методика проведения опыта
- •8.3 Примеры решения задач
- •8.4 Необходимый уровень подготовки студентов
- •8.5 Задания для самоконтроля
- •Лабораторная работа № 9 Тема: Гидролиз солей
- •9.1 Теоретические пояснения
- •Смещение равновесия в процессах гидролиза солей
- •9.2 Методика проведения опытов
- •8.3 Задания для самоконтроля
- •8.4 Примеры решения задач
- •8.5 Необходимый уровень подготовки студентов
- •Лабораторная работа №10 Тема: Окислительно-восстановительные реакции
- •10.1 Теоретические пояснения
- •10.2 Методика проведения опытов
- •10.3 Необходимый уровень подготовки студентов
- •10.4 Задания для самоконтроля
- •Лабораторная работа №11 Тема: Электрохимический ряд напряжений металлов
- •11.1 Теоретические пояснения
- •11.2 Методика проведения опытов
- •11.4 Задания для самоконтроля
- •Лабораторная работа № 12 Тема:Гальванический элемент
- •12.1 Теоретические пояснения
- •12.2 Методика проведения опыта
- •12.3 Необходимый уровень подготовки студентов
- •12.4 Задания для самоконтроля
- •Лабораторная работа №13 Тема: Изучение свойств азотной, серной и ортофосфорной кислот
- •13.1 Теоретические пояснения
- •13.2 Методика проведения опытов
- •13.3 Необходимый уровень подготовки студентов
- •13.4 Задания для самоконтроля
- •Лабораторная работа №14 Тема: Электролиз солей
- •14.1 Теоретические пояснения
- •14.2 Методика проведения опыта
- •14.3 Необходимый уровень подготовки студентов
- •14.4 Задания для самоконтроля
- •Лабораторная работа № 15 Тема: Коррозия металлов. Защита металлов от коррозии
- •15.1 Теоретические пояснения
- •15.2 Методика проведения опыта
- •Опыт 7: Пассивация алюминия.
- •15.3 Необходимый уровень подготовки студентов
- •15.4 Задания для самоконтроля
- •Лабораторная работа №16 Тема: Криоскопический метод определения молекулярной массы растворенного вещества
- •16.1 Теоретические пояснения
- •16.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •16.3 Примеры решения задач
- •16.4 Необходимый уровень подготовки студентов
- •16.5 Задания для самоконтроля
- •Лабораторная работа №17 Тема: Определение кажущейся степени диссоциации хлорида калия криоскопическим методом
- •17.1 Теоретические пояснения
- •17.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •17.3 Примеры решения задач
- •17.4 Необходимый уровень подготовки студентов
- •17.5 Задания для самоконтроля
- •Содержание
- •Лукашов Сергей Викторович
- •Методические указания по выполнению лабораторных работ
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
Лабораторная работа №17 Тема: Определение кажущейся степени диссоциации хлорида калия криоскопическим методом
Цель работы: научиться определять кажущуюся степень диссоциации сильного электролита криоскопическим методом.
Оборудование и реактивы: прибор для определения молекулярной массы криоскопическим методом (рис. 1): пробирка с боковым отростком, широкая пробирка, толстостенный стакан, термометр Бекмана, мешалки, крышка; аналитические весы с разновесом, мерный цилиндр, шпатель, снег (толченый лед) и хлорид натрия для охладительной смеси, бюкс с 1,2-1,5 г хлорида калия, дистиллированная вода.
17.1 Теоретические пояснения
Электролитическая диссоциация – это распад веществ в расплаве или в растворе на свободно составляющие их ионы. По способности веществ распадаться или не распадаться на ионы различают электролиты и неэлектролиты.
Электролиты – это вещества, которые подвергаются электролитической диссоциации, и вследствие чего их растворы или расплавы проводят электрический ток. К электролитам относятся все соли, а также кислотные, основные и амфотерные гидроксиды.
Неэлектролиты – это вещества, которые не подвергаются электролитической диссоциации, и вследствие чего их растворы или расплавы не проводят электрический ток. К неэлектролитам относится большинство органических соединений.
Электролитическая диссоциация потенциальных электролитов представляет собой равновесный процесс. Электролит может диссоциировать на ионы почти полностью или частично, что зависит от вида электролита и от концентрации его в растворе, а также от температуры раствора.
Одной из количественных характеристик неполной электролитической диссоциации электролитов является степень диссоциации α, равная:

где
 –
число продиссоциированных молекул;
–
число продиссоциированных молекул; –
общее число молекул.
–
общее число молекул.
Степень
диссоциации электролита – это частное
от деления числа продиссоциированных
молекул к общему числу молекул электролита
введенных в раствор.
Степень диссоциации изменяется в
пределах
 (значение
(значение относится к неэлектролитам,
относится к неэлектролитам, <0,03
– к слабым электролитам, 0,03<
<0,03
– к слабым электролитам, 0,03< – к сильным).
– к сильным).
Степень электролитической диссоциации связана с изотоническим коэффициентом соотношением:

где i - изотонический коэффициент, n - число ионов, на которые распадается электролит.
Так как при диссоциации электролита число частиц в растворе будет больше чем при растворении такого же количества неэлектролита, это обуславливает понижение температуры замерзания раствора по сравнению с растворителем:

где
i
- изотонический
коэффициент (для электролитов больше
1),
 -
понижение температуры замерзания
раствора, определенное опытным путем,
-
понижение температуры замерзания
раствора, определенное опытным путем, -
понижение температуры, вычисленное без
учета диссоциации электролита по
формуле:
-
понижение температуры, вычисленное без
учета диссоциации электролита по
формуле:
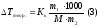
где
 -
масса растворенного вещества в граммах,
-
масса растворенного вещества в граммах, -
масса растворителя в граммах,
-
масса растворителя в граммах, -
молярная масса растворенного вещества
вг/моль,
-
молярная масса растворенного вещества
вг/моль,
 -
криоскопическая постоянная для воды
равная 1,85
-
криоскопическая постоянная для воды
равная 1,85 ,
1000- коэффициент пересчета от граммов
растворителя к килограммам.
,
1000- коэффициент пересчета от граммов
растворителя к килограммам.
Учитывая (2) и (3), выражение (1) можно записать в виде:

Таким образом, степень диссоциации электролита можно определить методом криоскопии, для этого необходимо измерить понижение температуры замерзания его раствора и воспользоваться формулой (4).
Для растворов сильных электролитов определенная таким образом степень электролитической диссоциации будет кажущейся (α<1, тогда как на самом деле α=1). Это объясняется тем, что образующиеся при диссоциации электролита ионы взаимодействуют друг с другом (притягиваются), что как бы приводит к уменьшению числа частиц в растворе и понижает значение α.
Диссоциация – это обратимый равновесный процесс, который характеризуется константой равновесия, называемой константой диссоциации Кд.


где С – молярная концентрация электролита моль/л. Так вычисляют условную константу диссоциации, поскольку, используя для расчета молярную концентрацию, не учитывают взаимодействие ионов в растворе.
Для вычисления истинной константы диссоциации используют активную концентрацию или активность а. Активная концентрация отражает суммарное взаимодействие ионов в растворе между собой, с молекулами растворенного вещества и с молекулами растворителя. Активность вычисляют по формуле:

где f- коэффициент активности ионов, зависящий от концентрации и состава раствора, заряда, природы иона, температуры и других факторов.
В разбавленных растворах (С не превышает 0,5 моль/л) коэффициент активности зависит только от заряда иона и ионной силы, которая вычисляется по формуле:
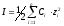
где Сi – концентрации, а zi – заряды всех находящихся в растворе ионов. В последней формуле под Сi следует понимать моляльность, однако для разбавленных растворов, для которых справедлива эта формула моляльность не сильно отличается от молярности.
В разбавленных растворах средний коэффициент активности вычисляют по формуле Дебая-Гюккеля:

Таким образом, активность ионов в разбавленном растворе можно вычислить по формуле:

где
С
- концентрация ионов моль/л,
 -
средний коэффициент активности ионов.
-
средний коэффициент активности ионов.
Понятие
активности применимо и к электролиту
в целом. Активность электролита равна
произведению активностей его ионов.
Для электролита
 активность равна:
активность равна:

Средняя активность ионов электролита рассчитывается по формуле:

Используя активность можно вычислить истинную константу диссоциации:

Константа диссоциации связана со степенью электролитической диссоциации уравнением, которое справедливо для разбавленных растворов:

где С0- исходная концентрация электролита моль/л, α- степень электролитической диссоциации. Для очень слабых электролитов можно использовать соотношение:
 .
.
