
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
6.4 Смещение химического равновесия. Принцип Ле-Шателье
Если система находится в состоянии равновесия, то она будет пребывать в нем до тех пор, пока внешние условия сохраняются постоянными. Если же условия изменяются, то система выйдет из равновесия − скорости прямого и обратного процессов изменятся неодинаково.
Характер смещения химического равновесия в системе при изменении условий, в которых она находится, описывается так называемым принципом Ле-Шателье: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию веществ), то равновесие сместится в сторону протекания той реакции, которая ослабляет это воздействие.
Рассмотрим 3 случая нарушения равновесия.
1. Изменение концентрации какого-либо из веществ, участвующих в реакции (температура и давление постоянны).
Рассмотрим реакцию взаимодействия водорода с парами йода:
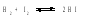
Константа равновесия данной реакции вычисляется по формуле
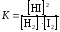 (18)
(18)
Введем в систему дополнительно, например, водород. Согласно закону действия масс это повлечет за собой увеличение прямой реакции – реакции синтеза НI и концентрация Н2 и I2 будет уменьшаться, что приведет к уменьшению скорости прямой реакции, концентрация НI возрастет, это приведет к возрастанию обратной реакции, затем наступит равновесие, но при этом концентрация НI будет теперь выше, а концентрация I2 ниже, т.е. равновесие сместится вправо.
Если увеличим концентрацию НI, то равновесие сместится в обратном направлении.
Увеличение концентрации одного из реагирующих веществ путем ввода в систему дополнительного количества этого вещества смещает равновесие в сторону прямой реакции (т. е. расходования части дополнительно введенного вещества), а повышение концентрации одного из продуктов − в сторону обратной реакции (по той же причине). Напротив, уменьшение концентрации одного из исходных веществ ведет к смещению равновесия в сторону обратной реакции, а уменьшение концентрации одного из продуктов − к смещению равновесия в сторону прямой реакции. Как мы видим, во всех случаях система как бы стремится восполнить убыль вещества за счет расходования других веществ системы либо превратить в другие вещества его избыток.
Отсюда следует, что, вводя в систему избыток того или иного вещества-участника равновесия или, наоборот, выводя его из системы, можно управлять выходом продуктов реакции, направляя его в необходимую сторону. Этим широко пользуются на практике. Если, например, вещество А, участвующее в процессе
А + В
 С +D
С +D
представляет значительную ценность и потому желательно использовать его максимально полно, то для реакции берут большой избыток вещества В, представляющего меньшую ценность.
2. Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема, температура постоянна).
Если в реакции участвуют газообразные вещества, то при увеличении давления равновесие смещается в сторону образования меньшего количества газообразных веществ. Например:
А (г) + В (г) С (г)
С (г)
В левой части – 1 моль газа А и 1 моль газа В, в правой – 1моль газа С. При увеличении давления равновесие смещается в сторону образования вещества С, при уменьшении давления – в сторону образования веществ А и В.
Отсюда вывод: при увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газа, т.е. в сторону понижения давления; при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул, т.е. в сторону увеличения давления.
3. Нарушение равновесия вследствие изменения температуры
Например, в системе
А + В
 С, ∆H<0
С, ∆H<0
прямая реакция является экзотермической, обратная – эндотермической. С ростом температуры равновесие смещается в сторону веществ A и B (так как эндотермическая реакция ослабляет воздействие), с уменьшением температуры – в сторону образования вещества C.
Как установлено экспериментально, смещение равновесия при изменении температуры можно определить так: «Повышение температуры вызывает смещение равновесия в сторону реакции, идущей с поглощением теплоты, а понижение температуры смещает равновесие в сторону реакции, идущей с выделением теплоты».
Температура оказывает заметное влияние на биохимические процессы, протекающие в пище при ее хранении или в ходе ее приготовления. Скорость порчи пищевых продуктов может быть понижена разными способами, включая замораживание. Например, свежесть и аромат чая зависят от содержания в нем ряда химических веществ, принадлежащих к группе флавинов. При хранении чая содержание в нем флавинов постепенно уменьшается. Скорость разрушения флавинов в чае приблизительно в равной мере зависит от влажности и температуры.
Закономерности, которые проявляются в рассматриваемых примерах нарушения химического равновесия, представляют собой частные случаи принципа Ле-Шателье.
