
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
1 Диссоциация кислот
В растворах кислоты диссоциируют с образованием протонов водорода и анионов кислотного остатка. Одноосновные кислоты диссоциируют в одну ступень, многоосновные кислоты подвергаются ступенчатой диссоциации Под воздействием протонов водорода индикаторы лакмус и метилоранж окрашиваются в красный цвет; фенолфталеин в кислой среде бесцветен.
2 Взаимодействие кислот с основаниями (реакция нейтрализации):

3 Взаимодействие кислот с основными оксидами:

4 Взаимодействие кислот с металлами:
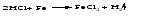
Металлы, стоящие в ряду напряжений (электрохимический ряд металлов) до водорода, могут замещать атомы водорода в кислотах, при этом образуется соль и выделяется водород, причем металл окисляется до низшей устойчивой в водной среде степени окисления (например, железо – до Fe2+).
При действии азотной (в любой концентрации) или концентрированной серной кислоты на металлы также образуются соли, но водород не выделяется.
5 Взаимодействие кислот с солями
Кислоты взаимодействуют с солями, образуя новые кислоты (иногда их оксиды) и новые соли. Реакции кислот с солями могут происходить при определенных условиях. Например, так называемые сильные кислоты (H2SO4, HC1, HNO3 и др.) вытесняют в процессе взаимодействия с солями более слабые кислоты (Н3РО4, HNO2, H2CO3, H2 S и др.):

Кроме того, реакция возможна, если в результате нее образуется нерастворимое, разлагающееся или летучее вещество (кислота или оксид):

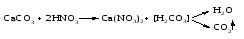


Способы получения кислот
1 Взаимодействие простого вещества с водородом
Только бескислородные кислоты можно получить взаимодействием простого вещества с водородом и растворением полученного газа в воде:
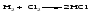

(символ «aq» означает, что вещество растворилось или образовалось соединение с неопределенным количеством воды).
2 Взаимодействие оксида с водой
Только кислородсодержащие кислоты можно получить взаимодействием оксида с водой (если образующаяся кислота растворима в воде):

3 Взаимодействие кислоты с солью
Как кислородсодержащие, так и бескислородные кислоты можно получить действием сильной кислоты на соль, если образуется летучая, малорастворимая или слабая кислота:

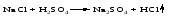


Амфотерные оксиды и гидроксиды
Амфотерными называют оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства, т. е. реагирующие, соответственно, как с кислотами, так и со щелочами.
Амфотерному оксиду соответствует амфотерный гидроксид. Например, амфотерному оксиду ZnO соответствует амфотерный гидроксид Zn(ОH)2, a амфотерному оксиду Al2O3 ‒ амфотерный гидроксид Аl(ОН)3.
Проявляя основные свойства, амфотерные оксиды и гидроксиды реагируют с кислотами, образуя соль и воду, например:


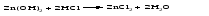

Проявляя кислотные свойства, они реагируют со щелочами, также образуя соль и воду, например:
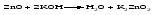


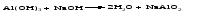
Чтобы правильно составить формулу образующейся соли, следует написать формулу амфотерного гидроксида так, как обычно записывается формула кислоты, и отсюда найти формулу соответствующего кислотного остатка. Например, в случае соединений цинка и алюминия надо мысленно проделать следующие логические переходы:

Следует обратить
внимание, что в случае алюминия кислота
теряет одну молекулу воды, т.е.
образовавшаяся соль соответствует не
ортоалюминиевой кислоте Н3AlO3,
а метаалюминиевой кислоте НАlO2.
Амфотерными свойствами обладает большое число оксидов и гидроксидов, например оксиды и гидроксиды бериллия, хрома (III), олова(II), свинца(II), олова(IV), свинца(IV).
Амфотерные гидроксиды практически нерастворимы в воде, поэтому соответствующие им амфотерные оксиды с водой не взаимодействуют. Как основные, так и кислотные свойства этих гидроксидов выражены слабо, т. е. они являются и слабыми основаниями, и слабыми кислотами одновременно.
Поскольку амфотерные гидроксиды растворимы в растворах щелочей, то для получения таких гидроксидов нельзя брать избыток щелочи в обменной реакции между солью и щелочью, так как это приведет к растворению в ней амфотерного гидроксида. Чтобы этого не произошло, иногда бывает достаточно вместо гидроксида натрия взять гидроксид аммония, в котором амфотерные гидроксиды с очень слабыми кислотными свойствами не растворяются.
При растворении гидроксида алюминия в щелочи могут образовываться разные соединения. Это связано с разной степенью гидратации этих соединений и разным количеством щелочи, участвующей в реакции:
Так, если в растворах алюминатов щелочных металлов присутствует ион [А1(ОН)4]-, то в безводном состоянии алюминаты содержат ион АlO2-, т.е. при растворении гидроксида алюминия в растворе NaOH образуется тетрагидроксоалюминат натрия Na[Al(OH)4], а при обезвоживании последнего – метаалюминат натрия NaAlO2:


Аналогичным образом реакцию гидроксида цинка со щелочью можно записать двумя способами:

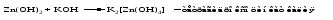
Рассмотренные примеры могут служить моделью для предсказания возможных форм соединений, которые образуются при действии щелочи на амфотерный оксид или гидроксид, Аl(ОН)3 ‒ модель для металлов в степени окисления (+3), Zn(ОН)2 ‒ для металлов в степени окисления (+2).
Лекция 14
Вопросы
Соли. Общая характеристика, классификация и номенклатура солей
Физические и химические свойства средних солей
Способы получения средних солей
Физические и химические свойства кислых и основных солей
Способы получения кислых и основных солей
Соли. Общая характеристика, классификация и номенклатура солей
Солями называются соединения, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп) и одного (нескольких) кислотных остатков.
Соли можно рассматривать как продукты реакции нейтрализации, в которой атомы водорода кислоты и гидроксогруппы основания соединяются, образуя воду, а атомы металла и кислотный остаток дают соль:

По составу соли подразделяют на средние (нормальные), кислые (гидросоли), основные (гидроксосоли), двойные, смешанные и комплексные.
Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислоте атомами металла или как продукты полной нейтрализации основания кислотой:


Кислые соли можно рассматривать как продукты неполного замещения атомов водорода в многоосновной кислоте атомами металла. Кислые соли состоят из атомов металла и кислых кислотных остатков, т. е. кислотных остатков, содержащих атомы водорода:

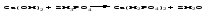
Основные соли можно рассматривать как результат неполного обмена гидроксогрупп многокислотного основания на кислотные остатки. Основные соли состоят из атомов металла, гидроксогрупп и кислотных остатков:


Взаимные превращения кислых, средних и основных солей можно представить следующей схемой:

Рассмотрим на примерах все возможные взаимные превращения кислых, средних и основных солей:

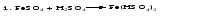

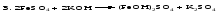
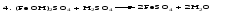
Соли, содержащие атомы двух разных металлов при общем кислотном остатке, называются двойными солями. Одним из наиболее типичных примеров двойных солей, часто встречающихся в химической практике, являются квасцы ‒ двойные сульфаты состава МеI МеII(SO4)2·12Н2О, где МеI ‒ чаще всего Nа+, К+, NН4+, а МеII ‒ А1+3, Fе+3 и Сr+3.
Смешанными называют соли, содержащие атомы одного металла, но разные кислотные остатки. Примерами смешанных солей могут служить белильная известь СаОСl2, в которой содержатся два разных кислотных остатка ‒ гипохлорит (СlO-) и хлорид (Cl-).
В водных растворах двойные и смешанные соли, если они растворимы, ведут себя как смесь двух соответствующих средних солей. Так, алюмокалиевые квасцы ведут себя как смесь сульфатов калия и алюминия, образуя в растворах ионы К+, А1 3+ и SO42- а белильная известь ведет себя как смесь гипохлорита и хлорида кальция, образуя в растворе ионы Са2+, СlO- и С1-.
Комплексными называют соли, содержащие комплексный катион или комплексный анион, например,K4[Fe(CN)6], [Ag(NH3)2]Cl.
Название средней соли по международной номенклатуре состоит из латинского названия кислотного остатка и названия металла в родительном падеже, причем для металлов, проявляющих разные степени окисления, указывают степень окисления. При этом следует помнить, что кислотные остатки кислородсодержащих кислот имеют суффикс «-ат», если образующий кислоту элемент находится в высшей степени окисления, и «-ит» ‒ если в более низкой степени окисления. Например:
|
Zn(NO3)2 ‒ нитрат цинка |
Zn(NO2)2 ‒ нитрит цинка |
|
Fe(SO4)3 ‒ сульфат железа (III) |
Na2SO3 ‒ сульфит натрия |
Кислотные остатки бескислородных кислот имеют суффикс «-ид»:
|
AgBr ‒ бромид серебра |
BaS ‒ сульфид бария |
|
FeCl2 ‒ хлорид железа (II) |
FeCl3 ‒ хлорид железа (III) |
Для солей бескислородных кислот часто употребляют названия, в которых с помощью греческого числительного указано число атомов неметалла:
|
FeCl2 ‒ дихлорид железа |
FeCl3 ‒ трихлорид железа |
В технической литературе встречаются и старые русские названия солей. Для солей кислородсодержащих кислот они состоят из прилагательного, составленного из названия кислоты (без окончания) и слова кислый, и далее названия металла в именительном падеже. Например, СаSО4 ‒ сернокислый кальций, К2SО3 ‒ сернистокислый калий. Старые русские названия солей бескислородных кислот состоят из прилагательного, образованного от названия неметалла, и названия металла в именительном падеже. При этом, если металл, проявляющий разные степени окисления, находится в высшей степени окисления, то прилагательное содержит суффикс «-н», а если металл имеет только одну степень окисления или находится в низшей степени окисления, то прилагательное содержит суффикс «-ист». Например: FeC13 ‒ хлорное железо, FеС12 ‒ хлористое железо, КС1 ‒ хлористый калий. Старую русскую номенклатуру можно встретить в названиях удобрений, химических реактивов и медикаментов.
На практике часто используются исторически сложившиеся эмпирические названия солей, например: NaС1 ‒ поваренная соль или каменная соль, KNО3, NаNО3, Са(NО3)2 ‒ соответственно калиевая (калийная), натриевая (чилийская) и кальциевая селитры, CaСО3 ‒ кальцинированная сода, СuSО4·5H2O ‒ медный купорос.
Названия кислых и основных солей составляются следующим образом. Для кислых солей перед названием кислотного остатка добавляется приставка «гидро-», если кислотный остаток содержит один атом водорода, «дигидро-», если два атома водорода, и т.д. Например: СаНРO4 ‒ гидрофосфат кальция, Са(Н2PO4)2 ‒ дигидрофосфат кальция.
Для основных солей перед названием металла добавляется слово гидроксо-, если на один атом металла приходится одна гидроксогруппа, дигидроксо-, если две гидроксогруппы, и т.д. Например: АlOHSO4 ‒ сульфат гидроксоалюминия, [А1(ОН)2]2SO4 ‒ сульфат дигидроксоалюминия.
