
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
6.2.3 Зависимость скорости реакции от температуры
При повышении температуры скорость реакций, как правило, резко возрастает. Например, при комнатной температуре скорость взаимодействия водорода с кислородом практически нулевая, при температуре 400 °С она делается заметной, хотя и остается небольшой, а при температуре 600 °С реакция протекает со взрывом.
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °С, называется температурным коэффициентом скорости (γ) этой реакции.
Для большинства реакций γ равно 2-3 (правило Вант-Гоффа).
Зная величину γ, а также скорость реакции при одной температуре Т1, можно вычислить ее скорость при другой температуре Т2, воспользовавшись уравнением:
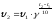 (11)
(11)
При расчетах по этому уравнению нетрудно заметить, что при повышении температуры скорость реакции возрастает очень резко. Так, если γ = 2, то повышение температуры, например, от 0 °С до 100 °С приводит к повышению скорости реакции в 2100/10=210=103 раз.
Объяснить столь резкое увеличение скорости реакции одним только увеличением числа соударений между частицами реагентов за счет возрастания скорости их движения (вычисляемой на основании кинетической теории газов) нельзя.
Если с помощью молекулярно-кинетической теории газов и жидкостей подсчитать число соударений между молекулами тех или иных веществ при определенных условиях, то окажется, что число соударений столь велико, что все реакции должны протекать мгновенно. Однако в действительности далеко не все реакции заканчиваются быстро. Это противоречие можно объяснить, если предположить, что не всякое столкновение молекул реагирующих веществ приводит к образованию продуктов реакции. Для того чтобы это произошло, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение не приведет к образованию новой молекулы. Если же кинетической энергии сталкивающихся молекул достаточно для ослабления или разрыва связей, то столкновение может привести к перестройке атомов с образованием переходного состояния (активированного комплекса) и затем к образованию молекулы нового вещества:
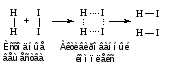
В состоянии активированного комплекса связи в исходных частицах ослаблены, как бы надорваны, и уже образуются новые связи, которые, однако, еще не стали такими же прочными, как в конечных веществах.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Ее определяют опытным путем, обозначают Еа и обычно выражают в [кДж/моль]. Молекулы, обладающие такой энергией, называются активными молекулами.
Если большое число молекул заключено при постоянной температуре в некотором объеме, то за счет хаотических соударений в результате теплового движения запас энергии у разных молекул будет различным. Какая-то доля молекул будет обладать наиболее вероятным запасом энергии Еа. Количество молекул N, обладающих иным запасом энергии, будет меньшим, чем больше их энергия отличается от ЕW.
На рисунке 6.2 (кривая 1) показано типичное распределение молекул по энергии при постоянной температуре t1. При повышении температуры до t2 ЕW возрастает (ЕW2 > ЕW1), и кривая распределения молекул по энергии сдвигается в сторону больших энергий (кривая 2), что приводит к возрастанию во много раз доли молекул, обладающих энергией, равной или большей Еа (заштрихованная область на рисунке). Это и является причиной резкого увеличения скорости химических реакций при повышении температуры.
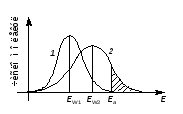
1 – при температуре t1, 2 – при температуре t2 > t1
Рисунок 6.2 – Распределение молекул по энергии
Зависимость скорости реакции от температуры выражается уравнением Аррениуса:
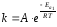 (12)
(12)
где k – константа скорости реакции; А – коэффициент, отражающий природу реагирующих веществ; Еа – энергия активации для данного процесса; R – универсальная газовая постоянная; Т – абсолютная температура.
Зависимость скорости реакции от присутствия катализатора
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции под действием катализаторов называются каталитическими.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации (рисунок 6.3). В присутствии катализатора возникают другие активированные комплексы, для образования которых требуется меньше энергии, чем для образования комплексов, возникающих без катализатора. Таким образом, энергия активации понижается; некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
Под влиянием катализаторов реакции могут ускоряться в миллионы раз и более. В некоторых случаях под действием катализаторов могут возбуждаться такие реакции, которые без них в данных условиях практически не протекают.
В зависимости от того, однородна или неоднородна среда, в которой протекает каталитическая реакция, различают два вида катализа: гомогенный и гетерогенный.
При гомогенном катализе и катализатор, и реагенты находятся в одной фазе, газовой или растворе.
При гетерогенном катализе катализатор и реагенты находятся в разных фазах, например газообразная реакционная смесь и твердый катализатор.
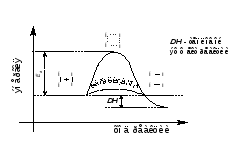
Рисунок 6.3 – Изменение энергии реагирующей системы
Гомогенный катализ, как правило, связан с образованием ре-акционноспособных промежуточных соединений. Примером гомогенного катализа может служить окисление сернистого ангидрида до серного в присутствии оксидов азота. Механизм реакции следующий. Молекула NO легко присоединяет кислород:
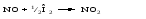
Образовавшаяся молекула отдает кислород на окисление сернистого газа:
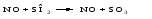
Регенерированная молекула NO снова присоединяет кислород и окисляет и т.д.
При гетерогенном катализе реакция протекает на поверхности катализатора, поэтому особую роль играют площадь поверхности, состав и структура поверхностного слоя катализатора. В свою очередь, структура катализатора зависит от способа его приготовления, в частности, от термической обработки. Наилучшими каталитическими свойствами обычно обладают катализаторы, приготовленные при возможно более низкой температуре и потому имеющие несовершенную кристаллическую структуру и большую удельную поверхность. Так, часто применяемый в качестве катализатора оксид алюминия получают обезвоживанием гидроксида при температуре не выше 400 °С. Никелевые катализаторы, которые используются в реакциях гидрирования, получают восстановлением гидроксида никеля водородом при температуре 300 °С; если температура более высокая, то активность катализатора понижается.
Катализаторы отличаются друг от друга по специфичности действия. Так, существуют универсальные катализаторы, применимые к самым разнообразным реакциям. Например, платина может катализировать как реакции окисления, так и реакции гидрирования, хотя по возможности ее стараются заменять более дешевыми веществами.
Некоторые катализаторы способны катализировать целую группу однотипных реакций, т.е. обладают групповой специфичностью. Например, оксид ванадия может служить катализатором для реакций окисления оксида серы, аммиака и других веществ. Никель является хорошим катализатором для реакций гидрирования (присоединения водорода).
Абсолютной специфичностью отличаются многие ферменты – белковые вещества, являющиеся катализаторами биохимических процессов в живых организмах. Так, в организме человека действует несколько десятков тысяч ферментов, большинство из которых катализируют только одну специфическую реакцию.
В качестве катализатора могут выступать продукты самой реакции – такое явление носит название автокатализа. Например, реакция окисления щавелевой кислоты перманганатом калия ускоряется по мере того, как в системе накапливается продукт реакции – ионы Мn2+, играющие роль катализатора.
Обычно каталитическим действием обладает не вся поверхность катализатора, а лишь незначительная часть ее – так называемые активные центры. Есть вещества – «каталитические яды» (ингибиторы), которые, попадая на катализатор, выводят его из строя, «отравляют» его. Например, платиновые катализаторы отравляются соединениями мышьяка, селена и теллура. Отравление катализатора происходит под действием очень небольших количеств каталитических ядов, достаточных для блокирования лишь активных центров. Действие ингибиторов может быть также связано с дезактивацией активных частиц реагентов и промежуточных продуктов.
В качестве ингибиторов могут выступать не только посторонние для данной реакции вещества. Ими могут быть и продукты самой катализируемой реакции в том случае, если они прочно адсорбируются на поверхности катализатора и закрывают доступ к ней молекулам реагирующих веществ.
Ингибиторы используются на практике для защиты металлов от коррозии, а также для стабилизации малоустойчивых веществ. Так, катализаторами разложения пероксида водорода являются соединения меди, железа, марганца, которые легко могут попасть в нее в производственных условиях. Для связывания этих металлов в нерастворимые соединения к пероксиду добавляют в качестве стабилизатора небольшое количество фосфатов, которые играют роль ингибиторов.
