
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
12.6 Физические и химические свойства оснований
При комнатной температуре все основания - твердые вещества, исключение составляет только одно основание - гидроксид аммония NH4OH, который представляет собой водный раствор аммиака и в свободном виде не существует.
Химические свойства оснований
1 Диссоциация оснований
При диссоциации растворимых оснований образуются катионы металла (катион аммония) и гидроксид-ионы. Однокислотные растворимые основания диссоциируют в одну ступень, многокислотные основания подвергаются ступенчатой диссоциации. Под воздействием образовавшихся в ходе диссоциации гидроксид-ионов изменяется цвет индикаторов (таблица 12.2).
Таблица 12.2 – Цвет индикаторов в различных средах
|
Индикатор |
Цвет индикатора | ||
|
Кислая среда |
Нейтральная среда |
Щелочная среда | |
|
Лакмус Фенолфталеин Метилоранж |
Красный Бесцветный Красный |
Фиолетовый Бесцветный Желтый |
Синий Малиновый Желтый |
2 Взаимодействие оснований с кислотами
Все основания взаимодействуют с кислотами, образуя соль и воду. Эта реакция является реакцией нейтрализации:

3 Взаимодействие оснований с кислотными оксидами
Основания взаимодействуют с кислотными оксидами с образованием соли и воды:

4 Взаимодействие оснований с солями
Растворимые основания реагируют с растворимыми солями, образуя новое основание и новую соль, при этом один из продуктов реакции обязательно должен выделяться в виде осадка:


5 Разложение оснований при нагревании
Нерастворимые основания при нагревании разлагаются на оксид (основной) и воду:

Щелочи разлагаются лишь при очень высоких температурах.
Способы получения оснований
1 Взаимодействие металлов с водой
Взаимодействие наиболее активных (щелочных и щелочноземельных) металлов с водой с образованием щелочи и выделением водорода:


2 Взаимодействие оксидов металлов с водой
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой; в результате взаимодействия образуется щелочь:

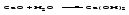
3 Взаимодействие оснований с солями
Действие растворимого основания на соль с образованием нерастворимого основания:
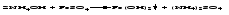
4 Электролиз водных растворов солей щелочных металлов (чаще всего хлоридов) с образованием соответствующих щелочей.
Лекция 13
Вопросы
Кислоты. Общая характеристика, номенклатура и классификация
Физические и химические свойства кислот
Способы получения кислот
Амфотерные оксиды и гидроксиды
Кислоты. Общая характеристика, номенклатура и классификация кислот
Кислотами называются соединения, которые состоят из атомов водорода, способных замещаться атомами металла, а также атомов или групп атомов, называемых кислотными остатками.
Кислоты классифицируют по составу, по числу атомов водорода, способных замещаться металлом, и по степени диссоциации в водных растворах.
По составу кислоты делятся на кислородные (кислородсодержащие, оксокислоты) (HNO3, Н2СО3, Н3РО4), и бескислородные (HF, HC1, H2S).
Число атомов водорода, содержащихся в молекуле кислоты и способных замещаться металлом, определяет основность кислоты. В зависимости от основности кислоты могут быть одноосновные (НСl, HNO3), двухосновные (H2S, H2CO3), трехосновные (Н3РО4).
Основность кислоты может не совпадать с числом атомов водорода в ее молекуле, так как не все атомы водорода способны замещаться металлом. Так, в молекуле уксусной кислоты СН3СООН только один атом водорода может замещаться металлом, поэтому уксусная кислота одноосновная, фосфористая кислота Н3РО3 двухосновная (только два атома водорода замещаются металлом), а фосфорноватистая Н3РO2 одноосновная (замещается металлом только один атом водорода, соединенный с фосфором через кислород).
Это становится понятным из структурных формул соответствующих кислот:

По степени диссоциации в водных растворах различают сильные (серная, хлороводородная, бромоводородная, йодоводородная, азотная, хлорная) и слабые кислоты (фосфорная, уксусная, угольная,сероводородная, сернистая, синильная и др.).
Названия бескислородных кислот составляют из названия элемента, образовавшего кислоту, с добавлением слов – водородная кислота, например: НСl – хлороводородная кислота, H2S ‒ сероводородная кислота.
Название кислородсодержащей кислоты производят от названия образующего ее элемента, причем, если данный элемент образует несколько кислот, в которых проявляет разные степени окисления, то в названиях этих кислот используют разные суффиксы.
В том случае, если элемент может иметь в кислоте только две степени окисления, то в названии кислоты, соответствующей высшей степени окисления элемента, используется суффикс «-н» (или «-ов», «-ев»): H2SO4 – серная, H3AsO4 – мышьяковая, H2SiO3 – кремниевая. В названии кислоты, в которой элемент имеет низшую степень окисления, используется суффикс «-ист»: H2SO3 – сернистая, H3AsO3 – мышьяковистая.
В том случае, если элемент в кислородсодержащих кислотах может иметь более двух степеней окисления, в названиях кислот используются суффиксы «-н», «-ов», «-оват», «-ист», «-оватист» по мере понижения степени окисления элемента: HClO4 – хлорная, HClO3 – хлорноватая, HClO2 – хлористая, HClO – хлорноватистая.
Для некоторых кислот употребляют также исторически сложившиеся названия, не связанные с какой-либо строгой системой, например: HCN – синильная кислота, НСl – соляная кислота, HF – плавиковая кислота.
Если одному оксиду соответствует несколько кислородсодержащих кислот (степень окисления элемента в оксиде и соответствующей ему кислоте одна и та же), содержащих разное количество воды, то перед названием кислоты, в которой количество воды наибольшее, ставится приставка орто-, а перед названием кислоты с наименьшим количеством воды – приставка мета-. Перед названиями кислот, полученных путем частичного обезвоживания ортокислот, ставят приставку пиро-. Например, Н3РО4 – ортофосфорная (или просто фосфорная) кислота, НРО3 – метафосфорная, Н4Р2О7 – пирофосфорная. Последнюю кислоту получают путем частичного обезвоживания ортофосфорной кислоты:

Названия наиболее часто встречающихся на практике кислот и соответствующих кислотных остатков приведены в таблице 13.1.
Физические и химические свойства кислот
Кислоты при обычных условиях могут быть твердыми (Н3РО4), жидкими (HNO3, H2SO4) или растворами газов в воде (НСl, H2S).
Некоторые кислоты, например азотистая HNO2, сернистая H2SO3, угольная H2CO3, существуют только в разбавленных растворах; при попытке концентрирования таких растворов они распадаются на оксид и воду или продукты разложения оксида и воду и, таким образом, не могут быть выделены в чистом виде:

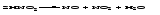
Таблица 13.1 – Названия наиболее часто встречающихся на практике кислот и соответствующих им кислотных остатков
|
Кислота |
Кислотный остаток | |||
|
Формула |
Название |
Формула |
Название | |
|
1 |
2 |
3 |
4 | |
|
HF |
Фтороводородная (плавиковая) |
F- |
Фторид | |
|
НСl |
Хлороводородная (соляная) |
Сl- |
Хлорид | |
|
НВr |
Бромоводородная |
Вr- |
Бромид | |
|
HI |
Иодоводородная |
I- |
Иодид | |
|
H2S |
Сероводородная |
HS- |
Гидросульфид | |
|
S2- |
Сульфид | |||
|
Окончание таблицы 13.1 | ||||
|
1 |
2 |
3 |
4 | |
|
H2SO4 |
Серная |
HSO4- |
Гидросульфат | |
|
SO42- |
Сульфат | |||
|
H2SO3 |
Сернистая |
HSO3- |
Гидросульфит | |
|
SO32- |
Сульфит | |||
|
HNO3 |
Азотная |
NO3- |
Нитрат | |
|
HNO2 |
Азотистая |
NO2- |
Нитрит | |
|
НРОЗ |
Метафосфорная |
PO3- |
Метафосфат | |
|
H3PO4 |
Ортофосфорная (фосфорная) |
H2PO4- |
Дигидрофосфат | |
|
HPO42- |
Гидрофосфат | |||
|
PO43- |
Ортофосфат (фосфат) | |||
|
H4P2O7 |
Двуфосфорная (пирофосфорная) |
H3P2O7- |
Тригидродифосфат | |
|
H2P2O72- |
Дигидродифосфат | |||
|
HP2O73- |
Гидродифосфат | |||
|
P2O74- |
Дифосфат | |||
|
H2CO3 |
Угольная |
HCO3- |
Гидрокарбонат | |
|
CO32- |
Карбонат | |||
|
H2SiO3 |
Кремниевая |
HSiO3- |
Гидросиликат | |
|
SiO32- |
Силикат | |||
|
H2CrO4 |
Хромовая |
HCrO4- |
Гидрохромат | |
|
CrO42- |
Хромат | |||
|
H2Cr2O7 |
Двухромовая |
HCr2O7- |
Гидродихромат | |
|
Cr2O72- |
Дихромат | |||
|
HClO4 |
Хлорная |
ClO4- |
Перхлорат | |
|
HClO3 |
Хлорноватая |
ClO3- |
Хлорат | |
|
HClO2 |
Хлористая |
ClO2- |
Хлорит | |
|
HClO |
Хлорноватистая |
ClO- |
Гипохлорит | |
|
HMnO4 |
Марганцевая |
MnO4- |
Перманганат | |
|
CH3COOH |
Уксусная |
CH3COO- |
Ацетат | |
|
H3BO3 |
Ортоборная (борная) |
H2BO3- |
Дигидроборат | |
|
HBO32- |
Гидроборат | |||
|
BO33- |
Ортоборат (борат) | |||
|
HCN |
Циановодородная (синильная) |
CN- |
Цианид | |
Химические свойства кислот
