
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
6.3 Химическое равновесие
Рассмотрим обратимую реакцию:
A + В = D + F
Скорости прямой и обратной реакции выражаются уравнениями:
 (13)
(13)
 (14)
(14)
В начальный момент времени, когда концентрации исходных веществ СА и СВ максимальны, скорость прямой реакции тоже максимальна. С течением времени скорость прямой реакции уменьшается. Реакция приводит к образованию D и F, молекулы которых, сталкиваясь, могут вновь реагировать, давая A и B. Чем выше концентрация D и F (СD и СF), тем вероятнее обратный процесс и тем выше скорость обратной реакции.
На рисунке 6.4
изображен график зависимостей скоростей
прямой и обратной реакций от времени.
По мере прохождения реакции наступает
такой момент, когда скорости прямой и
обратной реакций становятся равными,
кривые
 и
и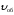 сливаются в одну
прямую линию, параллельную оси времени.
Такое состояние системы называется
состоянием
химического равновесия.
сливаются в одну
прямую линию, параллельную оси времени.
Такое состояние системы называется
состоянием
химического равновесия.
Итак, будем называть химическим равновесием состояние химической системы, не изменяющееся во времени и достижимое с двух противоположных сторон. Иначе говоря, химическое равновесие – это общий предел прямой и обратной реакции.
В состоянии равновесия скорости прямой и обратной реакций равны. Таким образом, химическое равновесие является равновесием динамическим, т.е. в состоянии равновесия химическое взаимодействие не прекращается, одновременно протекают прямая и обратная реакции, причем за единицу времени образуется такое же количество продуктов реакции, сколько их превращается в исходные вещества, в результате чего концентрации веществ, участвующих в равновесии, остаются постоянными.
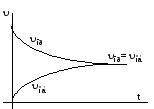
Рисунок 6.4 – Зависимости скоростей прямой и обратной реакций от времени
Состав реакционной смеси, соответствующий состоянию равновесия, называется равновесным составом, а концентрации веществ, находящихся в равновесии, называются равновесными концентрациями.
Итак, при равновесии скорости прямой и обратной реакций равны, значит:
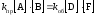 ,
(15)
,
(15)
где [A], [B] и [D], [F] – равновесные концентрации исходных веществ и продуктов реакции соответственно.
Тогда константа химического равновесия:
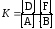 (16)
(16)
Равновесный состав зависит от природы веществ, участвующих в равновесии, от соотношения количеств исходных веществ, а также от внешних условий (температуры, давления). При изменении любого из этих факторов равновесный состав изменяется − равновесие смещается.
Если реакции
характеризуются наличием отличных от
единицы коэффициентов: аА + bВ
 dD
+ fF,
в таком случае:
dD
+ fF,
в таком случае:
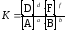 (17)
(17)
Получившееся уравнение – математическая запись закона действующих масс: для одной и той же температуры отношение произведений равновесных концентраций веществ (в степенях их стехиометрических коэффициентов) в правой и левой частях уравнения химической реакции представляет постоянную величину.
В уравнение входят только те концентрации веществ, которые могут изменяться в ходе реакции. Концентрации твердых веществ, а также концентрация растворителя (если реакция протекает в растворе) в уравнение не входят.
Численная величина константы равновесия зависит от температуры, но не зависит от концентрации веществ в равновесной системе. Это значит, что при изменении концентрации одного из веществ концентрации других веществ изменяются за счет протекания реакции в ту или иную сторону таким образом, что константа равновесия остается постоянной. Это правило действует достаточно точно при небольших концентрациях веществ. В некоторых случаях при высоких концентрациях величина константы равновесия может несколько меняться в зависимости от концентрации веществ.
Константа равновесия − одна из важнейших характеристик химической системы, позволяющая судить о возможности протекания того или иного химического процесса и глубины его протекания.
Если К>>1, процесс сильно сдвинут в сторону получения продуктов реакции. Реакция пройдет достаточно глубоко, почти до конца, т. е. исходные вещества, взятые в стехиометрическом соотношении, вступят в реакцию практически полностью.
Если К<<1, наоборот, процесс сдвинут влево и практически не идет. Это означает, что, взяв чистые исходные вещества, удастся провести реакцию при этих условиях (при данной температуре) лишь в незначительной степени.
При К=1 в равновесной смеси концентрации исходных веществ и продуктов реакций одинаковы.
