
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
14.2 Физические и химические свойства средних солей
При обычных условиях соли представляют собой твердые вещества, обладающие различной растворимостью в воде, которая зависит от сочетания металла и кислотного остатка. Физические свойства солей обусловлены тем, что они имеют ионную кристаллическую решетку.
Химические свойства средних солей
1 Диссоциация солей
Средние соли диссоциируют в одну ступень с образованием катионов металлов (катиона аммония) и анионов кислотных остатков.
2 Взаимодействие солей с металлами:

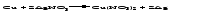
Металлы, расположенные в ряду напряжений левее, могут вытеснять металлы, расположенные в этом ряду правее, из растворов их солей, в результате чего образуется соль более активного металла.
Реакции обмена (3 – 5) идут лишь при условиях, определяющих возможность протекания реакций этого типа
3 Действие кислот на соли:
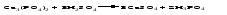
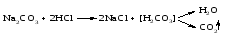
4 Действие оснований (щелочей) на соли:
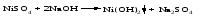
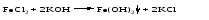
5 Взаимодействие двух солей:
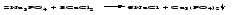
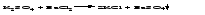
6 Разложение солей
Некоторые соли сравнительно легко разлагаются при нагревании. Так, карбонаты (за исключением карбонатов щелочных металлов) при нагревании разлагаются на оксид металла и углекислый газ:
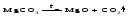
Если же оксид неустойчив, то образуется металл:

Карбонаты щелочных металлов более устойчивы; например, карбонаты натрия и калия плавятся без разложения при температурах выше 850 °С.
Разложение при нагревании характерно также для нитратов. В случае нитратов щелочных металлов продуктами разложения являются соответствующие нитриты:
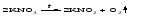
Нитраты других металлов разлагаются до оксидов (если последние устойчивы при нагревании) или до металла (если оксиды неустойчивы). Например:
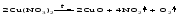

14.3 Способы получения средних солей
1 Синтез из простых веществ (реакция соединения металла и неметалла):

2 Действие кислоты на металл:
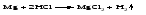
3 Действие металла, стоящего левее в ряду напряжений, на соль металла, находящегося в этом ряду правее:
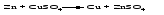
4 Реакция соединения основного и кислотного оксидов:
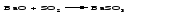
5 Действие кислоты на основный оксид:

6 Действие кислотного оксида на основание:
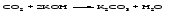
7 Реакция нейтрализации между кислотой и основанием:

8 Реакция обмена соли с растворимым основанием:
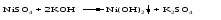
9 Обменная реакция кислоты с солью:
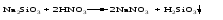
10 Реакция обмена между двумя солями:

Следует отметить, что реакция 1 применима для получения солей только бескислородных кислот, а реакции 4 и 6 – солей только кислородсодержащих кислот. При проведении реакций 8, 9 и 10 необходимо помнить об условиях, при которых реакции обмена идут до конца (практически необратимы).
14.4 Физические и химические свойства кислых и основных солей
Кислые и основные соли – твердые кристаллические вещества, обладающие различной растворимостью в воде.
Растворимость в воде кислых солей является промежуточной между растворимостями соответствующих кислоты и средней соли, а растворимость основных солей – промежуточной между растворимостями соответствующих основания и средней соли. Так, в ряду

наблюдается резкое увеличение растворимости: ортофосфат кальция в нейтральной среде практически нерастворим, гидрофосфат кальция малорастворим, дигидрофосфат растворим значительно лучше и, наконец, фосфорная кислота смешивается с водой в любых соотношениях. Аналогичным образом растворимость быстро увеличивается в ряду
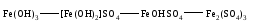
Химические свойства кислых солей
