
- •Химия общая химия
- •Содержание
- •Тема 1. Строение атома. Периодический закон и периодическая система химических элементов д. И. Менделеева
- •Тема 2. Химическая связь
- •Тема 3. Химические реакции
- •5.1 Понятие химической реакции. Признаки классификации химических реакций
- •Тема 4. Основные положения химической кинетики
- •6.2.1 Зависимость скорости реакции от природы реагирующих веществ
- •6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •6.2.3 Зависимость скорости реакции от температуры
- •6.3 Химическое равновесие
- •6.4 Смещение химического равновесия. Принцип Ле-Шателье
- •Тема 5. Ионно-молекулярные реакции
- •7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты
- •8.1 Ионные реакции
- •8.3 Буферные растворы
- •9.1 Гидролиз. Степень гидролиза. Константа гидролиза
- •Тема 6. Окислительно-восстановительные реакции
- •10.3 Составление уравнений овр методом электронного баланса
- •11.1 Типичные окислители и восстановители
- •11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей
- •Тема 7. Основные классы неорганических соединений
- •12.1 Основные классы неорганических соединений
- •1 Взаимодействие оксидов с водой
- •12.6 Физические и химические свойства оснований
- •1 Диссоциация оснований
- •2 Взаимодействие оснований с кислотами
- •1 Диссоциация кислот
- •3 Взаимодействие кислот с основными оксидами:
- •4 Взаимодействие кислот с металлами:
- •5 Взаимодействие кислот с солями
- •1 Взаимодействие простого вещества с водородом
- •2 Взаимодействие оксида с водой
- •3 Взаимодействие кислоты с солью
- •14.2 Физические и химические свойства средних солей
- •14.3 Способы получения средних солей
- •1 Диссоциация солей
1 Взаимодействие оксидов с водой
Основные оксиды с водой образуют основания, если последние растворимы:
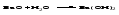

Оксиды, которым соответствуют нерастворимые основания, с водой непосредственно не взаимодействуют.
Кислотные оксиды (ангидриды) с водой образуют кислоты:
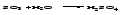
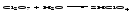
Большинство кислотных оксидов реагирует с водой; оксиды, которым соответствуют нерастворимые кислоты, например, оксид кремния (IV), с водой непосредственно не взаимодействуют.
2 Взаимодействие оксидов с кислотами
Все основные оксиды реагируют с кислотами, образуя соль и воду:


3 Взаимодействие оксидов со щелочами
Кислотные оксиды реагируют со щелочами, образуя соль и воду:

Иногда такие реакции протекают при комнатной температуре очень медленно, например, в случае оксида кремния (IV). Очень медленно идут реакции кислотных оксидов с малорастворимыми основаниями.
4 Взаимодействие основных оксидов с кислотными
Основные оксиды взаимодействуют с кислотными оксидами, образуя соли:

12.4 Способы получения оксидов
1 Взаимодействие простого вещества с кислородом
Во многих случаях оксиды можно получить реакцией соединения простого вещества с кислородом, протекающей, как правило, при нагревании:


Оксиды некоторых элементов, например, хлора, нельзя получить непосредственно соединением с кислородом; такие оксиды получают косвенным путем через другие соединения этих элементов.
2 Термическое разложение кислот, оснований, солей
Многие оксиды можно получить термическим разложением соответствующих кислот, оснований, а также неустойчивых при нагревании солей, например:

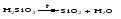
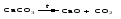

3 Взаимодействие кислоты (щелочи) с солью
Когда ангидриду соответствует неустойчивая кислота или основному оксиду - неустойчивое основание, оказывается возможным получить оксид действием кислоты или щелочи на соответствующую соль. При этом оксид является продуктом разложения соответствующего неустойчивого соединения - кислоты или основания:


4 Окисление сложных веществ
В некоторых случаях оксиды образуются при окислении кислородом сложных веществ:
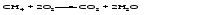

12.5 Основания. Общая характеристика, номенклатура и классификация оснований
Основаниями называются соединения, состоящие из атомов металла, связанных с одной или несколькими гидроксогруппами - ОН, например NaOH, Ba(OH)2, Fe(OH)3.
Особым является неорганическое соединение NH4OH (более точно его состав передается формулой NH3·хН2O). В составе этого соединения группа атомов NH4+ (катион аммония) играет такую же роль, как однозарядный катион металла.
Основания классифицируют по числу гидроксогрупп в молекуле основания, по растворимости в воде и по степени диссоциации в водных растворах.
Число гидроксогрупп в молекуле основания, способных заместиться на анионы кислотных остатков, называют кислотностью основания. Например, NaOH – однокислотное основание, Ва(ОН)2 – двухкислотное, Fe(OH)3 – трёхкислотное.
По растворимости основания делятся на две группы: хорошо растворимые в воде и мало растворимые в воде (их условно называют нерастворимыми).
По степени диссоциации в водных растворах различают сильные и слабые основания. Растворимые в воде сильные основания называются щелочами. Это гидроксиды щелочных и щелочноземельных металлов. Растворы щелочей мыльные на ощупь, разъедают кожу и ткани, поэтому их называют едкими щелочами. Растворимым, но слабым основанием является гидроксид аммония.
Название основания образуется из слова гидроксид и названия металла в родительном падеже, причем для металла с переменной степенью окисления указывается степень окисления. Например, NaOH - гидроксид натрия, Fe(OH)3 - гидроксид железа(III).
Для некоторых щелочей до сих пор употребляются старинные названия, такие как NaOH ‒ едкий натр, КОН ‒ едкое кали, Са(ОН)2 ‒ гашеная известь, Ва(ОН)2 ‒ едкий барит.
