
- •Гальванические элементы
- •1. Гальванические элементы
- •1.1. Механизм возникновения разности потенциалов на границе двух сред
- •М1│раствор1││раствор2│м2
- •1.2. Эдс гальванических элементов
- •1.3. Уравнение Нернста
- •1.4. Определение потенциалов электродов. Стандартный электродный потенциал
- •1.5. Классификация электродов
- •1.5.1. Электроды первого рода
- •1.5.2. Электроды второго рода
- •1.5.3. Газовые электроды
- •1.6. Классификация гальванических элементов
- •2. Термодинамика гальванического элемента
- •3. Экспериментальная часть
- •3.1.2. Порядок выполнения работы
- •3.2. Определение потенциалов отдельных электродов
- •3.2.1. Порядок выполнения работы
- •3.3. Лабораторная работа №15
- •3.3.1 Порядок выполнения работы
- •3.3.2. Обработка результатов измерений
- •4. Контрольные вопросы
- •5. Список рекомендованной литературы
- •6. Приложение
2. Термодинамика гальванического элемента
В гальванических элементах происходит превращение энергии химических реакций в электрическую энергию. Применение законов термодинамики к электрохимическим системам позволяет рассчитать для равновесного процесса, протекающего в гальваническом элементе, изменения термодинамических функций и значение константы равновесия химической реакции.
Электрическая работа гальванического элемента равна его ЭДС (Е), умноженной на количество переносимого электричества:
![]() . (57)
. (57)
С другой стороны, с точки зрения термодинамики при изобарно-изотермическом процессе она совершается за счет убыли энергии Гиббса. Следовательно, можно записать
![]() . (58)
. (58)
Зная
![]() ,
можно определить убыль энтропии -
,
можно определить убыль энтропии -![]() ,
как производную по температуре:
,
как производную по температуре:
![]() .
.
Подставив значение
![]() в (58), получим
в (58), получим
![]() ,
Дж/(моль·К). (59)
,
Дж/(моль·К). (59)
Из термодинамики известно, что уравнение Гиббса-Гельмгольца:
![]() ,
,
откуда
![]() .
.
Подставив![]() из уравнения (58) и
из уравнения (58) и![]() из (59) в
последнее уравнение, получим
из (59) в
последнее уравнение, получим
![]() , (60)
, (60)
![]() , (61)
, (61)
где
![]() - температурный коэффициент ЭДС;
- температурный коэффициент ЭДС;
![]() - ЭДС при температуре Т2;
- ЭДС при температуре Т2;
![]() - ЭДС при температуре Т1, причем
T2> T1.
- ЭДС при температуре Т1, причем
T2> T1.
Для расчета константы равновесия воспользуемся уравнением изотермы Вант-Гоффа для реакций, протекающих в стандартных условиях (активности потенциалопределяющих ионов равны единице):
![]()
Подставив в него уравнение (58) получим
![]() ,
,
откуда
![]() , (62)
, (62)
где
![]() - стандартная ЭДС.
- стандартная ЭДС.
Подставив в формулу (62) значения F=96500 Кл/моль, R=8,314 Дж/(моль·К), получим
![]() . (63)
. (63)
Измерив
![]() при данной температуре, рассчитаем
при данной температуре, рассчитаем![]() и получим константу равновесия химической
реакции, протекающей в гальваническом
элементе.
и получим константу равновесия химической
реакции, протекающей в гальваническом
элементе.
Воспользовавшись уравнением Гиббса-Гельмгольца (60), можно установить зависимость ЭДС от теплового эффекта химической реакции. Для этого уравнение (60) представим следующим образом:
![]() .
.
Тогда имеем в окончательном виде уравнение Гиббса-Гельмгольца для ЭДС гальванического элемента
![]() . (64)
. (64)
В этом уравнении
![]() относится к количеству вещества,
вступившему в реакцию при прохожденииzFколичества электричества, то есть
к одному молю.
относится к количеству вещества,
вступившему в реакцию при прохожденииzFколичества электричества, то есть
к одному молю.
Электрическая работа, совершаемая системой, может быть больше, меньше или равна изменению энтальпии теплового эффекта химических реакций в зависимости от знака температурного коэффициента ЭДС.
При
![]() электрическая работа, совершаемая
системой, меньше изменения энтальпии
и в изотермическом режиме часть тепловой
энергии не превращается в электрическую
работу, а рассеивается в виде теплоты.
Когда же система отделена от окружающей
среды теплонепроводящими стенками
(адиабатические условия), то в процессе
прохождения тока теплота не может
рассеиваться и будет происходить
нагревание системы (гальванического
элемента).
электрическая работа, совершаемая
системой, меньше изменения энтальпии
и в изотермическом режиме часть тепловой
энергии не превращается в электрическую
работу, а рассеивается в виде теплоты.
Когда же система отделена от окружающей
среды теплонепроводящими стенками
(адиабатические условия), то в процессе
прохождения тока теплота не может
рассеиваться и будет происходить
нагревание системы (гальванического
элемента).
Если
![]() ,
то электрическая работа больше изменения
энтальпии, и электрохимическая система
(гальванический элемент) в обратимом
изотермическом режиме превращает в
электрическую работу не только энергию,
выделяющуюся при уменьшении энтальпии
процесса (тепловой эффект химической
реакции), но и часть энергии окружающей
среды. Если доступ теплоты из окружающей
среды к системе затруднен (адиабатические
условия), то система будет охлаждаться.
,
то электрическая работа больше изменения
энтальпии, и электрохимическая система
(гальванический элемент) в обратимом
изотермическом режиме превращает в
электрическую работу не только энергию,
выделяющуюся при уменьшении энтальпии
процесса (тепловой эффект химической
реакции), но и часть энергии окружающей
среды. Если доступ теплоты из окружающей
среды к системе затруднен (адиабатические
условия), то система будет охлаждаться.
Если
![]() ,то
,то![]() (65)
(65)
и электрическая работа
![]() точно равна изменению энтальпии.
Последнее уравнение называется уравнением
Томсона. Его иногда применяют для
ориентировочных расчетов ЭДС.
точно равна изменению энтальпии.
Последнее уравнение называется уравнением
Томсона. Его иногда применяют для
ориентировочных расчетов ЭДС.
При электрических измерениях в качестве
эталонов используют гальванические
элементы, ЭДС которых мало зависит от
температуры
![]() .
Таким элементом является элемент Вестона
(рис. 7).
.
Таким элементом является элемент Вестона
(рис. 7).
Элемент Вестона является стандартным
элементом, так как обладает значением
ЭДС, мало зависящим от температуры. Так
ЭДС насыщенного элемента Вестона при
температуре, близкой к комнатной, находят
по уравнению
![]() ,
при 200С (293 К) –
,
при 200С (293 К) –![]() ,
при 250С (298 К) –
,
при 250С (298 К) –![]() .
.
Отрицательным электродом элемента Вестона является 12,5 % амальгама кадмия Cd(Hg), находящаяся в контакте с насыщенным раствором сульфата кадмия СdSO4. Положительным электродом служат ртуть и твердый сульфат одновалентной ртутиHg2SO4в растворе сульфата кадмия (рис. 7). Оба электрода находятся в постоянном соприкосновении с насыщенным по отношению к кристаллогидратуCdSO4·8/5·H2O раствором. Вывод контактов от полюсов элемента осуществляется платиновой проволокой, впаянной в оба отделения стеклянного сосуда.
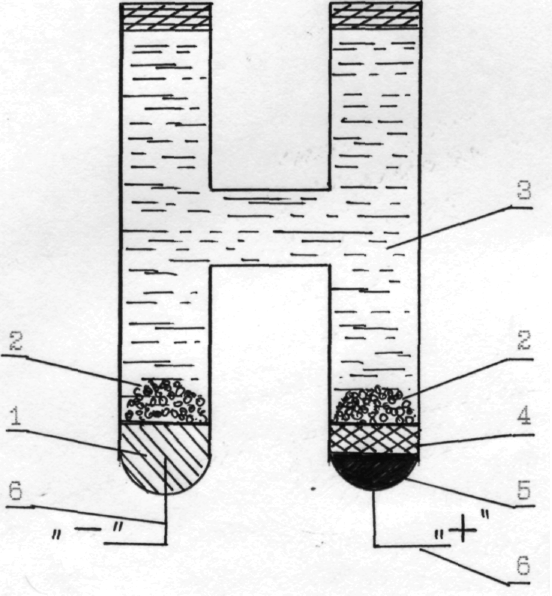
Рис. 7 Схема элемента Вестона
1 – амальгама кадмия; 2 – кристаллогидрат кадмия; 3 – насыщенный раствор сульфата кадмия; 4 – паста сернокислой закиси ртути; 5 – ртуть; 6 – платиновые выводы.
Условно элемент можно записать так:
Cd(Hg)│CdSO4│Hg2SO4│Hg.
При работе элемента на отрицательном электроде идет окисление кадмия:
Cd ⇄ Cd2+ + 2е-,
на положительном – восстановление ртути:
Hg2SO4 + 2е- ⇄ 2Hg + SO2-4
Тогда суммарная реакция будет следующей:
Cd + Hg2SO4 ⇄ 2Hg + CdSO4.
ЭДС элемента Вестона можно рассчитать по уравнению Нернста
![]() .
.
