
- •Гальванические элементы
- •1. Гальванические элементы
- •1.1. Механизм возникновения разности потенциалов на границе двух сред
- •М1│раствор1││раствор2│м2
- •1.2. Эдс гальванических элементов
- •1.3. Уравнение Нернста
- •1.4. Определение потенциалов электродов. Стандартный электродный потенциал
- •1.5. Классификация электродов
- •1.5.1. Электроды первого рода
- •1.5.2. Электроды второго рода
- •1.5.3. Газовые электроды
- •1.6. Классификация гальванических элементов
- •2. Термодинамика гальванического элемента
- •3. Экспериментальная часть
- •3.1.2. Порядок выполнения работы
- •3.2. Определение потенциалов отдельных электродов
- •3.2.1. Порядок выполнения работы
- •3.3. Лабораторная работа №15
- •3.3.1 Порядок выполнения работы
- •3.3.2. Обработка результатов измерений
- •4. Контрольные вопросы
- •5. Список рекомендованной литературы
- •6. Приложение
1. Гальванические элементы
Источники постоянного тока, в которых электрическая энергия получается за счет энергии химической реакции, называются гальваническими элементами. Гальванический элемент состоит из положительного и отрицательного электродов. Электрод представляет собой электрохимическую систему, состоящую их двух фаз. На границе раздела фаз протекает электродный процесс, в результате которого происходит переход электрических зарядов из одной фазы в другую. Каждая граница фазы при этом приобретает свой электрический заряд. На границе раздела фаз создается двойной электрический слой, которому соответствует скачок потенциала.
Электроды состоят из проводника первого рода и проводника второго рода (раствор или расплав электролита).
Электрической характеристикой электрода является равновесный потенциал φ , а гальванического элемента электродвижущая сила (ЭДС)Е. Единицей измерения для потенциала и ЭДС является вольт (В).
1.1. Механизм возникновения разности потенциалов на границе двух сред
В зависимости от характера и природы
соприкасающихся сред различают контактный
потенциал (вольта-потенциал) (![]() V2),
диффузионный потенциалφди потенциал на границе раздела твердой
и жидкой фаз(φ-,φ+).
V2),
диффузионный потенциалφди потенциал на границе раздела твердой
и жидкой фаз(φ-,φ+).
Для унификации системы знаков электродных потенциалов и стандартизации записи электрохимических систем и процессов Международный союз по чистой и прикладной химии принял конвенцию, по которой рекомендована система знаков, принятая в Европе. Любая электрохимическая система (в том числе гальванический элемент) должна записываться следующим образом: сначала указывается материал отрицательного электрода, затем примыкающий к нему раствор, далее раствор, контактирующий с положительным электродом и, наконец, материал положительного.
При такой записи гальванического элемента все образующие ее фазы отделяются друг от друга вертикальной чертой, вещества, входящие в одну фазу, разделяются запятыми. Контактирующие растворы разделяются пунктирной вертикальной чертой, указывающей на существование между двумя растворами диффузионного потенциала. В случае устранения между двумя растворами диффузионного потенциала ставят вместо пунктирной линии две вертикальные черты.
ЭДС элемента называется алгебраическая сумма всех скачков потенциала в гальваническом элементе.
Так, для элемента
М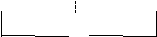 1│раствор1раствор2│
М2
1│раствор1раствор2│
М2
![]()
![]()
![]()
![]() V2
V2
ЭДС равна E=φ-+φ++φд+![]() V2
V2
Контактная разность потенциаловвозникает на границе соприкосновения двух металлов за счет перехода электронов из одного металла в другой. Из двух соприкасающихся металлов положительно заряжается тот, работа выхода электронов из которого меньше. Так, при соприкосновении меди и цинка, цинк, имеющий меньшую работу выхода электронов, заряжается положительно, медь – отрицательно, и на границе их соприкосновения возникает контактный потенциал
![]() (1)
(1)
![]()
Где АCu, AZn– работа выхода электрона из меди и цинка, соответственно;
е-– заряд электрона.
Если гальванический элемент заканчивается
одинаковыми по химическому составу
металлами, то такая система называется
правильно разомкнутой и для нее контактный
потенциал
![]() V2≈0.
Тогда схема элемента запишется:
V2≈0.
Тогда схема элемента запишется:
М 2│М1│раствор1раствор2│М2.
2│М1│раствор1раствор2│М2.
ЭДС элемента называют разность потенциалов на концах правильно разомкнутой электрохимической системы. Обычно в схеме повторную запись металла не указывают, и если это особо не оговорено, то имеем дело с правильно разомкнутыми системами.
Диффузионная разность потенциалов(диффузионный потенциал) возникает на границе соприкосновения двух растворов электролитов, отличающихся концентрациями или природой растворенного вещества.
При соприкосновении двух растворов одного и того же электролита, но разной активности (концентраций) а1иа2(а1 >а2), граница со стороны более концентрированного раствораа1будет заряжаться положительно (рис. 1а) в том случае, если анионы имеют большую скорость диффузии, чем катионы и отрицательно при обратном соотношении скоростей диффузии (рис. 1б).
Таким образом, если привести в соприкосновение, например, растворы нитрата серебра различной активности, то в силу того, что скорость диффузии нитрат-ионов (NO-3) больше, чем скорость диффузии ионов серебра (Ag+), раствор с меньшей активностью нитрата серебра (AgNO3) на границе раздела зарядится отрицательно, а с большей активностью – положительно. (рис. 1а).
В случае же двух соприкасающихся растворов соляной кислоты различной активности получится обратная картина, так как скорость диффузии ионов водорода (Н+) больше, чем у хлорид-иона (рис. 1б).
AgNO3 (a2) HCl (a2)
а) NO-3 NO-3 NO-3 NO-3 NO-3 б)H+ H+ H+ H+ H+
_________________________ __________________
Ag+ Ag+ Ag+ Ag+ Ag+ Cl- Cl- Cl- Cl- Cl-
AgNO3 (a1) HCl (a1)
Рис. 1 Схема движения ионов через границу раздела растворов
Поскольку границы растворов приобретают электрические заряды, то в первом случае скорость диффузии анионов уменьшается, катионов увеличивается, а во втором случае наоборот, скорость диффузии катионов уменьшается, анионов увеличивается, и с течением времени эти скорости становятся одинаковыми. В стационарном состоянии граница электролита диффундирует как единое целое.
При этом граница каждого раствора имеет свой заряд, и разность потенциалов, установившаяся между растворами, соответствует диффузионному потенциалу φд.
Расчет диффузионного потенциала в общем случае затруднен. С учетом некоторых допущений Планком и Гендерсоном выведены формулы для расчета φд. Так, например, при контакте двух растворов одного и того же электролита с различной активностью (а1 >а2)
![]() (2)
(2)
где R– универсальная газовая
постоянная;Т– температура;F– число Фарадея;![]() и
и![]() - предельные молярные электрические
проводимости (подвижности) ионов.
- предельные молярные электрические
проводимости (подвижности) ионов.
В случае, если в гальваническом элементе устранен диффузионный потенциал, то схема записи будет следующей:
