
- •Гидравлика и теплотехника
- •Оглавление
- •1. Общие положения изучаемой дисциплины 10
- •2. Гидродинамика и ГиДродинамические процессы 22
- •3. Тепловые процессы и аппараты 118
- •4. Массообменные процессы и аппараты 162
- •5. Мембранные процессы 283
- •Условные обозначения
- •Введение
- •1. Общие положения изучаемой дисциплины
- •1.1. Классификация основных процессов и аппаратов
- •1.2. Кинетические закономерности основных процессов
- •1.3. Общие принципы расчёта химических машин и аппаратов
- •1.4. Применение метода моделирования для исследования и расчета процессов и аппаратов
- •2. Гидродинамика и ГиДродинамические процессы
- •2.1. Физические свойства жидкостей и газов
- •2.2. Основные уравнения покоя и движения жидкостей
- •2.2.1. Дифференциальные уравнения равновесия Эйлера для покоящейся жидкости
- •2.2.2. Практическое приложение уравнений гидростатики
- •2.2.3. Основные характеристики движения жидкостей
- •2.2.4. Уравнение неразрывности (сплошности) потока
- •2.2.5. Режимы движения жидкостей
- •2.2.6. Турбулентный режим
- •2.2.7. Дифференциальные уравнения движения жидкости
- •2.2.8. Дифференциальные уравнения движения Навье-Стокса
- •2.2.9. Уравнение Бернулли
- •2.2.10. Гидродинамическое подобие
- •2.2.11. Гидравлические сопротивления в трубопроводах и каналах
- •2.2.12. Движение тел в жидкостях
- •2.2.13. Движение жидкостей через неподвижные пористые слои
- •2.2.14. Гидродинамика псевдоожиженных слоев
- •2.3. Перемещение жидкостей (насосы)
- •2.3.1. Классификация и области применения насосов
- •2.3.2. Параметры насосов
- •2.3.3. Насосная установка
- •2.3.4. Основное уравнение лопастных машин (уравнение Эйлера)
- •2.3.5. Характеристики центробежных насосов
- •2.4. Сжатие и перемещение газов (компрессоры)
- •2.4.1. Классификация компрессоров
- •2.4.2. Поршневые компрессоры
- •2.4.3. Теоретический и рабочий процесс в поршневом компрессоре
- •2.4.4. Производительность действительного поршневого компрессора
- •2.4.5. Роторные компрессоры
- •2.4.6. Принцип действия, классификация и устройство турбокомпрессоров
- •2.5. Процессы разделения неоднородных смесей
- •2.5.1. Классификация неоднородных систем и способов их разделения
- •2.5.2. Материальные балансы процессов разделения
- •2.6. Осаждение
- •2.7. Фильтрование
- •2.8. Перемешивание в жидких средах
- •3. Тепловые процессы и аппараты
- •3.1. Способы передачи теплоты
- •3.2. Тепловые балансы
- •3.3. Температурное поле и температурный градиент
- •3.4. Передача тепла теплопроводностью
- •3.5. Тепловое излучение
- •3.6. Конвективный теплообмен
- •3.6.1. Теплоотдача
- •3.6.2. Дифференциальное уравнение конвективного теплообмена
- •3.6.3. Подобие процессов теплообмена
- •3.6.4. Теплоотдача при свободном и вынужденном движении жидкости
- •3.6.5. Теплоотдача при изменении агрегатного состояния
- •3.7. Сложный теплообмен
- •3.8. Процессы нагревания, охлаждения и конденсации
- •3.9. Теплообменные аппараты
- •3.9.1. Классификация и типы теплообменных аппаратов
- •3.9.2. Расчет теплообменных аппаратов
- •3.9.3. Выбор и проектирование поверхностных теплообменников
- •4. Массообменные процессы и аппараты
- •4.1. Основы массопередачи
- •4.1.1. Общие сведения о массообменных процессах
- •4.1.2. Основные расчетные зависимости массообменных процессов
- •4.1.3. Материальный баланс массообменных процессов
- •4.1.4. Движущая сила массообменных процессов
- •4.1.5. Модифицированные уравнения массопередачи
- •4.1.6. Основные законы массопередачи
- •4.1.7. Подобие процессов переноса массы
- •4.1.8. Связь коэффициентов массопередачи и массоотдачи
- •4.1.9. Массопередача с твердой фазой
- •4.2. Абсорбция
- •4.2.1. Равновесие при абсорбции
- •4.2.2. Материальный, тепловой балансы и кинетические закономерности абсорбции
- •4.2.3. Принципиальные схемы абсорбции
- •4.2.4. Конструкции колонных абсорбционных аппаратов
- •4.2.5. Десорбция
- •4.3. Перегонка жидкостей
- •4.3.1. Идеальные и неидеальные смеси
- •4.3.2. Простая перегонка
- •4.3.3. Ректификация
- •4.3.4. Ректификация многокомпонентных смесей
- •4.3.5. Тепловой баланс процесса ректификации
- •4.3.6. Специальные виды перегонки
- •4.3.7. Устройство ректификационных аппаратов
- •4.4. Экстракция
- •4.4.1. Жидкостная экстракция
- •4.4.2. Равновесие при экстракции
- •4.4.3. Материальный баланс экстракции
- •4.4.4. Кинетические закономерности процесса экстракции
- •4.4.5. Принципиальные схемы процесса экстракции
- •4.4.6. Конструкции экстракторов
- •4.5. Адсорбция
- •4.5.1. Равновесие в процессах адсорбции
- •4.5.2. Промышленные адсорбенты
- •4.5.3. Конструкции адсорбционных аппаратов и методы проведения адсорбционно-десорбционных процессов
- •4.6. Сушка
- •4.6.1. Равновесие в процессах сушки
- •4.6.2. Конструкции сушилок и области их применения
- •4.6.3. Материальный и тепловой балансы сушки
- •Количество влаги, удаляемой в сушилке:
- •4.7. Кристаллизация и растворение
- •4.7.1. Общие сведения
- •4.7.2. Равновесие при кристаллизации
- •4.7.3. Кинетика процесса кристаллизации
- •4.7.4. Факторы, влияющие на процесс кристаллизации
- •4.7.5. Материальный и тепловой балансы кристаллизации
- •4.7.6. Кристаллизаторы
- •5. Мембранные процессы
- •5.1 . Процессы мембранного разделения смесей. Сущность процесса мембранного разделения смесей
- •5.2. Кинетика процессов мембранного разделения смесей
- •5.3. Влияние различных факторов на мембранное разделение
- •5.4. Мембраны
- •5.4.1. Уплотняющиеся (полимерные) мембраны
- •5.4.2. Мембраны с жесткой структурой
- •5.4.3. Жидкие мембраны
- •5.5. Физико-химические основы мембранных процессов
- •5.6. Баромембранные процессы
- •5.7. Диффузионно-мембранные процессы
- •5.8. Электромембранные процессы
- •5.9. Термомембранные процессы
- •5.10. Расчет мембранных процессов и аппаратов
- •5.11. Мембранные аппараты
- •Библиографический список
- •Гидравлика и теплотехника
4.6.3. Материальный и тепловой балансы сушки
Материальный и тепловой балансы рассмотрим на примере конвективной сушилки.
При
расчете процесса в сушилке должна быть
задана начальная
![]() и конечная
и конечная
![]() влажности материала:
влажности материала:
влажность по влажному материалу количество влаги, отнесенное к весу влажного материала:
 ;
;
влажность по сухому материалу – количество влаги, отнесенное к весу сухого материала:
 .
.
Связь между влажностями по влажному и сухому материалу выражается следующими соотношениями:
![]() ;
;
![]() .
.
Количество абсолютно сухого вещества
![]() .
.
Количество высушенного вещества
 .
.
Количество вещества, поступающего на сушку:
 .
.
Количество влаги, удаляемой в сушилке:
 или
или
 .
.
При расчетах сушилок приходится относить производительность сушилок по влаге или по высушенному веществу к единице поверхности нагрева или единице объема сушилки. Эта величина, зависящая от типа сушилки, влажности материала и др., называется напряжением сушилки:
![]() ,
,
где
![]() – время сушки, с.
– время сушки, с.
Для сушилок контактного типа
![]() .
.
Баланс влаги в конвективной сушильной установке
Исходя из уравнения материального баланса, можно определить расход воздуха в сушилке, из уравнения баланса влаги
![]() ,
,
![]() ;
;
удельный расход сухого воздуха
![]() ,
,
![]() ,
,
так
как
![]() ,
то удельный расход сухого воздуха
,
то удельный расход сухого воздуха
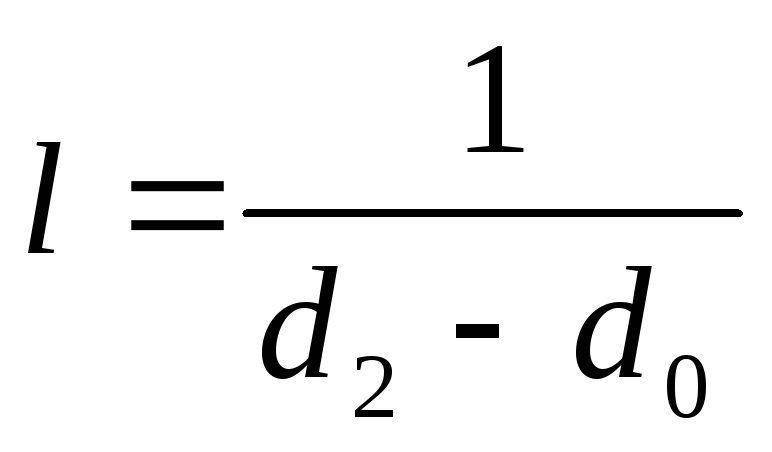 .
.
Тепловой баланс конвективной сушильной установки
Приход тепла в сушилку:
с сушильным агентом –
 ;
;с влагой материала –
 ;
;с материалом –
 ;
;с транспортными устройствами –
 ;
;от источника тепла в калорифере –
 (не учитывается при сушке дымовыми
газами);
(не учитывается при сушке дымовыми
газами);от дополнительного источника тепла –
 .
.
Расход тепла:
с уходящим воздухом –
 ;
;с высушенным материалом –
 ;
;с транспортными устройствами –
 .
.
Потери
в окружающую среду –
![]() .
.
У равнение
теплового баланса
равнение
теплового баланса
где
![]() – теплоемкость высушиваемого материала;
– теплоемкость высушиваемого материала;![]() – температура влаги и материала на
входе в сушилку;
– температура влаги и материала на
входе в сушилку;![]() – температура материала на выходе из
сушилки.
– температура материала на выходе из
сушилки.
Теплоемкость высушиваемого материала
![]() .
.
Уравнение теплового баланса на 1 кг испаренной влаги
![]() .
.
Удельный расход тепла в калорифере
![]()
или
![]() .
.
Обозначив
![]() ,
,
получим уравнение баланса сушильной камеры
![]() .
.
Это выражение характеризует отклонение действительного процесса сушки от теоретического и представляет собой внутренний баланс тепла в сушилке.
Для
теоретической сушилки
![]() ,
тогда
,
тогда
![]() ,
т. е.
,
т. е.
![]() .
.
4.7. Кристаллизация и растворение
4.7.1. Общие сведения
Кристаллизация представляет собой процесс выделения твердой фазы из растворов, расплавов или паров. Кристаллы – однородные твердые вещества различной геометрической формы, ограниченной плоскими гранями.
Продукт, получаемый в результате кристаллизации, представляет собой сыпучую массу кристаллов различного размера. Внешняя геометрическая форма кристаллов специфична для каждого вещества. Характерной особенностью кристаллического строения вещества является определенное, периодически повторяющееся в трех измерениях расположение ионов, атомов или молекул, образующих кристаллическую решетку.
В основу классификации кристаллов положена их симметрия. Известны 32 вида симметрии кристаллов. Для удобства они сгруппированы в 7 кристаллографических форм, или сингоний (кубическая, тригональная, тетрагональная, гексагональная, ромбическая, моноклинная, триклинная), и в 3 категории: высокую, к ней относится первая форма; среднюю и низкую (относятся следующие формы по три).
Ряд веществ, чаще всего химически однотипных, имеющих подобную кристаллическую решетку и при кристаллизации из растворов выделяющихся совместно, образуют смешанные кристаллы. Такие вещества называются изоморфными.
В зависимости от условий кристаллизации (температуры, давления и др.), одно и то же вещество может образовывать разные по симметрии и форме кристаллы, называемые полиморфными разновидностями или модификациями.
Кристаллы, включающие молекулы воды, называют кристаллогидратами. В зависимости от условий проведения процесса кристаллизации одно и то же вещество может кристаллизоваться с разным числом молекул воды.
В химической технологии наибольший интерес представляет процесс кристаллизации из растворов для получения различных веществ высокой чистоты. Проведение такого процесса в промышленном масштабе с одновременным получением большого числа кристаллов называется массовой кристаллизацией.
Растворы– однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами.
В отличие от состава химических соединений, состав растворов может в известных пределах непрерывно изменяться. Растворы бывают газообразными, жидкими и твердыми. Одно из веществ, образующих раствор, называется растворителем, остальные –растворенными веществами. Для жидких растворов, которые будут нами рассматриваться, растворителем принято считать то вещество, которое при образовании раствора находилось в жидком состоянии. Наиболее распространенным растворителем, используемым в химической технологии, является вода. Твердые неорганические вещества (хлориды, сульфаты и т.п.) при растворении в воде распадаются на отдельные ионы, а органические вещества (мочевина, сахар и др.) – на отдельные молекулы.
Наибольшее влияние на растворимость твердых веществ в каком-либо растворителе оказывает температура раствора. На растворимость газов в жидкостях существенное влияние оказывает также внешнее давление.
У большинства веществ растворимость с повышением температуры раствора увеличивается. В таком случае речь идет о прямой, положительной растворимости (хлориды, сульфаты натрия, калия, сахар и т.п.). Однако у некоторых веществ растворимость с повышением температуры раствора уменьшается (гипс, сода в воде). Такие вещества имеютобратную, отрицательную растворимость.
Очень важными в теории процессов растворения и кристаллизации являются понятия о ненасыщенном, насыщенном и пересыщенном растворах.
Ненасыщеннымназывается такой раствор, который способен в данных условиях растворить в себе некоторое количество содержащегося в нем вещества.
К насыщеннымотносятся растворы, которые не изменяют своего состава, находясь в контакте с кристаллами растворенных в них веществ. Содержание растворенного вещества в насыщенном растворе соответствует его растворимости при данных условиях. Однако если изменить условия, например повысить температуру раствора, то кристаллы могут снова начать растворяться, а состав раствора при этом будет изменяться. Если этот же раствор охладить, то из него начнут выделяться кристаллы растворенного вещества. Это происходит потому, что в рассматриваемом нами растворе с понижением температуры растворимость соли уменьшается. Кристаллы будут выделяться до тех пор, пока раствор не станет снова насыщенным, но уже при более низкой температуре. В течение всего этого времени количество вещества, содержащегося в растворе, превышало его растворимость, а раствор находился в пересыщенном состоянии.
Пересыщеннымназывается раствор, в котором содержание какого-либо вещества в растворенном виде превышает его растворимость в данных условиях.
Растворениемназывается процесс взаимодействия растворителя с полностью растворяемой твердой фазой, не образующей остаточной пористой структуры (скелета) и шлама ( нерастворимого осадка). При наличии пористого тела процесс перехода растворимого вещества в раствор называютвыщелачиванием. Выщелачивание происходит в две стадии: диффузия внутри пор и массоотдача с геометрической поверхности тела. Растворение предполагает взаимодействие растворителя с твердым телом только на его внешней поверхности.
Растворение – это процесс, обратный кристаллизации; в ряде химических производств он имеет самостоятельное значение. Путем чередования процессов кристаллизации и растворения (перекристаллизации) получают наиболее чистые продукты.
