- •Фізичний практикум з механіки та молекулярної фізики
- •§1. Рекомендації з вимірювання фізичних величин та загальні правила роботи у фізичних лабораторіях 9
- •§2. Лабораторні роботи з механіки 35
- •§ 4. Довідникові матеріали з механіки та молекулярної фізики 223
- •§1. Рекомендації з вимірювання фізичних величин та загальні правила роботи у фізичних лабораторіях
- •1.1. Визначення похибок вимірювань
- •1.1.1. Абсолютні та відносні похибки
- •1.1.2. Прямі та непрямі вимірювання
- •1.1.3. Систематичні та випадкові похибки
- •1.1.3.1. Систематичні похибки
- •1.1.3.2. Випадкові (статистичні) похибки
- •1.2. Рекомендації щодо обробки результатів вимірювань та їхнього запису
- •1.2.1. Правила запису результатів
- •1.2.2. Правила визначення похибки прямих вимірювань
- •Коефіцієнти Стьюдента tp
- •Кількість вимірювань п, що гарантує величину обраної частки випадкової помилки
- •1.2.3. Визначення похибки непрямих вимірювань
- •Формули для оцінки похибок результату непрямого вимірювання
- •Різноманітних фізичних явищ. В ній також наведено вирази для розрахунків абсолютної та відносної похибок для цих функціональних залежностей.
- •1.3. Графічне представлення експериментальних результатів
- •1.3.1. Правила побудови графіків
- •1.3.2. Метод найменших квадратів
- •1.4. Правила поведінки студентів у фізичних лабораторіях
- •1.5. Правила оформлення лабораторного журналу
- •Лабораторний журнал
- •З Фізичного практикуму
- •Студента групи тп-11 фтф
- •Сидоренка Володимира
- •1.6. Зразок звіту про виконання лабораторної роботи
- •§2. Лабораторні роботи з механіки
- •2.1. Лабораторна робота «Вивчення рівноприскореного руху та визначення величини прискорення вільного падіння на машині Атвуда»
- •3. Порядок виконання роботи
- •2.2. Лабораторна робота «Дослідження закону збереження енергії та визначення моменту інерції механічного тіла відносно фіксованої осі обертання за допомогою маятника Максвела»
- •1.1. Робота з приладом
- •1.2. Параметри маятника
- •3. Порядок виконання роботи
- •2.3. Лабораторна робота «Визначення прискорення сили тяжіння за допомогою фізичного та математичного маятників»
- •2.4. Лабораторна робота «Визначення моментів інерції твердого тіла за допомогою обертового маятника»
- •3. Порядок виконання роботи
- •2.5. Лабораторна робота «Визначення коефіцієнтів тертя за допомогою похилого маятника»
- •3. Порядок виконання роботи
- •2.6. Лабораторна робота «Визначення швидкості польоту тіла за допомогою балістичного маятника»
- •2.1. Короткі теоретичні відомості
- •2.2. Порядок виконання роботи
- •3.1. Короткі теоретичні відомості
- •3.2. Порядок виконання роботи
- •2.7. Лабораторна робота «Вивчення особливостей руху гіроскопа»
- •4. Порядок виконання роботи
- •2.8. Лабораторна робота «Вивчення будови терезів та техніки зважування»
- •2.9. Лабораторна робота «Вивчення основного закону динаміки обертального руху на хрестовому маятнику Обербека»
- •2.10. Лабораторна робота «Визначення роботи деформації, коефіцієнта відновлення, часу та сили взаємодії тіл при ударі»
- •2.11. Лабораторна робота «Вивчення вимушених механічних коливань»
- •2.12. Лабораторна робота «Вивчення параметричних механічних коливань»
- •3. Порядок виконання роботи
- •§3. Лабораторні роботи з молекулярної фізики
- •3.1. Лабораторна робота «Визначення довжини вільного пробігу та ефективного діаметра молекул повітря»
- •1. Ознайомлення з основами теорії стаціонарних процесів перенесення
- •2. Опис лабораторного устаткування
- •3. Порядок виконання роботи
- •4. Обробка отриманих результатів вимірювань
- •5. Представлення здобутих результатів
- •3.2. Лабораторна робота «Визначення коефіцієнта внутрішнього тертя рідини методом Стокса»
- •1. Короткі теоретичні відомості про стаціонарні явища перенесення
- •2. Визначення коефіцієнта внутрішнього тертя рідини
- •3. Опис лабораторного устаткування
- •4. Порядок виконання роботи
- •5. Обробка отриманих результатів вимірювань
- •6. Представлення здобутих результатів
- •3.3. Лабораторна робота «Визначення відношення величин теплоємностей газу за умов сталого тиску та сталого об’єму»
- •1. Короткі теоретичні відомості
- •2. Визначення коефіцієнта Пуассона
- •3. Порядок виконання роботи
- •4. Обробка здобутих результатів вимірювань
- •5. Представлення здобутих результатів
- •3.4. Лабораторна робота «Визначення вологості повітря»
- •1. Короткі теоретичні відомості.
- •2. Визначення вологості повітря методом психрометра
- •3. Опис приладу та вимірювання відносної вологості повітря
- •4. Порядок виконання роботи
- •3.5. Лабораторна робота «Визначення швидкості звуку у повітрі інтерференційним методом»
- •1. Ознайомлення з основами теорії поширення звуку
- •2. Опис лабораторного обладнання
- •3. Порядок виконання роботи
- •4. Обробка здобутих результатів вимірювань
- •5. Представлення здобутих результатів
- •3.6. Лабораторна робота «Визначення коефіцієнта теплопровідності металів»
- •1. Ознайомлення з основами класичної теорії теплопровідності
- •2. Теоретичне обґрунтування методики експерименту
- •3. Опис лабораторної установки
- •4. Порядок виконання роботи
- •5. Обробка здобутих результатів вимірювань
- •6. Представлення здобутих результатів
- •3.7. Лабораторна робота «Визначення питомої теплоємності твердих тіл методом адіабатичного калориметра»
- •1. Короткі теоретичні відомості
- •2. Опис лабораторного обладнання
- •3. Порядок виконання роботи
- •3.8. Лабораторна робота «Визначення коефіцієнтів пружності при поздовжній та поперечній деформаціях»
- •1. Короткі теоретичні відомості
- •2. Опис лабораторної установки для визначення модуля Юнга
- •3. Порядок виконання роботи з визначення модуля Юнга
- •4. Визначення модуля зсуву g
- •5. Опис лабораторної установки з визначення модуля зсуву
- •6. Порядок виконання роботи з визначення величини g
- •3.9. Лабораторна робота «Вимірювання тиску газу в вакуумній камері, що відкачується форвакуумним насосом»
- •1. Короткі теоретичні відомості
- •1.3. Манометри, що вимірюють низький тиск
- •1.4. Вакуумметр віт-2 (призначення та правила роботи)
- •1.5. Вакуумметр термопарний
- •3. Порядок виконання роботи
- •3.2. Вимикання установки та вимірювання натікання газу до вакуумного балону
- •3.10. Лабораторна робота «Визначення питомої теплоти пароутворення води»
- •1. Короткі теоретичні відомості
- •2. Опис лабораторної установки
- •3. Порядок виконання роботи
- •3.11. Лабораторна робота «Визначення питомої теплоти плавлення олова та побудова діаграми стану оловосвинець»
- •1. Короткі теоретичні відомості
- •2. Опис установки
- •3. Визначення питомої теплоти плавлення олова
- •4. Оцінка похибки вимірювання
- •5. Побудова діаграми стану системи оловосвинець
- •§ 4. Довідникові матеріали з механіки та молекулярної фізики
- •4.10. Густина рідин (, кг/м3)
- •4.11. Термодинамічні сталі газів (за нормальних умов): молярна маса, показник адіабати, коефіцієнт теплопровідності, коефіцієнт внутрішнього тертя,, діаметр молекул d
- •4.12. Сталі Ван-дер-Ваальса
- •4.17. Коефіцієнти теплопровідності, температура та питома теплота плавлення твердих тіл
- •4.18. Пружні сталі твердих тіл (величини вказаних коефіцієнтів пружності сильно залежать від технології виготовлення, наявності домішок таке інше )
- •4.19. Граничні коефіцієнти для твердих тіл та води
- •4.21. Коефіцієнти тертя ковзання
- •4.22. Коефіцієнти тертя кочення,, см
- •4.23. Швидкість звуку в газах
- •4.24. Швидкість звуку у повітрі при різних температурах
- •4.24. Швидкість звуку у рідинах
- •4.27. Психрометрична таблиця відносної вологості повітря
- •Список літератури
- •Предметний покажчик
5. Обробка отриманих результатів вимірювань
В даній лабораторній
роботі у якості рідини, для якої
визначається коефіцієнт внутрішнього
тертя, використовують гліцерин. Його
густина при 20C
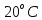 складає
величину
гл=1.26×103
кг/м3.
Густина металу, з якого виготовлено
кульки, м=7.8×103
кг/м3.
Коефіцієнт
для кожного експерименту
з усіма
кульками обчислюється окремо за наступною
формулою:
складає
величину
гл=1.26×103
кг/м3.
Густина металу, з якого виготовлено
кульки, м=7.8×103
кг/м3.
Коефіцієнт
для кожного експерименту
з усіма
кульками обчислюється окремо за наступною
формулою:
 .
(3.31)
.
(3.31)
Під
час виконання роботи вимірювались
наступні величини: d
– діаметр кульки; t
– час рівномірного руху кульки; l
– довжина шляху рівномірного руху
кульки, Dз
– зовнішній
діаметр циліндра.
Внутрішній діаметр циліндра D
обчислено за
допомогою виміряного значення. Отже,
величини 
 ,
,
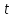
 ,l
,l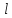 ,
D
визначено з певною похибкою. Враховуючи
це, формула для обчислення абсолютної
похибки для
має вигляд:
,
D
визначено з певною похибкою. Враховуючи
це, формула для обчислення абсолютної
похибки для
має вигляд:
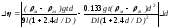 +
+
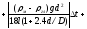
 (3.32)
(3.32)
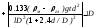 .
.
Обчисленні значення та заносяться до таблиці:
|
№ досліду |
Коефіцієнт
внутрішнього тертя,
|
Абсолютна
похибка,
|
|
1 |
|
|
|
… |
|
|
|
N |
|
|
За
даними з цієї таблиці обчислюється
середнє значення коефіцієнта внутрішнього
тертя
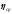 відповідно до формули:
відповідно до формули:
 .
(3.33)
.
(3.33)
Абсолютна
похибка для 
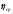 обчислюється за формулою:
обчислюється за формулою:
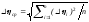 .
(3.34)
.
(3.34)
6. Представлення здобутих результатів
Записати
отримане значення коефіцієнта внутрішнього
тертя
 (Па с), обчислити
відносну похибку для
за формулою:
(Па с), обчислити
відносну похибку для
за формулою:
 .
(3.35)
.
(3.35)
Порівняти отримане значення коефіцієнта внутрішнього тертя з табличним. Розрахувати відносне відхилення отриманого значення коефіцієнта внутрішнього тертя від табличного таб за формулою:
 . (3.36)
. (3.36)
Контрольні питання
1. Який фізичний зміст має коефіцієнт внутрішнього тертя?
2. Порівняти залежності коефіцієнтів внутрішнього тертя в газах та рідинах від температури, пояснити природу внутрішнього тертя в цих середовищах.
3. Який радіальний профіль має швидкість упорядкованого руху при протіканні речовини у системах з великим радіусом поперечного перетину (значно більшим ніж довжина вільного пробігу)?
4. Який розподіл частинок ідеального газу за довжиною вільного пробігу?
5. Як пов’язано коефіцієнти дифузії та в’язкості у теорії перенесення для ідеальних газів, в яких одиницях вони вимірюються?
6. Яке явище називають тепловим ковзанням, з чим воно пов’язано?
7. Що та в якому напрямку переноситься в процесі внутрішнього тертя?
3.3. Лабораторна робота «Визначення відношення величин теплоємностей газу за умов сталого тиску та сталого об’єму»
Мета
роботи:
експериментально визначити відношення
величин теплоємності газу при сталому
тиску Cp
до теплоємності газу при сталому об’ємі
газу CV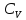 .
.
Обладнання: скляний балон великого об’єму, який з’єднано з рідинним манометром, система впуску та випуску газу з балону.
1. Короткі теоретичні відомості
Частка Cp/CV=
 є
показником ступеня в рівнянні Пуассона,
яке описує рівноважний адіабатичний
(ізоентропійний) процес, тобто процес,
який відбувається без обміну теплом із
зовнішнім середовищем. Тому часто її
називають показником адіабати. Показник
ізентропи
відіграє важливу роль в описі реальних
технічних процесів, які
є близькими
до ізоентропійного процесу. Для прикладу
вкажемо, що ,
зокрема, визначає швидкість поширення
звуків у газах, від неї залежить плин
газів по трубах зі звуковими швидкостями.
Описаний нижче спосіб визначення
показника адіабати газу було запропоновано
Дезормом та Клеманом. У ньому досліджуються
процеси швидкого збільшення та зменшення
об’єму газу, які вважаються ізоентропічними,
оскільки за час їхнього протікання
процес теплопередачі не встигає
реалізуватися.
є
показником ступеня в рівнянні Пуассона,
яке описує рівноважний адіабатичний
(ізоентропійний) процес, тобто процес,
який відбувається без обміну теплом із
зовнішнім середовищем. Тому часто її
називають показником адіабати. Показник
ізентропи
відіграє важливу роль в описі реальних
технічних процесів, які
є близькими
до ізоентропійного процесу. Для прикладу
вкажемо, що ,
зокрема, визначає швидкість поширення
звуків у газах, від неї залежить плин
газів по трубах зі звуковими швидкостями.
Описаний нижче спосіб визначення
показника адіабати газу було запропоновано
Дезормом та Клеманом. У ньому досліджуються
процеси швидкого збільшення та зменшення
об’єму газу, які вважаються ізоентропічними,
оскільки за час їхнього протікання
процес теплопередачі не встигає
реалізуватися.
Суть запропонованого
методу визначення показника адіабати
газу полягає у порівнянні параметрів
стану газу, який виконує поступово
кілька процесів, серед яких є два різних
адіабатичних процеси. У скляному балоні,
який з'єднано
з манометром, знаходиться
певний об’єм газу (повітря); визначимо
це, як перший стан (1) термодинамічної
системи (повітря в балоні). Цей стан
описується наступним набором
термодинамічних величин

 та масою повітря в балоніm
та масою повітря в балоніm .
.
Якщо до балону
швидко за допомогою гумової груші
нагнітати повітря, то повітря в ньому
до певної міри нагріється
це буде другий стан (2) нашої термодинамічної
системи
T2,
P2,
V2.
 Слід
зауважити, що маса повітря в системі
змінилась на величинуm,
а об’єм повітря, яке повністю заповнює
балон, не змінився, тобто V1=V2
Слід
зауважити, що маса повітря в системі
змінилась на величинуm,
а об’єм повітря, яке повністю заповнює
балон, не змінився, тобто V1=V2 .
.
Внаслідок теплообміну
між повітрям в балоні та навколишнім
середовищем через якийсь час температура
повітря в балоні зрівняється з кімнатною
температурою. В цьому стані (3) система
описується наступним набором
термодинамічних величин 
 та масою повітря
та масою повітря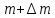
 .
.
Розглянемо цей
стан більш ретельно. Об’єм повітря
у
балоні не змінився, тобто 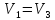
 .
Але з часом, внаслідок теплообміну,
повітря охолоне до кімнатної температури,
отже,
.
Але з часом, внаслідок теплообміну,
повітря охолоне до кімнатної температури,
отже,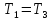
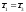 .
В стані (1) тиск повітря був
.
В стані (1) тиск повітря був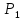
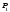 ,
а в стані (3) тиск повітря буде дорівнювати
,
а в стані (3) тиск повітря буде дорівнювати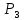
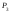 .
Тиск повітря у балоні вимірюється
рідинним манометром, завдяки якому ми
можемо визначити значення
.
Тиск повітря у балоні вимірюється
рідинним манометром, завдяки якому ми
можемо визначити значення
 ,
яке буде дорівнювати
,
яке буде дорівнювати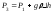
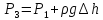 ,
де
,
де
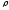
густина манометричної рідини,
густина манометричної рідини, 

прискорення вільного падіння,
прискорення вільного падіння, 

різниця висот стовпчиків рідини в
манометрі. Запишемо рівняння стану
досліджуваної термодинамічної системи
у першому (1) та третьому (3) станах:
різниця висот стовпчиків рідини в
манометрі. Запишемо рівняння стану
досліджуваної термодинамічної системи
у першому (1) та третьому (3) станах:
 (3.37)
(3.37)
Віднявши від другого рівняння перше, а потім поділивши результат на перше рівняння, ми отримаємо:
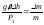 .
(3.38)
.
(3.38)
Обчислимо
відносну величину зміни маси. Якщо взяти
до уваги, що
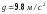 ,
, ,
атмосферний тиск
,
атмосферний тиск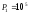 Па, а
лабораторне обладнання не може забезпечити
зміну висоти стовпчика манометра більшу
за 40 см, то ми отримаємо таку оцінку:
Па, а
лабораторне обладнання не може забезпечити
зміну висоти стовпчика манометра більшу
за 40 см, то ми отримаємо таку оцінку:
 , (3.39)
, (3.39)
що
є набагато менше одиниці. З цього можна
зробити наступний висновок: кількістю
маси повітря, що ми додали до об’єму
лабораторного пристрою можна знехтувати.
Враховуючи це, можна розглядати процес
переходу зs стану (1) до стану (2) як
адіабатичний процес стискання газу.
Стан газу (2) при цьому описується набором
термодинамічних величин
 ,
а маса газу вважається незмінною. В
такому випадку
,
а маса газу вважається незмінною. В
такому випадку ,
,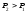 ,
, (див. рис. 3.4).
(див. рис. 3.4).
Внаслідок теплообміну між повітрям в балоні та навколишнім середовищем через якийсь час температура повітря в балоні зрівняється з кімнатною температурою. В цьому
|
|
|
Рис. 3.4. Процеси, що відбуваються в системі: 1 → 2 адіабатичний процес нагнітання повітря, 2 → 3 ізохоричний процес охолодження повітря до кімнатної температури, 3 → 4 адіабатичний процес розширення повітря, 4 → 5 ізохоричний процес нагрівання повітря до кімнатної температури |
стані
система описується наступним набором
термодинамічних величин
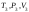 ,
нагадаємо що маса газу вважається
незмінною. Процес охолодження відбувається
при сталому об’ємі (ізохоричний процес),
таким чином у стані (3)
,
нагадаємо що маса газу вважається
незмінною. Процес охолодження відбувається
при сталому об’ємі (ізохоричний процес),
таким чином у стані (3) ,
, ,
,
 .
.
Якщо тепер змусити
повітря в балоні швидко розширитися,
відкривши кран балону та одразу ж його
закривши, тоді внаслідок розширення
повітря охолоне, а його тиск впаде до
атмосферного. Цей процес розширення
можна вважати адіабатичним (хоча маса
повітря змінюється, ми вважаємо цей
процес адіабатичним без зміни маси
газу, через міркування, які є аналогічними
тим, що приведені раніше).
В кінці
цього процесу стан газу, назвемо його
четвертим (4), визначається параметрами
 ,
при цьому
,
при цьому ,
,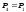 ,
, .
.
Потім через
теплообмін між повітрям у балоні та
оточуючим середовищем відбудеться
поступове нагрівання повітря в балоні
до кімнатної температури
 .
Повітря в балоні перейде у п’ятий (5)
стан. У цьому стані повітря характеризується
параметрами:
.
Повітря в балоні перейде у п’ятий (5)
стан. У цьому стані повітря характеризується
параметрами: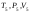
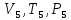 .
При цьому тиск його стане вищим за
атмосферний тиск
.
При цьому тиск його стане вищим за
атмосферний тиск
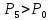 ,
де
,
де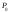

це атмосферний тиск.
це атмосферний тиск.