
immunologia_zachet_1
.pdf2.Купферовские клетки – в печени. Их назначение в основном заключается в уничтожении старых клеток крови.
3.Гистиоциты - распространенная разновидность макрофагов, которые встречаются во всех органах. Дело в том, что это – клетки соединительной ткани: волокон, образующих строму (каркас) большинства структур тела. Иногда гистиоциты превращаются в «настоящие» макрофаги.
4.Селезеночные макрофаги – располагаются в синусоидных сосудах этого органа. Как и у клеток Купфера, их задача заключается в том, чтобы вылавливать из крови и уничтожать отжившие клетки крови. Недаром селезенка называется кладбищем погибших эритроцитов!
5.Дендритные клетки – макрофаги, находящиеся под слизистыми оболочками и в коже, то есть фактически на границе с внешней средой.
6.Перитонеальные макрофаги – фагоциты, «живущие» в брюшине.
7.Где находятся макрофаги лимфатических узлов, понятно по названию. Это благодаря им лимфоузлы известны в качестве фильтров, очищающих лимфу.
МАРКЕРЫ:
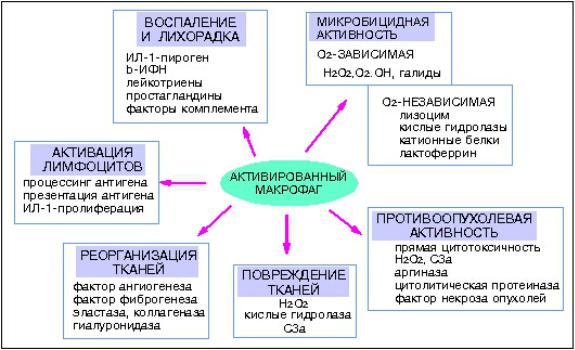
макрофаги имеют рецепторы к антигенам (Fc), С3bрецепторы, антигены гистосовместимости,рецепоры-мусорщики, маннозные рецепторы, TOLLподобные,(которые связывают PAMPмикроорганизмов и поврежденных клеток и,активируя механизмы врожденного иммунитета), рецепторы для цитокинов(ИЛ-2,ФНО,ИФН-гамма, М-КСФ).
Функции:
Макрофаги участвуют как в естественном, так и в специфическом ИО. На ранней стадии ИО макрофаги выполняют функцию презентации антигена - в результате фагоцитоза антиген расщепляется, а его эпитоп выносится на мембрану в комплексе с белком МНСII. На конечной стадии ИО макрофаг активируется лимфокинами.
3. Процессинг и презентация антигенов Т-хелперам.
Впредставлении АГ Т-клеткам выделяют следующие этапы:
•Ферментативную переработку экзогенных и эндогенных АГ до коротких АГ-ых пептидов;
•Синтез молекул HLA в эндоплазматическом ретикулуме клетки;
•Образование комплекса «АГ-ый пептид – молекула HLA» (встраивание АГ-ого пептида в бороздку синтезированной HLAмолекулы);
•Транспорт образовавшегося комплекса на клеточную мембрану;
•Презентация АГ-ого пептида Т-лимфоцитам.
Процессинг АГмногоэтапный процесс сборки комплекса «пептид-HLA», происходящий в осбых цитоплазматических зонах клетки.
Процессы переработки и презентации АГ-ых пептидов в комплексе с молекулами HLA различаются в зависимости от происхождения и природы АГ-ов: эндогенных (вирусы, внутриклеточные бактерии, опухоли, аутоантигены и др.) и экзогенных (микроорганизмы, токсины, аллергены, разнообразные белки и др.).
Экзогенные АГ презентируются в комплексе с молекулами HLA класса 2, синтезируемыми в эндоплазматическом ретикулуме. Везикулы, содержащие такие молекулы HLA (без антигенного пептида), сливаются с ранними эндосомами или первичными лизосомами, которые содержат экзогенные белки. Эти белки вытесняют CLIP из молекулы HLA класса 2. В кислой среде при действии протеаз участки белков, не встроенные в бороздку молекулы HLA, отщепляются. Затем в составе везикул комплексы «HLA-2-антигенный пептид» транспортируются на клеточную мембрану и презентируются CD4+ Т-лимфоцитам. Молекула CD4, состоящая из 4 иммуноглобулиновых доменов, взаимодействует с бета-2-доменом молекулы HLA-2 класса.
В процессе презентации АГ Т-лимфоцитам задействованы межклеточные вонтактные
взаимодействия, участвующие в образовании молекулярного иммунологического синапса, в пределах которого происходит обмен сигналами для оптимизации начального этапа иммунной реакции.
4.Процессинг и презентация антигенов Т-киллерам.
Впредставлении АГ Т-клеткам выделяют следующие этапы:
•Ферментативную переработку экзогенных и эндогенных АГ до коротких АГ-ых пептидов;
•Синтез молекул HLA в эндоплазматическом ретикулуме клетки;
•Образование комплекса «АГ-ый пептид – молекула HLA» (встраивание АГ-ого пептида в бороздку синтезированной HLAмолекулы);
•Транспорт образовавшегося комплекса на клеточную мембрану;
•Презентация АГ-ого пептида Т-лимфоцитам.
Процессинг АГмногоэтапный процесс сборки комплекса «пептид-HLA», происходящий в осбых цитоплазматических зонах клетки.
Процессы переработки и презентации АГ-ых пептидов в комплексе с молекулами HLA различаются в зависимости от происхождения и природы АГ-ов: эндогенных (вирусы, внутриклеточные бактерии, опухоли, аутоантигены и др.) и экзогенных (микроорганизмы, токсины, аллергены, разнообразные белки и др.).
Эндогенные АГ после ферментативной деградации в протеасоме транспортируются в эндоплазматический ретикулум с участием переносчиков ТАР-1 и ТАР-2, где образуются к омплекс с молекулой HLA класса 1, синтезируемой в ретикулуме. Затем комплекс c помощью транспортной системы аппарата Гольджи транспортируется на клеточную поверхность АПК и презентируется CD8+ T-лимфоцитам. Молекула CD8 состоит из гетерогенных альфа- и бета-цепей
ивзаимодействует с альфа-3-доменом молекулы HLA-1 класса.
Впроцессе презентации АГ Т-лимфоцитам задействованы межклеточные вонтактные взаимодействия, участвующие в образовании молекулярного иммунологического синапса, в пределах которого происходит обмен сигналами для оптимизации начального этапа иммунной реакции.
5. Взаимодействие АПК с Т-лимфоцитом. Механизм распознавания антигена.
Презентация (представление антигена Т-лимфоцитам) осуществляется в результате поглощения антигена антигенпрезентирующей клеткой (АПК), расщепления его внутри клетки ферментами, связывания образующихся антигенных пептидов с молекулами МНС ("загрузка" антигенных пептидов в желобки собственных молекул МНС I, II класса) и выхода их на поверхность клетки для представления (presentation)Т-лимфоцитам

Антигенраспознающие рецепторы В- и Т-лимфоцитов
Антигенраспознающий В-клеточный рецептор В-линфоцитов
(BcR - англ. В-се11 Receptor) построен из молекулы мембранного иммуноглобулина (mlg, состоящий из двух одинаковых тяжелых Н- и двух одинаковых легких - L-цепеи) и двух молекул CD79 (Igα, Igβ) - BcR имеет трансмембранные и внутрицитоплазматические сегменты, передающие внутриклеточные сигналы.
Антигенраспознающий Т-клеточный рецептор Т-лиифоцитов
(TcR - англ. Т-се11 Receptor) имеет две формы - αβ и γδ,
которые соединены в мембране клетки с комплексом CD3. Димеры αβ и γδ также как молекулы иммуноглобулина, имеют V- и С-домены. TcR совместно с корецепторами CD8 или CD4 распознает комплекс пептид-антиген + МНС первого (I) или второго (II) класса.
Антигенпрезентирующая, или антигенпредставляющая, клетка (АПК) захватывает антиген путем эндоцитоза и расщепляет его до пептидных фрагментов, которые связываются внутри клетки с молекулами МНС I или II класса и выставляются на поверхность клетки. Профессиональными АПК для лимфоцитов являются дендритные клетки (DC), В-лимфоциты, макрофаги. Роль АПК могут также выполнять эндотелиальные клетки, фибробласты, кератиноциты и некоторые другие клетки, способные при активации экспрессировать МНС и цитокины.
1.Цитокины. Определение и классификация, основные св-ва цитокинов.
Цитокины-универсальные регуляторы жизненного цикла клеток,контролирующие процессы их дифференцировки,пролиферации,функциональной активностии апоптоза.
Являясь регуляторными молекулами,цитокины играют важную роль в осуществелении реакций врожденного и адаптивного иммунитета,обеспечивают их взаимосвязь,а также контролируют гемопоэз,воспаление,заживление ран ,образование новых кровеносных сосудов.
Классификация:
•Интерлейкины (ИЛ-1-ИЛ-34). Среди интерлейкинов на основе функциональной активности выделяют провосполительные цитокины, ростовые факторы лимфоцитов, регуляторные цитокины.
•Интерфероны — противовирусные агенты с выраженным иммунорегуляторным действием [ин
терфероны типа I — а, бета, 8, к, ш, г, интерфероны типа II — у и группа интерфероноподобных цитокинов, ИЛ-28А (ИФН-А2), ИЛ-28В (ИФН-ЛЗ) и ИЛ-29 (ИФН)].
• Факторы некроза опухоли — цитокины с цитотоксическим и регуляторным действием: ФНО-а и лимфотоксины (ЛТ).
• Факторы роста гемопоэтических клеток — фактор роста стволовых клеток (c-Kit-лиганд, ИЛ-3, ИЛ-7, ИЛ-11, эритропоэтин, тромбопоэтин, ГМ-КСФ, Г-КСФ, М-КСФ).
• Хемокины [СС, СХС (ИЛ-8), СХ3С, С] — регуляторы хемотаксиса различных типов клеток.
Свойства цитокинов |
|
|
|
|
|
-Все |
цитокины |
обладают |
следующими |
общими |
свойствами: |
синтезируются в процессе реализации механизмов естественного или специфического иммунитета;
- проявляют свою активность при очень низких концентрациях (порядка 10^2 моль/л);
— служат медиаторами иммунных и воспалительных реакций и обладают ауто-, пара- и эндокрин ной активностью;
— действуют как факторы роста и факторы дифференцировки клеток (при этом вызывают преимущественно медленные клеточные реакции, требующие синтеза новых белков);
— образуют регуляторную сеть, в которой отдельные элементы обладают синергическим или
антагонистическим |
действием; |
— обладают плейотропной (полифункциональной) активностью |
|
2.понятие о системе цитокинов. Основные клетки продуценты.
Цитокины - это белковопептидные молекулы, продуцируемые различными клетками организма и осуществляющие межклеточные и межсистемные взаимодействия. Цитокины - универсальные регуляторы жизненного цикла клеток, контролирующие процессы их дифференцировки, пролиферации, функциональной активации и апоптоза.
Система цитокинов включает клетки-продуценты; растворимые цитокины и их антагонисты; клетки-мишени и их рецепторы.
Клетки-продуценты:
I. Основную группу клеток-продуцентов цитокинов в адаптивном иммунном ответе составляют T -хелперы.
ThO вырабатывают широкий спектр цитокинов в очень низких концентрациях.
Th1 продуцируют ИЛ-2, ИФНγ, ИЛ-3, ФНОα, необходимые для развития реакций клеточного иммунитета (ГЗТ, противовирусной, противоопухолевой цитотоксичности и др.)
Набор цитокинов, секретируемых Th2 (ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13, ИЛ-3), определяет развитие гуморального иммунного ответа.
В последние годы описана субпопуляция Th3, вырабатывающих ТФРβ, который супрессирует функцию как Тh1, так и Th2.
Т-цитотоксические (CD8+), В-лимфоциты, естественные киллеры являются слабыми продуцентами цитокинов.
II. В системе врожденного иммунитета основными продуцентами цитокинов являются клетки миелоидного ряда. С помощью Toll-подобных рецепторов (TLRs) они распознают сходные молекулярные структуры различных патогенов, так называемые патогенассоциированные молекулярные патерны (РАМП), например липополисахарид (ЛПС) грамотрицательных бактерий, липотейхоевые кислоты, пептидогликаны грамположительных микроорганизмов, флагеллин, ДНК, богатую неметилированными СрG повторами, и др. В результате такого взаимодействия с TLR запускается внутриклеточный каскад передачи сигнала, приводящий к экспрессии генов двух основных групп цитокинов: провоспалительных и ИФН типа 1. Главным образом эти цитокины (ИЛ-1, -6, -8, -12, ФНОа, ГМ-КСФ, ИФН, хемокины и др.) индуцируют развитие воспаления и участвуют в защите организма от бактериальных и вирусных инфекций.
III. Клетки, не относящиеся к иммунной системе: клетки соединительной ткани, эпителия, эндотелия спонтанно, без антигенной стимуляции, секретируют цитокины, поддерживающие пролиферацию гемопоэтических клеток, и аутокринные факторы роста (ФРФ, ЭФР, ТФРβ и др.).
Клетки-мишени
Действие цитокинов на клетки-мишени опосредуется через специфические рецепторы, связывающие цитокины с очень высокой аффинностью, причем отдельные цитокины могут использовать общие субъединицы рецепторов. Каждый цитокин связывается со своим специфическим рецептором.
Рецепторы цитокинов представляют собой трансмембранные белки и делятся на 5 основных типов. Наиболее распространен так называемый гемопоэтиновый тип рецепторов, имеющих два экстраклеточных домена, один из которых содержит общую последовательность аминокислотных остатков двух повторов триптофана и серина, разделенных любой аминокислотой (WSXWS-мотив). Второй тип рецепторов может иметь два внеклеточных домена с большим количеством консервативных цистеинов. Это рецепторы семейства ИЛ-10 и ИФН. Tретий тип представлен рецепторами цитокинов, относящихся к группе ФНО. Четвертый тип рецепторов цитокинов принадлежит к суперсемейству иммуноглобулиновых рецепторов, имеющих внеклеточные домены, напоминающие по строению домены молекул иммуноглобулинов. Пятый тип рецепторов, связывающих молекулы семейства хемокинов, представлен трансмембранными белками, пересекающими клеточную мембрану в 7 местах. Рецепторы цитокинов могут существовать в растворимой форме, сохраняя способность связывать лиганды.
3. Роль цитокинов в иммунном ответе.
Цитокиныуниверсальные регуляторы жизненного цикла, контролирующие процессы их дефференцировки, пролиферации , функциональной активности и аппоптоза. Цитокины являются регуляторными молекулами, играющие роль в осуществлении реакций врожденного и адаптационного иммунитета, обеспечивают их взаимосвязь, регулируют гемопоэз , восполение, заживление ран.
4. Цитокины, вырабатываемые активированными Т –хелперами 1 типа. Роль в иммунном ответе.
Дефференцированные Т-хелперы 1 типа вырабатывают : Ил-2, Ил-3, ИФНгамма, ФНО-альфа, бета, ГМ-КСФ. Эти цитокины усиливают клеточно-опосредованный иммунный ответс преимущественно цитотоксической активностью( от внутриклеточных патогенов и опухолей) , принимают участие в развитии аутоиммунных процессов клеточного типа.
5.Цитокины, вырабатывающиеся активированными Т –хелперами 2 типа. Роль в иммунном ответе.
Деференцированные т –хелперы 2 типа вырабатывают типичные для них цитокины: (ИЛ-4, ИЛ-5,-6,-9 ,-10,-13,-21,-23,-3 ,ГМ-КСФ). Они усиливают гуморальный ответ и учавствуют в аллергических реакциях , противогельминтозном ответе, гуморальных аутоиммунных процессах.
6. Цитокины, выделяемые клетками магрофогально –моноцитарного ряда
.Роль в развитии воспалительной реакции.
Активированные макрофагивырабатывают: ИЛ-1,-6,-8 ,-12, ФНО – альфа.
Под влиянием Ил-1 возростает концентрация продуктов метаболизма фосфолипидов в клетках воспалительного экссудата. ,вазодилатация, активизируются процессы дегрануляции тучных клеток.ФНОальфа учавствует в привлечении лейкоцитов в очаг восполения, уч. В активации клеток воспаления.
7. Интерфероны (ИФН) – важнейший компонент врождённой неспецифической защиты организма от инфекций. Это семейство белков местной (аутокринной и паракринной) регуляции, которые способны активировать внутриклеточные процессы и межклеточные взаимодействия, обеспечивающие устойчивость к вирусным инфекциям, усиливающие врождённый и приобретённый иммунные ответы, модулирующие процессы развития и гибели нормальных и опухолевых клеток. Резистентность организма к вирусным инфекциям и ряду других заболеваний во многом зависит от активности группы генов системы интерферонов.
Препараты интерферона широко используют в медицине. Эффекты интерферонов непрямые –
активация интерферонами специфических рецепторов вызывает каскад клеточных процессов, приводящих к индукции специфических стимулируемых интерферонами генов, кодирующих синтез множества белков, которые и обеспечивают противовирусные эффекты, противоопухолевое и антипролиферативное действие интерферонов. Индуцируемые интерферонами белки включают: ферменты, транскрипционные факторы, клеточные поверхностные гликопротеиды, цитокины, хемокины и другие факторы, действие которых продолжают исследовать. Продукция интерферонов клетками является преходящей, временной - «молчащие» в норме гены интерферонов индуцируются под действием продуктов вирусного и микробного происхождения и химических индукторов.
Интерфероны делят на три типа (α, β и γ), которые ассоциируют с определёнными функциями и определёнными клетками-продуцентами. Интерфероны α и β , несмотря на значительные структурные различия, имеют общие рецепторы и сходные функции. Вместе их называют также интерфероны I типа, или кислотно-стабильные интерфероны, в отличие от интерферона-γ, кот орый имеет свои рецепторы и частично отличающиеся функции (он известен также как интерферон II, или кислотно-лабильный интерферон).
Интерферон α (выявлено более 20 его субтипов) — основной интерферон, который синтезируется в культуре лейкоцитов, индуцированной вирусом. Главными продуцентами ИФН-α являются плазмацитоидные дендритные клетки, существенный вклад в ИФН-α-продуцирующую способность крови вносят моноциты. Основные его функции – противовирусная активность и активация естественных киллеров.
Интерферон β — основной интерферон, продуцирующийся культурой фибробластов, индуцированной двухспиральной РНК. Его основные продуценты – фибробласты, эпителиальные клетки и макрофаги, основная функция – противовирусная активность.
Интерферон γ — основной интерферон, продуцирующийся иммунологически стимулированной (митогенами или антигенами) культурой лимфоцитов. Основные клетки-продуценты ИФН -γ — Т- лимфоциты. Основная функция гамма-интерферона – иммунорегуляция (включая активацию макрофагов, усиление Th1-ответа, индукцию экспрессии антигенов главного комплекса гистосовместимости типа II на антигенпрезентирующих клетках и др.); также как и другие интерфероны, он проявляет противовирусную и антипролиферативную активность. Все клетки животных способны продуцировать интерфероны, определенные клетки (лейкоциты и фибробласты) могут продуцировать более одного типа — как ИФН-α так и ИФН-β.
8. Количественное определение цитокинов в биологических жидкостях и в культурах мононуклеарных клеток периферической крови методом ИФА можно охарактеризовать следующим образом.
Поскольку цитокины являются локальными медиаторами, более целесообразно измерять их уровни в соответствующих тканях после экстракции тканевых протеинов или в естественных жидкостях, например в слезе, смывах из полостей, моче, амниотической жидкости, спинномозговой жидкости и т.д. Уровни цитокинов в сыворотке или других биологических жидкостях отражают текущее состояние иммунной системы, т.е. синтез цитокинов клетками организма in vivo.
Определение уровней продукции цитокинов мононуклеарами периферической крови (МНК)
показывает функциональное состояние клеток. Спонтанная продукция цитокинов МНК в культуре свидетельствует, что клетки уже активированы in vivo.Индуцированный (различными стимуляторами, митогенами) синтез цитокинов отражает потенциальную, резервную способность клеток отвечать на антигенный стимул (в частности, на действие лекарственных препаратов). Сниженная индуцированная продукция цитокинов может служить одним из признаков иммунодефицитного состояния. Цитокины не специфичны в отношении конкретного антигена. Поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня тех или иных цитокинов невозможна. В то же время оценка уровней цитокинов позволяет получить данные о тяжести воспалительного процесса, его переходе на системный уровень и прогнозе, функциональной активности клеток иммунной системы, о соотношении Th1- и Th2-клеток, что очень важно при дифференциальной диагностике ряда инфекционных и иммунопатологических процессов.
В биологических средах можно определить цитокины количественно с помощью целого ряда методов иммуноанализа,используя поликлональные и моноклональные антитела (см. гл. 4). ИФА позволяет узнать, каковы точные концентрации цитокинов в биологических жидкостях организма. Иммуноферментное выявление цитокинов имеет ряд преимуществ перед другими методами (высокая чувствительность, специфичность, независимость от присутствия антагонистов, возможность точного автоматизированного учета, стандартизации учета). Однако и этот метод имеет свои ограничения: ИФА не характеризует биологическую активность цитокинов, может давать ложные результаты за счет перекрестно-реагирующих эпитопов. Биологическое тестирование проводят на основе знания основных свойств цитокинов, их действия на клетк и-мишени. Изучение биологических эффектов цитокинов позволило разработать четыре разновидности тестирования цитокинов:
1)по индукции пролиферации клеток-мишеней;
2)по цитотоксическому эффекту;
3)по индукции дифференцировки костно-мозговых предшественников;
4)по противовирусному действию.
1.Основные виды клеточной цитотоксичности.
Клетки, обладающие цитотоксичностью – ЦТЛ,NK, клетки миелоидного ряда ( макрофаги,
нейтрофилы)
А) Т-клеточная цитотоксичность
Б) NK – клеточная цитотоксичность (распознавание и уничтожение в организме клеток,
поврежденных вирусом, опухолевых клеток, лишенных MHC хозяина)
В) Антителозависимая клеточно – опосредованная цитотоксичность (направлена на безъядерные
клетки (эр, тр); уничтожение NK - клетками КМ, покрытых IgG антителами, с вовлечением
рецептора для IgG)
Г) Комплементзависимая цитотоксичность
2.Т - лимфоциты, характеристика, функции.
Цитотоксические CD8+ Т-лимфоциты (ЦТЛ) — клетки-киллеры, способные поражать инфицированные вирусом клетки-мишени, опухолевые клетки, клетки трансплантата. ЦТЛ распознают антигенные пептиды в комплексе с молекулами HLA класса.
Функции:
1) Распознавание клеточных элементов, несущих признаки генетической чужеродности (в
комплексе с молекулой MHC 1 класса):
Цитотоксическая активность клеток-киллеров реализуется при непосредственном синаптическом
контакте лимфоцита с КМ. При этом в КМ индуцируется апоптоз..
А) В зрелом дифференцированном цитотоксическом лимфоците формируются гранулы ,
содержащие перфорины и гранзимы. После образования синапса между КЭ и КМ гранулы концентрируются в области контакта и затем высвобождаются в направлении КМ. Перфорин при
контакте с мембраной КМ полимеризуется и встраивается в мембрану, формируя в ней пору. В эту
пору проникают гранзимы – ферменты, индуцирующие апаптоз КМ.
Б) Индукция апоптоза в КМ может происходить через CD95 молекулы (Fas), содержащие домен смерти. Лигандом CD95 служит молекула FasL, экспрессируемая на ЦТЛ.
2)Уничтожение клеточных элементов, несущих признаки генетической чужеродности.
3)Разрушение и элиминация стареющих и поврежденных клеток.
3. Характеристика естественных киллеров, основные маркеры, рецепторы, функции.
Естественные киллеры (NK) – эффекторные клетки врожденной иммунной системы,
