
immunologia_zachet_1
.pdf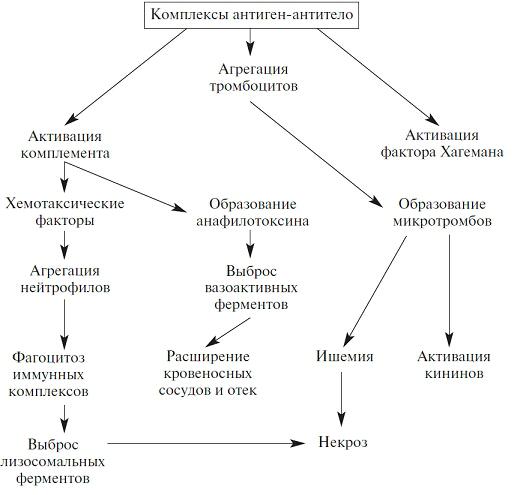
Фагоцитоз комплексов антиген-антитело лейкоцитами приводит к выбросу или образованию различных дополнительных провоспалительных веществ, включая простагландины, сосудорасширяющие белки и хемотаксические вещества. Повреждение тканей опосредуется также свободными радикалами кислорода, продуцируемыми активированными нейтрофилами. Иммунные комплексы вызывают агрегацию тромбоцитов и активацию фактора Хагемана, что приводит к усилению воспалительного процесса и образованию микротромбов. В результате развиваются васкулит, гломерулонефрит, артрит и т.п.
В морфологической картине иммунокомплексного повреждения доминирует острый некротизирующий васкулит. Например, поражение клубочков почки сопровождается гиперклеточностью из-за набухания и пролиферации эндотелиальных и мезангиальных клеток, а также инфильтрацией нейтрофилами и моноцитами.
Хроническая сывороточная болезнь развивается при повторном или продолжительном контакте (экспозиции) с антигеном. Постоянная антигенемия необходима для развития хронической иммуно-комплексной болезни, так как иммунные комплексы чаще всего оседают в сосудистом русле. Например, системная красная волчанка связана с долгим сохранением (персистенцией)
аутоантигенов. Часто, однако, несмотря на наличие характерных морфологических изменений и других признаков, свидетельствующих о развитии иммунокомплексной болезни, антиген остается неизвестным, например, при ревматоидном артрите, узелковом периартериите, мембранозной нефропатии и некоторых васкулитах.
Местная иммунокомплексная болезнь (реакция Артюса) выражается в местном некрозе ткани, возникающем вследствие острого иммунокомплексного васкулита. Реакция Артюса развивается в течение нескольких часов и достигает пика через 4—10 ч после инъекции, когда появляется зона видимого отека с кровоизлияниями. При светооптическом исследовании описывают фибриноидный некроз сосудов. Разрыв сосудов приводит к развитию местных кровоизлияний, но чаще наблюдается тромбоз, способствующий развитию местных ишемических повреждений.
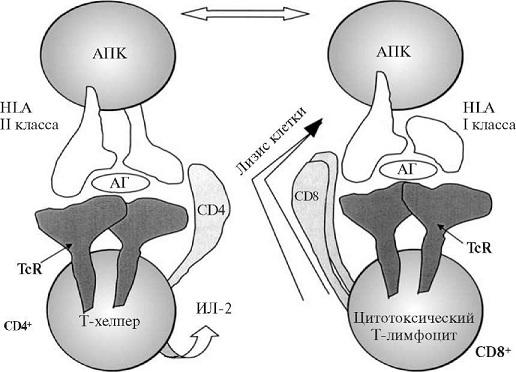
IV тип гиперчувствительности (клеточно-опосредованный, ГЗТ). IV тип гиперчувствительности вызывают специфически сенсибилизированные Т-лимфоциты (схема 8.5). Он включает в себя классические замедленные реакции гиперчувствительности, вызываемые CD4+ Т-имфоцитами, и прямую клеточную цитотоксичность, опосредованную CD8+ Т-лимфоцитами. Это основной тип иммунного ответа на различные внутриклеточные микробиологические агенты, особенно микобактерии туберкулеза, а также на многие вирусы, грибы, простейшие и паразиты. Описаны два варианта реакций гиперчувствительности IV типа.
Схема 8.
Клеточно-опосредованная реакция гиперчувствительности IV типа
В-лимфоцит или моноцит/макрофаг
Гиперчувствительность замедленного типа (ГЗТ). Примером служит реакция на внугрикожно введенный туберкулин — компонент из стенок микобактерии туберкулеза. У сенсибилизированного пациента через 8—12 ч возникает покраснение и уплотнение в месте введения, а пик реакции наступает через 24—72 ч. У сильно сенсибилизированных больных в зоне инъекции развивается некроз. ГЗТ характеризуется накоплением мононуклеарных клеток в подкожной ткани и дерме, преимущественно вокруг мелких вен и венул с образованием характерных периваскулярных манжеток. Выход белков плазмы за пределы сосудистого русла увеличивает отек дермы и сопровождается оседанием фибрина в интерстиции. В участках повреждения преобладают CD4+ Т-лимфоциты.
При персистенции антигена макрофаги трансформируются в эпителиоидные клетки, окруженные валом из лимфоцитов — формируется гранулема. Такой тип воспаления характерен для IV типа гиперчувствительности и называется гранулематозным воспалением.
ИФН-у является одним из наиболее важных медиаторов ГЗТ и сильным активатором макрофагов. Активированные макрофаги, обладающие способностью к фагоцитозу, уничтожают микроорганизмы. В то же время макрофаги продуцируют некоторые полипептидные факторы роста — тромбоцитарный фактор роста (ТцФР) и трансформирующий фактор роста (ТФРb), стимулирующие пролиферацию фибробластов и усиливающие синтез ими коллагена. Таким образом, активированные макрофаги обеспечивают элиминацию антигена, а если активация продолжается, то способствуют развитию фиброза.
Цитокины ФНОa и ФНОb воздействуют на эндотелиальные клетки, вызывая повышение секреции простациклина, что приводит к увеличению кровотока в результате расширения сосудов, и усилению экспрессии адгезивной молекулы Е-селектина (ELAM-1), способствующей прикреплению пришлых лимфоцитов и моноцитов. Одновременно происходит усиление секреции низкомолекулярных хемотаксических факторов, например ИЛ-8. Все эти изменения в эндотелии способствуют выходу лимфоцитов и моноцитов за пределы сосудистого русла в зону развития ГЗТ.
При цитотоксичности, опосредованной Т-лимфоцитам и, сенсибилизированные CD8+ Т-лимфоциты уничтожают клетки-мишени, которые являются носителями антигена (цитотоксические лимфоциты — CTL). Т-лимфоциты, направленные против антигенов гистосовместимости, фиксированных на поверхности клеток, играют важную роль в отторжении трансплантата. Они также участвуют в защите от вирусных инфекций. В клетках, пораженных вирусом, вирусные пептиды связываются с молекулами ГКГС класса I и в вице комплексов транспортируются к поверхности клетки. Этот комплекс распознается цитотоксическими CD8+ Т-лимфоцитами. Лизис зараженных клеток завершается до репликации вируса, что приводит к уничтожению вирусов. Полагают, что многие опухолевые антигены представлены на поверхности клеток, a CTL участвуют в противоопухолевом иммунитете.
Отторжение трансплантата. Реакция отторжения трансплантата связана с распознаванием хозяином пересаженной ткани как чужеродной (схема 8.6). Антигенами, ответственными за такое отторжение у человека, являются антигены HLA. Отторжение трансплантата — сложный процесс, во время которого имеют значение как клеточный иммунитет, так и циркулирующие антитела.
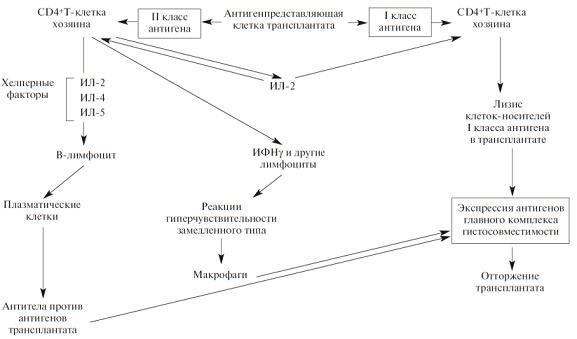
Схема 8.
Отторжение трансплантата
Инициация реакций, опосредованных Т-лимфоцитами , происходит при контакте лимфоцитов реципиента с антигенами HLA донора. Полагают, что наиболее важными иммуногенами являются дендритные клетки донорских органов. Т-клетки хозяина встречаются с дендритными клетками в пересаженном органе, а затем мигрируют в регионарные лимфатические узлы. Предшественники CD8+ CTL, обладающие рецепторами к I классу HLA-антигенов, дифференцируются в зрелые CTL. Зрелые CTL лизируют пересаженную ткань. Кроме специфических CTL, образуются CD4+ Т-лимфоциты, которые играют исключительно важную роль в отторжении трансплантата. Как и при ГЗТ, активированные CD4+ Т-лимфоциты выделяют цитокины, вызывающие повышение сосудистой проницаемости и местное скопление мононуклеарных клеток (лимфоцитов и макрофагов). Считают, что ГЗТ, проявляющаяся повреждением микрососудов, ишемией и деструкцией тканей, является наиболее важным механизмом деструкции трансплантата.
Реакции, обусловленные антителами, могут протекать в двух вариантах. Сверхострое отторжение развивается тогда, когда в крови реципиента есть антитела против донора. Такие антитела встречаются, например, у реципиентов, у которых уже было отторжение почечного трансплантата. Предшествующие переливания крови от HLA-неидентифицированных доноров также могут привести к сенсибилизации, так как тромбоциты и лейкоциты особенно богаты HLA-антигенами. В таких случаях отторжение развивается немедленно после трансплантации, так как циркулирующие антитела образуют иммунные комплексы, оседающие в эндотелии сосудов пересаженного органа. Затем происходит фиксация комплемента и развивается реакция Артюса.
У реципиентов, которые не были предварительно сенсибилизированы к антигенам трансплантата,
экспозиция донорских HLA-антигенов I и II класса может вызывать образование антител. Антитела, образованные реципиентами, вызывают повреждение ткани посредством нескольких механизмов: комплемент-зависимой цитотоксичности, антитело-зависимого, обусловленного клетками цитолиза, и в результате отложения комплексов антиген-антитело. Изначальной мишенью для этих антител служат сосуды трансплантата. Поэтому феномен антитело-зависимого отторжения в почке гистологически представлен васкулитом.
9. Первичные иммунодефициты
1)ПИД – гетерогенная группа наследственных расстройств, причиной которых являются мутации специфических генов с дефектом одной или нескольких компонентах иммунной системы.
2) Механизм Развития
Реализация генетического дефекта приводит к появлению широкого спектра заболеваний. В подавляющем большинстве случаев эти заболевания – результат повышенной чувствительности пациентов к инфекциям, предрасположенности к аутоиммунным и онкологическим заболеваниям, а также аллергии.
3)Распространенность
В настоящее время известно около 150 клинических форм генетически опосредованной иммунной недостаточности, и примерно в 130 из них открыты генные дефекты. Частота встречаемости: IgA(1:300-1:700),
ОВИН(1:7000-1:200.000), Х - сцепленная агаммаглобулинемия(1:500.000-1.000.000), ХГБ(1:50.000-1:250.000).
4)Классификация
Выделяют следующие группы:
1 группа – комбинированные Т- и В- клеточные иммунодефициты
2 группа – преимущественный дефицит антител
3 группа – синдромы иммунодефицитов с хорошо охарактеризованными клиническими признаками
4 группа – генетические нарушения иммунной регуляции
5 группа – врожденные дефекты фагоцитов (числа, функций и/или того и другого)
6 группа – дефекты врожденного иммунитета
7 группа – аутовоспалительные заболевания
8 группа – дефициты комплемента
5)Диагностика Признаки являющиеся диагностически значеыми
•Частый отит (6-8 раз в год и чаще)
•Синусит (4-6 раз в год)
•Пневмонии (2 раза в год и чаще)
•Абсцессы кожи и внутренних органов, особенно повторные
•Антибиотикатерапия для купирования инфекции с применением антибиотиков внутремышечно или per os в течении 2 мес. И более, а также с использованием внутривенных антибиотиков.
•Не менее двух перенесенных инфекций, таких как: менингит, остеомиелит, сепсис
•Отставание ребенка в росте и по массе в сравнении с возрастной нормой
•Персистирующая молочница или грибковые поражения кожи в возрасте старше 1 года
•Указание на наличие в семье больных ПИД, ранние смерти детей от тяжелых инфекций.
10.Клинико-лабораторные критерии
1)Комбинированные ПИД (Т- и В-клеточные)
Нарушение реакции клеточного иммунитета с 6-7 месяцев, проявляющиеся в виде лимфопений (менее 4000 кл/мкл), снижение ровня IgA, IgM, IgG в сыворотке крови, в отсутствие специфических антител даже после вакцинации , а также в снижении или отсутствии Т- и/или В-лимфоцитов в зависимости от формы иммунодефицита.
2) Х-сцепленной ТКИН
А)генетическое исследование ДНК на наличие мутаций в Xq13.1
Б)Определение экспрессии общей (гамма -такая хуевина как у) гамма-цепи на лимфоцитах с помощью моноклональных анти-гамма-антител
В)пренатальную диагностику путем исследования ворсин хориона или клеток амниотической жидкости на наличие данной мутации либо исследование крови плода, начиная с 17-ой недели развития, и выявлении лимфопении за счет снижения количества Т-клеток и их ответа на миоген
3) Тяжелая форма ИН с дефицитом аденозин дезоминазы
А)определение содержания АДА в эритроцитах, лимфоцитах, фибробластах
Б)обнаружение дАТФ и дезоксиаденозина в моче
В)генетическое обследование на наличие мутации гена , кодирующего АДА
Г)пренатальная диагностика ворсин хориона , амниотических клеток и клеток крови плода на наличие мутации гена, кодирующего АДА
3)Тяжелая комбинированная ИН с дефицитом пуриннуклеозидфосфорилазы
А)исследование активности фермента в лизате эритроцитов(спектрофотометрия, радиохимический анализ)
Б)определение содержания мочевой кислоты в сыворотке крови (снижено)
В)содержание ионозина и гуанозина в сыворотке крови
Г) содержание ионозина и гуанозина, дезоксиионозина и дезоксигуанозина
В моче
Д)исследование активности пуриннуклеозидфосфорилазы и наличие мутации его гена в ворсинках хориона и амниотических клетках.
11.Принципы диагностики и иммунотерапии больных с первичными иммунодефицитами.
Диагностика
Тесты оценки Т-кл. звена:
Скрининговы тесты:
-абсолютное число лимфоцитов, Т-лимфоцитов (СД3), субпопуляций Т-лимф. (СД4,СД8) -УЗИ или рентгенография тимуса у младенцев
-кожные тесты ГЗТ Подтверждающие тесты:
-лимфопролиферативный ответ на антигены,митогены,аллогенные кл.
-образование цитокинов (Th-1 типа: ИФН-гамма, ФНО-альфа, ИЛ-2 и Th-2 типа: ИЛ-4,5,6,10,13) -функциональный ответ Т-кл на цитокины
-молекулярный анализ специфических дефектов развития Т-кл. -выявление молекул адгезии Тесты оценки В-кл. звена:
Скрининговые тесты:
- определение содержания В-лимф (СД-19,СД20) в периферической крови
-определение концентрации сывороточных Ig-A, Ig-M, Ig-E, Ig-G - определение субклассов Ig-G (Ig-G1, Ig-G2, Ig-G3, Ig-G4)
-выявление специфических антител (например, Ig-G1- антитела к анатоксинам столбняка и дифтерии; Ig-G1 и Ig-G3 к антигенам респираторных вирусных вакцин и т.д)
Подтверждающие тесты:
-тест на образование В-кл. Ig in vitro -регуляция синтеза Ig
-молекулярный анализ генетических нарушений Тесты оценки фагоцитарного звена:
Скрининговые тесты:
-определение абсолютного числа нейтрофилов и моноцитов
-показатели фагоцитоза Подтвреждающие тесты: -оценка хемотаксиса фагоцитов
-определение экспрессии молекул адгезии на пов-тной мембране НФ
-определение завершенности фагоцитоза
Терапия
При иммунной недостаточности показаны все виды иммунотерапии, хотя наиболее глубокие формы первичных иммунодефицитов могут быть излечены только с помощью методов иммунореконструкции, способных обеспечить прививку больным полноценных донорских лимфоидных клеток. Заместительная иммунотерапия создает больному пассивный протективный иммунитет, однако она должна быть регулярной и, как правило, пожизненной.
Для заместительной терапии в настоящее время используют следующие препараты:
-Ig для внутреннего введения
-ростковые факторы
-препараты интерферона гамма
-препараты на основе ИЛ-2
12.Тяжелые комбинированные иммунодефициты (ТКИД), основные варианты.
Клиника,диагностика,принципы лечения.
1. ТКИД с дефецитом аденозиндезаминазы – образуется в рез-те дефекта гена важнейшего для клеток иммунной системы фермента - аденозиндезаминазы (АДА).
Данная группа фенотипически похожих генетических дефектов включает точечные мутации и делеции в пределах гена, кодирующего АДА. В отсутствие АДА токсичные метаболиты пуринового обмена (дАТФ) и метилирования накапливаются внутри клетки и тормозят пролиферацию. В результате нарушается функция Т- и В-лимфоцитов. Накопление дАТФ происходит также в эритроцитах. В плазме повышается концентрация аденозина и дезоксиаденозина.
Клиническая картина зависит от возраста, в котором произошла манифестация заболевания (ранняя и поздняя манифестация). Для ранней манифестации характерно появление к 2-3-месячному возрасту повторных респираторных инфекций, диареи, отставание в развитии, а также наличие множественных дефектов костей, затрагивающих костно-хрящевые соединения, апофизы подвздошных костей и тела позвонков.
Диагностика:
•определение содержания АДА в эритроцитах, лимфоцитах, фибробла стах;
•обнаружение дАТФ и дезоксиаденозина в моче;
•генетическое обследование на наличие мутации гена, кодирующего АДА;
•пренатальная диагностика ворсин хориона, амниотических клеток и клеток крови плода на наличие мутаций гена, кодирующего АДА.
При лечении данного заболевания применяют следующие подходы:
-трансплантацию костного мозга от НLА-совместимого донора
- ферментозамещающую терапию 3 раза в неделю в виде подкожных инъекций препарата АДА крупного рогатого скота, конъюrированного с полиэтиленгликолем.
2. ТКИД с дефицитом пуриннуклеозидфосфорилазы - аутосомно-рецессивное заболевание, которое развивается в результате дефекта гена, кодирующего фермент пуриннуклеозидфосфорилазу.
При отсутствии пуриннуклеозидфосфорилазы токсичные метаболиты, в данном случае дГТФ, накапливаются внутри клетки и нарушают пролиферацию лимфоцитов. Т-лимфоциты особенно чувствительны к накоплению дГТФ. Они поражаются в большей степени, чем В-лимфоциты.
Содержание сывороточных иммуноглобулинов чаще в пределах нормы или несколько повышено. У больных с недостаточностью пуриннуклеозидфосфорилазы, как и при дефиците АДА, выявляют выраженную лимфопению. Активность Т-лимфоцитов снижена, но поддерживается на минимальном уровне и с течением времени может меняться.
Клинические проявления заболевания могут развиваться и в первый год жизни, и в более позднем возрасте. Характерны рецидивирующие вирусно-бактериальные
инфекции, поражающие органы дыхания, ЛОР органы, мочевыделительную систему.
У 1/3 пациентов выявляют неврологическую симптоматику в виде спастических нарушений: атаксию, тремор, гиперили гипотонию, а также задержку умственного развития. В некоторых случаях обнаруживают аутоиммунные расстройства, в частности аутоиммунную гемолитическую анемию, идиопатическую тромбоцитопению. Возможно появление лимфомы.
Диаrностика:
-исследование активности фермента в лизате эритроцитов (спектрофо тометрия, радиохимический анализ);
-определение содержания мочевой кислоты в сыворотке крови (сни жено);
-определение содержания инозина и гуанозина в сыворотке крови;
-определение содержания инозина, гуанозина, дезоксиинозина и дезок сигуанозина в моче;
-пренатальная диагностика путем исследования активности пуринну клеозидфосфорилазы и наличия мутации его гена в ворсинках хориона и амниотических клетках.
3. ТКИД обусловленная дефицитом JАКЗ
JАКЗ-киназа - единственная сигнальная молекула, взаимодействующая с у-цепью, и поэтому считают, что дефект гена именно этой киназы служит причиной развития аутосомно-рецессивноr о варианта ТКИД, молекулярная основа которого до сих пор остается неизвестной. Больные восприимчивы к инфекционным заболеваниям и подвержены болезни трансплантат против хозяина , которую могут вызвать аллоrенные Т-лимфоциты. В иммунном статусе уровень В-лимфоцитов повышен, а содержание Т-лимфоцитов и NК-клеток резко снижено.
