
- •Глава 1. БИОЛОГИЧЕСКАЯ РОЛЬ СЛЮНЫ
- •1.1. Методы сбора слюны
- •Глава 2. ХИМИЧЕСКИЙ СОСТАВ СЛЮНЫ
- •2.1. Физико-химические свойства слюны
- •2.2. Органические компоненты слюны
- •2.3. Ферменты слюны
- •2.4. Биологически активные вещества слюнных желез и слюны
- •2.5. Минеральные компоненты слюны
- •Глава 3. СЛЮННЫЕ ЖЕЛЕЗЫ И ГЕМОСТАЗ (докт. мед. наук, проф. В.П. Мищенко)
- •Глава 4. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ИССЛЕДОВАНИЙ СЛЮНЫ
- •Глава 5. КОСТНАЯ ТКАНЬ
- •5.1.Строение костной ткани
- •5.2. Минерализация костной ткани
- •5.3. Формы нарушения метаболизма костной ткани
- •5.3.1. Кальция-фосфорный баланс в организме
- •5.4. Биохимические тесты для оценки метаболизма костной ткани
- •Глава 6. ЗУБЫ
- •6.1.Эмаль
- •6.2. Неорганический компонент эмали
- •6.3.Органический матрикс эмали
- •6.4. Особенности обмена веществ в эмали
- •6.5.Дентин
- •6.6. Цемент
- •6.7. Пульпа зуба
- •6.7.1. Архитектоника пульпы
- •Глава 7. БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ РАЗВИТИЯ ОСНОВНЫХ СТОМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ (кариес, пародонтит, сиалоаденит, сиалозы)
- •7.1. Кариес зубов
- •7.2. Принципы профилактики и лечения кариеса
- •7.3. Пародонтит
- •7.4. Основы метаболической коррекции пародонтита
- •7.5. Сиалоаденит, сиалозы
- •ОТВЕТЫ НА ТЕСТЫ
- •СПИСОК ЛИТЕРАТУРЫ
- •В.А. Сухомлинский
- •В.А. Сухомлинский
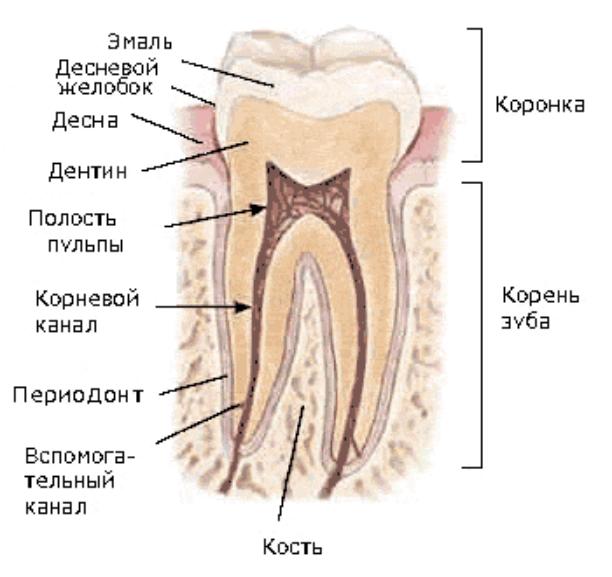
Глава 6. ЗУБЫ
Зубы – наиболее минерализированные органы, которые обеспечивают механическую обработку пищи. Они необходимы для связной речи и выполняют определенную эстетическую функцию.
Основу зуба составляют три вида минерализированных тканей: эмаль, дентин и цемент. Снаружи дентин покрыт в области коронки зуба эмалью, в области корней зуба – цементом. Пульпа зуба по составу и функции похожа на костный мозг.
6.1.Эмаль
Эмаль – наиболее твердая, резистентная к изнашиванию минерализированная ткань, которая снаружи покрывает коронку зуба. Эмаль располагается поверх дентина и тесно с ним связана структурно и функционально как в процессе развития зуба, так и после завершения его формирования. Толщина слоя эмали максимальна в области жевательных
30
бугров, где она достигает 2,3 – 2,5 мм, на латеральных поверхностях – 1
– 1,3 мм.
Основными структурными компонентами эмали являются эмалевые призмы диаметром 4 – 6 мкм. Длина призмы превышает толщину эмали, поскольку она имеет извилистый ход. Эмалевые призмы, концентрируясь в пучки, образуют S-подобные изгибы. Общее количество призм в эмали колеблется от 5 до 12 млн. в зависимости от размеров зуба.
Различают призменную, межпризменную и беспризменную эмаль. Межпризменная эмаль расположена между эмалевыми призмами (1 мкм) и является идентичной по строению с ними, но кристаллы гидроксиапатитов ориентированы под прямым углом к кристаллам, которые формируют призму. Степень минерализации межпризменной эмали ниже, чем призменной. Беспризменная эмаль – это внутренний слой эмали 5 – 15 мкм вдоль дентинно-эмелевой границы, который не имеет призм.
Эмаль содержит 95 – 98 % минеральных веществ, 1,2 % органических веществ и незначительное количество воды – 2,3 %. Кроме связанной воды (гидратная оболочка кристаллов) в составе эмали содержится свободная вода, которая находится в микропространствах.
6.2. Неорганический компонент эмали
Эмалевые призмы состоят из плотно уложенных кристаллов главным образом гидроксиапатита – Са10(РО4)6(ОН)2 и восьмикальциевого фосфата Са8Н2(РО4) . 5Н2О. Встречаются и другие виды апатитов, в которых количество атомов кальция колеблется от 6 до 14 (табл. 6.2.1.).
Кристаллы гидроксиапатита в зрелой эмали приблизительно в 10 раз больше кристаллов в дентине, цементе и костной ткани. Их толщина составляет 25 – 40 нм, ширина – 40 – 90 нм и длина – 100 – 1000 нм. Каждый кристалл покрыт гидратной оболочкой толщиной около 1 нм. Между кристаллами имеются микропространства, заполненные эмалевой жидкостью, которая служит переносчиком молекул некоторых веществ и ионов.
В составе минеральных веществ эмали кальций составляет 37 %, а фосфор – 17 %.
Свойства эмали зуба в большей степени зависят от соотношения Са/Р. Это соотношение непостоянно и может изменяться под действием многих факторов. Здоровая эмаль молодых людей имеет более низкий коэффициент Са/Р, чем эмаль взрослых. Этот показатель уменьшается при деминерализации зубов.
Таблица 6.2.1. Виды апатитов неорганического компонента эмали
Апатит |
Строение |
Гидроксиапатит |
Ca10 (PO4 ) 6(OH) 2 |
Каpбонатный апатит |
Ca10 (PO4 ) 6 СO 3 |
Хлоpный апатит |
Ca10 (PO4 ) 6Cl 2 |
Фтоpапатит |
Ca10 (PO4 ) 6F 2 |
31
Стpонциевый апатит |
SrCa9 (PO4 ) 6(OH) 2 |
Для апатитов, которые входят в состав кристаллов эмали зуба, молярные соотношения Са/Р составляют 1,67. Чем больше соотношение Са/Р в эмали, тем выше ее резистентность к кислотному разрушению, поскольку в кристаллической решетке гидроксиапатита Н+ - ионы могут замещать ионы Са+.
Фторапатит является наиболее кариесрезистентным апатитом эмали. Оптимальное для здоровья содержание фтора в питьевой воде составляет 5 – 1,2 мг/л. Фтор с пищей усваивается на 20 % меньше, чем из питьевой воды. Излишек или недостаток поступления фтора приводит к нарушениям минерального обмена костной ткани и зубов. Под влиянием низких концентраций фтора образование фторапатита из гидроксиапатита происходит согласно уравнению:
Ca10(PO4)6(OH)2 + 2F - ¾¾¾¾¾® Ca10(PO4 )6F2 + 2(OH)-
Влияние малых доз фтора на организм человека (Поворознюк В.В.,
2003):
1.Стимулирование остеобластов, усиление образования остеоида и новой костной ткани, особенно в кортикальном слое кости.
2. Стимулирование одонтобластов к отложению вторичного денти-
на.
3. Образование кристаллов фторапатита.
Действие на эмаль зуба высоких доз фтора способствует образованию фторида кальция согласно уравнению:
Ca10(PO4)6(OH)2 + 2F- ¾¾¾¾¾® 10 CaF2 + 6PO43- + 2(OH)-
Чрезмерное поступление в организм фтора приводит к развитию флюороза зубов. Повышенное содержание в питьевой воде фтора (больше 1,5 мг/л) способствует развитию эндемического флюороза.
Влияние высоких доз фтора на организм человека (Поворознюк В.В., 2003):
1.Образование иррегуляторного матрикса за счет ингибирования некоторых ферментов, беспорядочное расположение коллагеновых волокон матрикса.
2.Ослабление и нарушение минерализации при образовании иррегуляторного матрикса.
3.Стимулирование остеобластов, усиленное новообразование остеоида. Образованная новая кость несовершенна, плохо минерализована.
4.Увеличение темпов перестройки, активация остеокластов, костной резорбции.
6.3.Органический матрикс эмали
Органический матрикс эмали составляет в среднем 1,2 %. Он тесно связан с кристаллами минеральных солей и в ходе образования эмали обеспечивает процессы их роста и ориентации. По мере созревания ор-
32
ганический матрикс сохраняется в виде тончайшей трехмерной белковой сетки, нити которой размещаются между кристаллами.
Эмаль является секреторным продуктом эпителия и относится к тканям эктодермального происхождения. Она существенно отличается от других минерализованных тканей (костная, дентин, цемент), которые относятся к тканям мезенхимального происхождения. Органический матрикс уникален и отличается от других минерализованных тканей, основным компонентом органической части которых является коллаген.
Согласно современным представлениям, органический матрикс эмали представлен следующими белками: тафтелином, энамелином, амелогенином.
Тафтелин встречается на самых ранних этапах эмбриогенеза не только в эпителии, но и в тканях мезенхимы, поэтому некоторые авторы данный белок не относят к специфическим протеинам эмали. Иммунногистохимические исследования убедительно обосновывают важность тафтелина в морфогенетических процессах дифференциации проамелобластов. Установлено, что генетическое кодирование тафтелина осуществляется в длинном плече 1-й хромосомы.
Тафтелин состоит из 338 аминокислотных остатков с молекулярной массой 38,63 кДа; рІ = 5,85. Данный белок идентифицирован у ряда позвоночных животных, он сохраняется на протяжении 550 млн. лет эволюции. Тафтелин относится к классу b-кератинов. Вторичная структура полипептидов b-конформации обладает наиболее устойчивой формой и обеспечивает (подобно шелку и паутине) высокую прочность на разрыв. Тафтелин играет роль сигнального белка, обеспечивая в эмбриональном периоде морфогенез эмалевого органа. Тафтелин не играет существенной роли как нуклеатор кристаллов гидроксиапатита, но является важным белком дифференциации проамелобластов.
Второй белок органического матрикса эмали – энамелин выделяется на более поздних стадиях эмбриогенеза секреторными энамелобластами. Он располагается вдоль эмалево-дентинной границы и локализован в отростках Томса в стадию раннего купола. В формирующейся эмали энамелин составляет 10 %, а в зрелой – 90 % всех белков. Возрастание содержания энамелина в зрелой эмали осуществляется не за счет увеличения синтеза, а вследствие повышенной деградации амелогенина, который элиминируется амелогениназами.
Установлено наличие гена энамелина в 4-й хромосоме. Иммунногистохимические исследования разных позвоночных животных свидетельствуют об общих антигенных свойствах энамелина, то есть он сохраняется на протяжении 450 млн. лет эволюции. Энамелин определяется в виде узкой полоски вдоль эмалево-дентинной границы. Различают энамелин высокомолекулярный (189 кДа), среднемолекулярный (89 кДа) и низкомолекулярный (32 кДа). Высокомолекулярный энамелин локализируется в основном во внешнем слое эмали, что под действием энамелизина (металлопротеиназы) расщепляется до большого энамелина.
33
Последний в глубоких слоях эмали на ранней стадии эмбриогенеза разрушается специфическим ферментом – серинпротеиназой до низкомолекулярного энамелина. Детально изучена первичная структура энамелина с молекулярной массой 89 кДа на ранней стадии амелогенеза. Он состоит из 627 аминокислотных остатков и имеет общий с амелогенином пептид.
Таблиця 6.3.1. Аминокислотный состав энамелина эмали человека
(Deutsch D., et al.,1989)
Аминокислота |
Формирующийся |
Зрелый энамелин |
|
энамелин |
|
Асп |
83 |
85 |
Тре |
42 |
42 |
Сер |
121 |
167 |
Глу |
146 |
154 |
Про |
143 |
87 |
Гли |
140 |
156 |
Ала |
54 |
69 |
Вал |
33 |
35 |
Мет |
20 |
11 |
Иле |
25 |
23 |
Лей |
52 |
46 |
Тир |
28 |
26 |
Фен |
24 |
21 |
Гис |
34 |
28 |
Лиз |
27 |
76 |
Арг |
29 |
21 |
Энамелин содержит высокую концентрацию серина и глутамата, которые способны фосфорилироваться, и подобно другим неколлагеновым кислым белкам являются потенциальным нуклеатором минерализации. Это положение основано также на том, что энамелин является кислотным белком, локализованным на поверхности кристаллических решеток и синтезирующийся в ходе амелогенеза до появления другого белка эмали – амелогенина.
Энамелины формируют центр кристалла и определяют его позицию, ориентацию в ходе дальнейшего формирования супермолекулы гидроксиапатита. Рентгеноструктурным анализом установлено, что энамелин дает сильное отражение тени (около 0,47 нм), что соответствует боковым граням кристаллов гидроксиапатита (Быков Л.В., 1996).
Другим свидетельством роли энамелина в первичной минерализации являются данные иммунногистохимического исследования, которые показали, что кислотный белок – энамелин синтезируется секреторными энамелобластами на раннем этапе эмбриогенеза, когда еще нет амело-
34
генина. В зрелой эмали энамелин в основном локализуется в шеечной части зуба и вдоль эмалево-дентинной границы беспризменной эмали.
Установлено, что в ходе развития эмали изменяется соотношение между основными белками - энамелином и амелогенином. Так, на раннем этапе эмбриогенеза на стадии купола в эмали определяется один белок – энамелин. В эмали, что созревает, в эмалевом органе на стадии колокола содержится два белка - энамелин и амелогенин. Содержание его значительно преобладает над содержанием энамелина. Наконец, в зрелой эмали амелогенин почти полностью исчезает, за счет чего, возрастает удельный вес энамелина. Таким образом, вторичная минерализация осуществляется за счет изменения количественного содержания амелогенина.
Главная роль в минерализации эмалевых призм принадлежит амелогенинам, которые представляют 90 % белков эмали, синтезированных энамелобластами в стадию секреции. В процессе роста кристаллов гидроксиапатита они модифицируются, а потом почти полностью элиминируются. Термин «амелогенин» впервые предложен J.E. Eastoe в 1964 году, как продукт экстрацелюлярного матрикса эмали, который секретируют энамелобласты. В отличие от кератиноподобных белков – продукта секреции эктодермального эпителия и мезенхимальных клеток, что синтезируют коллаген, амелогенин имеет высокое содержание пролина, лейцина, глутамина и гистидина.
Выявлено 2 разных амелогениновых гена, один из которых локализуется в Х-, другой в У-хромосоме. Амелогенин человека состоит из 216 аминокислот, из них 19 представлены сигнальным пептидом. N-конец амелогенина состоит из 27 аминокислотных последовательностей, которые являются общими с энамелином и характерным для всех млекопитающих. С-конец амелогенина гидрофильный, другая часть амелогенина (158 аминокислот) содержит в основном гидрофобные аминокислоты. Вблизи N-конца молекулы идентифицированный обогащенный тирозином амелогениновый пептид, который содержит 45 аминокислот с молекулярной массой 5 кДа. В центральной части амелогениновой молекулы в интервале 82-87 аминокислотной последовательности выявлено наличие постоянного мотива Gln – Gln – Pro – Met – Met – Pro. Такой аминокислотный домен выявлен не только в большом, но и в малом амелогенине.
Таблиця 6.3.2. Аминокислотный состав амелогенина эмали человека
(Deutsch D., et al.,1989)
Аминокислота |
Формирующийся |
Зрелый амелогенин |
|
амелогенин |
|
Асп |
35 |
47 |
35
Тре |
35 |
35 |
Сер |
65 |
91 |
Глу |
133 |
132 |
Про |
251 |
204 |
Гли |
81 |
107 |
Ала |
17 |
28 |
Вал |
36 |
33 |
Мет |
39 |
34 |
Иле |
34 |
32 |
Лей |
82 |
77 |
Тир |
71 |
69 |
Фен |
25 |
27 |
Гис |
53 |
39 |
Лиз |
17 |
19 |
Арг |
23 |
24 |
Молекулярная масса амелогенина у человека и животных очень вариабельна. Зависимо от молекулярной массы и локализации амелогенина его можно разделить на 3 группы:
-большой амелогенин с молекулярной массой 28, 25, 22 и 20 кДа, который локализуется в эмалевых призмах;
-сверхбольшой амелогенин с молекулярной массой 46 и 72 кДа, который локализуется в цитоплазме некоторых энамелобластов;
-малый амелогенин с молекулярной массой 5, 10, 12 и 16 кДа, который локализуется в межпризменной эмали.
Большой амелогенин представлен 4 типами соответственно с молекулярной массой 28, 25, 22 и 20 кДа. Сверхбольшой амелогенин с молекулярной массой 46 и 72 кДа выявлен в цитоплазме некоторых энамелобластов, которые частично сохраняются среди зрелых эмелевых призм. Амелогенин с низкой молекулярной массой (5, 10, 12 и 16 кДа) локализуется в межпризменном пространстве и представляет собой белковые фрагменты, которые путем частичного протеолиза отщепляются от основной полипептидной цепи разными амелогениназами. Деградация амелогенина имеет место на ранних стадиях амелогенеза благодаря наличию в амелобластах 2-го типа специфических лизосомальных ферментов – амелогениназ, которые последовательно отщепляют из С- и N-конца полипептидной цепи обогащенный тирозином пептид; остается амелогенин с молекулярной массой 12 кДа. Затем с N-конца отщепляется пептид и остается обогащенный лейцином фрагмент (4 кДа). Отщепление пролинобогащенного фрагмента обусловливает образование амелогенина с молекулярной массой 10 кДа. После следующего отщепления пептида остается центральный фрагмент с наличием в положении 82-87 метионина и пролина.
36
