- •I часть: вопросы раздела «Общая химия»
- •9.Осмотические свойства растворов электролитов(дима). Осмолярность. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. Роль осмоса в биологических системах. Плазмолиз и цитолиз.
- •11.Буферные растворы и системы. Механизм буферного действия на примерах ацетатного, гидрокарбонатного,(тет но не понятно) гидрофосфатного(тоже самое), аммиачного буфера.
- •12.Расчет рН протолитических (буферных) систем (еще см в тет), зависимость рН от различных факторов. (дима)Зона буферного действия.
- •14.Понятия о буферных системах крови: гидрокарбонатная, фосфатная, гемоглобиновая, оксигемоглобиновая, протеиновая. Понятие о кислотно-основном состоянии организма.Ацидоз. Алкалоз.
- •21 Вопрос
- •22 Вопрос
- •23 Вопрос
- •24 Вопрос
- •25 Вопрос
- •26 Вопрос
- •27 Вопрос
- •28 Вопрос
- •Окисление
- •Восстановление
- •Концентрация окислителя и восстановителя. Увеличение концентрации реагирующих веществ в соответствии с принципом Ле-Шателье смещает равновесие овр в сторону образования продуктов реакции
- •29 Вопрос
- •30 Вопрос
- •31 Вопрос
- •Электрохимическая коррозия
- •Химическая коррозия
- •32 Вопрос
- •33 Вопрос
- •34 Вопрос
- •35 Вопрос
- •Строение двойного электрического слоя
- •36 Вопрос
- •37 Вопрос
- •Физическая адсорбция
I часть: вопросы раздела «Общая химия»
Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования. Закон Гесса. Расчеты по следствию из закона Гесса.(спросить у Димы).Термохимические процессы. Применение первого начала термодинамики к биосистемам
Первое начало термодинамики
-это всеобщий закон природы, закон превращения и сохраниения энергии
1. энергия не исчезает и не возникает из ничего, а только превращается из одного вила в другой строго в эквивалентных соотношениях
2. в изолированной системе внутренняя энергия постоянна, то есть (дельта) U = 0
3. если в закрытой системе подвести теплоту Q, то эта энергия расходуется на увеличение внутреннией энергии системы (дельта)U и на свершение системной работы против внешних сил окружающей среды: Q = (дельта) U + A
Энтальпия – это термодинамическая функция, характеризующая энергетическое состояние системы при изобарно-изотермических условиях. Q= ΔН
Величина (дельта)Н определяется разностью энтальпии, характеризующая конечное и начальное состояние системы: ΔН = Н(конечное) – Н(начальное)
Термохимические процессы.
Экзотермические – сопровождаются выделением энергии из системы в окружающувю среду. В результате этих процессов энатльпия системы уменьшается (Н(кон) < Н(нач)), следовательно ΔН = (Нкон-Ннач) < 0. ΔН (экзо) < 0
Эндотермические процессы -сопровождаются поглощением энергии в систему из окружающей среды в результате этих процессов энтальпия системы увеличивается, следовательно ΔН =(Н(кон) – Н(нач)) > 0. ΔН(эндо) > 0.
Стандартная энтальпия (ΔН0р, кДж/моль)
Стандартные условия: количество вещества – 1 моль, давление – 760 мм рт. Ст. = 101325Па, температура – 298 К =~250С
Стандартная энтальпия образования простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состоянии при стандартных условиях принимается равной нулю. Например, для кислорода ΔН0(О2) = 0, для графита ΔН0(С(графит))=0. Однако для озона ΔНо(О3) = 142,2 кДж/моль, алмаза ΔНО(Салмаз) = 1,8 кДж/моль.
Стандартная энтальпия образования сложного вещества равна энтальпии реакции получения 1 моль этого вещества из простых веществ при стандартных условиях. Например, стандартная энтальпия гипотетической реакции 2СГРАФИТ + 3Н2(г) + 0,5О2(г) = С2Н5ОН(ж) ΔНО(С2Н5ОН) = -277 кДЖ/моль
Закон Гесса
- Энтальпия реакции, т.е тепловой эффект реакци зависит от природы и состояния исходных веществ и конечных продуктов и не зависит от пути, по которму протекает реакция.
1) С2Н12О6 - 2С3Н6О3, ΔНр1
2) С6Н12О6 + 6О2 - 6СО2 + 6Н2О, ΔНр2
3) С3Н6О3 + 3О2 -3СО2 + 3Н2О, ΔНр3
Но чаще применяется следствия из закона Гесса
Энтальпия реакции равна разности между суммой энтальпии образования продуктов и суммой энтальпии образования исходных веществ.
ΔНр-ии = ДОПИШУ
Например, ДОПИШУ
Энтальпия прямой реакции численно равна энтальпии обратной реакции, но с противоположным знаком.
ΔН = - ΔН
Например, реакция фотосинтеза глюкозы, которая является обратной реакцией горения глюкозы: 6СО2 + 6Н2О (фотосинтез)(горение) = С6Н12О6 + 6О2
ΔНфотосинтеза= - ΔНгорения; ΔНГОРЕНИЯ(С6Н12О6(Т)) = -1273 кДж/моль
ΔНФОТОСИНТЕЗА(С6Н12О6(Г)) = - (-1273) = +1273 кДЖ/моль.
3.Если начальное и конечное состояние химической реакции совпадают, то ее тепловой эффект равен нулю.
Применение первого начала термодинамики к биосистемам.
Поступление пищи обеспечивает энергию, которая используется для выполнения различных функций организма или сохраняется для последующего использования. Энергия высвобождается из пищевых продуктов в процессе их биологического окисления, которое является многоступенчатым процессом.
Энергия пищевых продуктов используется в клетках первоначально для синтеза макроэргических соединений - например, аденозинтрифосфорной кислоты (ATФ). ATФ, в свою очередь, может использоваться как источник энергии почти для всех процессов в клетке.
Пищевые вещества окисляются вплоть до конечных продуктов, которые выделяются из организма. Например, углеводы окисляются в организме до углекислого газа и воды. Такие же конечные продукты образуются при сжигании углеводов в калориметре:
C6H12O6 + 6O2 = 6CO2 + 6H2O
Величина энергии, высвобождаемой из каждого грамма глюкозы в этой реакции, составляет 4,1 килокалории (кКал). Столько же энергии, образуется при окислении глюкозы в живых клетках, несмотря на то, что процесс окисления в них является многоступенчатым процессом и происходит в несколько стадий. Этот вывод основан на принципе Гесса, который является следствием первого закона термодинамики: тепловой эффект многоступенчатого химического процесса не зависит от его промежуточных этапов, а определяется лишь начальным и конечным состояниями системы.
Таким образом, исследования с помощью калориметра показали среднюю величину физиологически доступной энергии, которая содержится в 1грамме трех пищевых продуктов (в килокалориях): углеводы - 4,1; белки - 4,1; жиры - 9,3.
С другой стороны, в конечном итоге вся энергия, поступившая в организм, превращается в теплоту. Также при образовании АТФ лишь часть энергии запасается, большая - рассеивается в форме тепла. При использовании энергии ATФ функциональными системами организма большая часть этой энергии также переходит в тепловую.
Оставшаяся часть энергии в клетках идёт на выполнении ими функции, однако, в конечном счёте, превращается в теплоту. Например, энергия, используемая мышечными клетками, расходуется на преодоление вязкости мышцы и других тканей. Вязкое перемещение вызывает трение, что приводит к образованию тепла.
Другим примером является расход энергии, передаваемой сокращающимся сердцем крови. При течении крови по сосудам вся энергия превращается в тепло вследствие трения между слоями крови и между кровью и стенками сосудов.
Следовательно, по существу вся энергия, потраченная организмом, в конечном счете, преобразуется в теплоту. Из этого принципа существует лишь единственное исключение: в случае, когда мышцы выполняют работу над внешними телами.
Если человек не выполняет внешней работы, то уровень высвобождения организмом энергии можно определить по величине общего количества теплоты, выделенной телом. Для этого применяют метод прямой калориметрии, для реализации которого используют большой, специально оборудованный калориметр. Организм помещают в специальную камеру, которая хорошо изолирована от среды, то есть не происходит обмена энергией с окружающей камеру средой. Количество теплоты, выделенной исследуемым организмом, можно точно измерить. Эксперименты, выполненные этим методом, показали, что количество энергии, поступающей в организм, равно энергии, выделяющейся при проведении калориметрии.
Прямая калориметрия в проведении трудоёмка, поэтому в настоящее время используют метод непрямой калориметрии, который основан на вычислении энергетического выхода организма по использованию им кислорода.
Вопрос 2 .Основные термодинамические функции состояния . Энтропия. Энергия Гиббса.Расчет изменение значения энергии Гиббса при различных условиях(Спросить у Димы). Эндергонические и экзергонические реакции, принцип энергетического сопряжения в биологических системах.
Основные термодинамические функции состояния:
Общая энергия(E) Энергия Внутренняя(V) Энтальпия(H) Энтропия(S) Энергия Гиббса(G)
Энтропия – мера хаоса, мера неупорядоченности систем или это термодинамическая вероятность (сколько микросостояний возможно в макросостоянии)
ΔSР-ИИ = ДОПИШУ
Энтропия зависит от природы вещества, температуры, давления и агрегатного состояния:
- SГАЗОВ > SЖИД > SТВ
S(CГРАФИТ ) > S(CАЛМАЗ )
- Чем выше температура, тем выше энтропия
- Чем выше давление, тем ниже энтропия
- Чем больше деформация, тем выше энтропия
Энергия Гибса (G)
Энергия Гиббса является обобщенной термодинамической функцией состояния системы, учитывающей энергетику и неупорядоченность системы при изобарно – изотермических условиях. (Величина показывающая изменение Е в ходе хим реакции и дающая ответ на вопрос о принципиальной возможности протекания хим реакции)
G=V+pV-TS
Расчет ΔGр-ии:
При стандартных условиях: ДОПИШУ
В любых условиях ΔGсчитается ΔН – ТΔS
ΔG= ΔН – ТΔS, где ΔН – характеризует полное изменение энергии системы при р,Т =constи отражает стремление системы к минимуму энергии;
ТΔS – характеризует ту часть энергии, которую нельзя превратить в работу, и отражает стремление системы к максимуму неупорядоченности.;
ΔG характеризует ту часть энергии, которую можно превратить в работу
Экзэргонические реакции – биохимические реакции, сопровождающиеся уменьшением энергии Гибса (ΔGр < 0). Они могут совершаться самопроизвольно. Если в течении экзэргонической реакции энергия Гибса только понижается, то такая реакция протекает в данных условиях самопроизвольно и необратимо.
Эндэргонические реакции – биохимические реакции, сопровождающиеся увелением энергии Гибса (ΔGр > 0). Они не возможны без внешнего подвода энергии. Для того, чтобы подобная реакция происходила, надо постоянно подводить энергию. Например, процесс фотосинтеза в растениях идет только под действием солнечного света: 6СО2 + 6Н2О С6Н12О6 + 6О2. ΔGр = +2870 кДж/моль
Равновесие (ΔGр = 0)
Принцип энергетического сопряжения в биосистемах.
Для того, чтобы в живых системах протекали эндэргонические реакции (ΔGр > 0), необходимо, чтобы они были сопряжены с экзэргоническими реакциями (ΔGр < 0). Такое сопряжение возможно, если обе реакции имеют какое-либо общее промежуточное соединение и на всех стадиях сопряженных реакций суммарный процесс характеризуется отрицательным значением изменения энергии Гибса (∑ΔGсопр.р < 0). Например, синтез сахарозы является эндэргонической реакцией и самопроизвольно происходить не может: глюкоза + фруктоза - сахароза + Н2О ΔGр = +20,9 кДж/моль. Однако сопряжение этой реакции с экзэргонической реакцией гидролиза АТФ сопровождающееся образованием общего промежуточного глюкозо – 1- фосфата, приводит к тому, что суммарный процесс имеет ∑ΔG < 0: АТФ + глюкоза + фруктоза - сахароза + АДФ + Ф ΔGр = -29,2 кДЖ/моль
Вопрос 3. Предмет и основные понятия химической кинетики. Скорость, константа скорости химических реакций; их зависимость от природы реагирующих веществ, концентрации (закон действующих масс), температуры (правило Вант-Гоффа, уравнение Аррениуса). Применение методов химической кинетике в медицине, биологии(Дима), фармакологии, физиологии(Дима).
Кинетика химических реакций изучает скорость, время и механизмы химический реакций.
Основные понятия:
Химические реакции делятся на гомогенные и гетерогенные.
Гомогенные реакции характеризуются отсутствием поверхности раздела фаз между реагентами, поэтому их взаимодействие протекает по всему объему системы.
а) реакции с газообразными веществами: 2NO + O2 2NO2
б)реакции в растворах: 2KOH + H2SO4 = K2SO4 + 2H2O
Гетерогенные реакции характеризуются наличием поверхности раздела между реагентами, где и протекает их взаимодействие. При гетерогенных реакциях вещества находятся в разных агрегатных состояниях СаО(т) + СО2(г) СаСО3
Скорость химических реакций определяется изменением концентрации реагирующих веществ в единицу времени.
Истинная скорость химических реакций характеризует скорость в данный момент времени
Средняя скорость химической реакции по данному компоненту является усредненной скоростью за данный промежуток времени.
Простые(элементарные) реакции – реакции, протекающие в одну стадию.
Сложные реакции – реакции, протекающие в несколько стадий, каждая из которых является простой реакцией.
Скорость, константа скорости химических реакций; их зависимость от различных факторов
*значение константы скорости реакции численно равно скорости реакции при концентрациях реагентов равных 1 моль/л.(зависит от природы вещества, температуры, но не от концентрации вещества)
Факторы, влияющие на скорость реакции:
Природа реагирующих веществ
- прочность энергетических связей
- агрегатное состояние
- виды частиц
2) зависимость скорости реакций от концентрации
- скорость гомогенных реакций зависит от числа соударений
*скорость реакции в данный момент зависит от концентрации газов или жидкостей, и не зависит от концентрации твердого вещества.
Зависимость скорости реакции от концентрации, закон действующих масс.
Закон действующих масс(ЗДМ)
- Скорость реакций прямо пропорциональна произведению молярных концентраций реагирующих веществ, находящихся в менее конденсированном состоянии, взятых в степенях равных стехиометрическим коэффициентам
МАТЕМАТИЧЕСКАЯ ЗАПИСЬ ЗДМ
Для гомогенных:
- аА + вВ ->mM + nN (для прямой)
- ЗДМ: Vпр = k * Ca(A) *Cb(B)
Vпр = k[A]a * [B]b
Зависимость скорости реакции от концентрации
- Скорость реакции в данный момент времени зависит от концентрации газов или жидкостей, и не зависит от концентрации твердого вещества.
2NO(Г) + O2(Г) Vпр = k * [NO]2 * [CO2]
Зависимость скорости реакции от температуры. Правило Вант-Гоффа
Влияние температуры на скорость реакции отражено в правиле Вант-Гоффа:
С увеличением температуры на каждые 10 К скорость химической реакции возрастает в 2-4 раза:
![]() При
повышении температуры на каждые 10
градусов константа скорости гомогенной
элементарной реакции увеличивается в
два—четыре раза.
При
повышении температуры на каждые 10
градусов константа скорости гомогенной
элементарной реакции увеличивается в
два—четыре раза.

**где v1,v2, там должно быть k1,k2
Энергия активации является очень важной энергетической характеристикой реакции, которая связана с константой скорости реакции уравнением Аррениуса:
![]()

Из этого уравнения следует, что чем больше энергия активации, тем меньше будут константа и скорость химической реакции, так как в системе будет меньше число активных частиц
Химическая кинетика и медицина Фармакокинетика является одной из наиболее молодых и интенсивно развивающихся медицинских дисциплин. Изучение фармакокинетики позволяет рассматривать взаимодействие между лекарственным средством и организмом на уровне концентраций лекарства во внутренней среде организма [2]. Фармакокинетика - это учение о кинетических закономерностях распределения веществ во внутренней среде организма. она изучает кинетику всасывания и распределения. метаболизм и выделение препаратов. а также их фармакологическое, терапевтическое и токсическое воздействие на организм животного и человека. В фармакокинетике отражено одно из наиболее важных для клиники применений фармакокинетики - установление связи между концентрацией препарата в области его действия и величиной эффекта. Некоторые приемы химической кинетики используются при фармакокинетическом моделировании. Основа теоретических построений фармакокинетики заключается в том, что все процессы переноса вещества рассматриваются в качестве химических реакций, к которым приложим соответствующий математический аппарат. При этом существо процессов, которые приводят к количественным изменениям содержания препарата в организме является второстепенным, поскольку задача фармакокинетики обычно ограничивается формальным описанием их количественной стороны. В этом смысле исходная предпосылка фармакокинетики совпадает с предпосылкой химической кинетики. При рассмотрении простейшей аналогии биологической системы, как физической модели, её можно описать математическими уравнениями химической кинетики. При этом процессы могут протекать по закономерностям различного порядка: нулевого, первого, второго. Метаболические процессы в организме протекают большей частью по законам кинетики первого и второго порядка. В настоящее время активно развиваются исследования в области биокинетики, на основе химико-кинетических закономерностей изучается количественная микробиология и кинетическое моделирование процессов микробного роста. Существует целый раздел в медицинской биохимии - медицинская энзимология, в котором выделяют энзимодиагностику, энзимопатологию и энзимотерапию, изучение которых невозможно без знаний кинетики ферментативных реакций. Химическая кинетика и фармация Образовательный стандарт специальности «Фармация» включает ряд фундаментальных химических дисциплин (общую и неорганическую химию, физическую и коллоидную, аналитическую, органическую), которые создают теоретический и экспериментальный фундамент для профильных дисциплин (фармацевтическая химия, фармакогнозия, фармацевтическая технология). Объектом исследования названных дисциплин являются: вещество, лекарственный препарат, лекарственное средство. Природу этих объектов составляет качественный и количественный элементный и компонентный состав и строение, физические и химические свойства. Объекты исследования могут быть как природного так и синтетического происхождения. Получение и выделение получаемых веществ, исследование их качественного и количественного состава входит в нормативные фармакопейные требования, при этом используются различные физико-химические методы, в том числе и кинетические. В неорганической и органической химии при синтезе веществ, изучении их химических свойств химическая кинетика используется для изучения кинетических закономерностей и механизма протекания соответствующих химических реакций. В аналитической химии химическая кинетика используется при разработке современных селективных кинетических методов анализа химических элементов и соединений. В фармацевтической химии начинается активно развиваться новое направление - «кинетические методы в фармацевтическом анализе». В фармакогнозии химическая кинетика может использоваться при выделении биологически активных веществ из растительного сырья, и изучении влияния различных факторов в том числе ферментов на сохранность и устойчивость биологически активных веществ. В фармацевтической технологии получения и приготовления лекарственных средств, при изучении ускоренного старения лекарственных препаратов применяются уравнения химической кинетики первого и второго порядков, а также уравнение Аррениуса. 4.Понятие о теории активных соударений, энергия активации. Энергетический профиль экзо- и эндотермической реакций, проходящих без катализатора и в присутствии катализатора(Дима). Особенности каталитической активности ферментов.
Понятие о теории активных соударений
Сильное влияние температуры на скорость химической реакции объясняет теория активных столкновений. Основные постулаты этой теории:
-не каждое столкновение приводит к акту химического взаимодействия
- к химическому взаимодействию приводят только те столкновения, в которых учавствуют частицы, обладающие энергией, необходимой для данного взаимодействия(энергия активации)
- при соударении частицы должны быть определенным образом сориентированы относительно друг друга.
Энергия активации – энергия, которой должны обладать реагирующие частицы, чтобы их столкновение привело к реакции( Еа, кДЖ/моль)
Энергия активации реакции характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию конечных веществ. Энергия активации необходима для возникновения непрочного переходного комплекса [ A…B], который не является химическим соединением в подлинном смысле этого слова, так как в нем Энергия активации зависит от природы реагирующих веществ, от пути протекания реакции, и не зависит от температуры, если с ее изменением не произошло изменения механизма реакции. Опытным путем установлено, что реакции с Еа < 50 кДж/моль при 298 К идут с высокой скоростю. Это характерно для реакций с участием радикалов или ионов. Если реакция имеет Еа > 100 кДж/моль, то ее скорость при 298 К неизмеримо мала.
Энергия активации является очень важной энергетической характеристикой реакции, которая связана с константой скорости реакции уравнением Аррениуса:
![]()

Из этого уравнения следует, что чем больше энергия активации, тем меньше будут константа и скорость химической реакции, так как в системе будет меньше число активных частиц.
Особенности
католической активности ферментов.


5.Кинетическое(Дима) и термодинамическое условия химического равновесия. Константа равновесия, ее зависимость от различных факторов. Смещение равновесия. Принцип Ле-Шателье и принцип адаптивных перестроек для живых систем.
Химическим равновесием называется такое состояние обратимого процесса, при котором скорости прямой и обратной реакции равны.
Протекание самопроизвольного процесса в термодинамической системе сопровождается уменьшением свободной энергии системы (dG < 0, dF < 0). Очевидно, что рано или поздно (напомним, что понятие "время" в термодинамике отсутствует) система достигнет минимума свободной энергии. Условием минимума некоторой функции Y = f(x) является равенство нулю первой производной и положительный знак второй производной: dY = 0; d2Y > 0. Таким образом, условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала:
Изобарно-изотермические (P = const, T = const):
ΔG = 0 dG = 0, d2G > 0
Изохорно-изотермические (V = const, T = const):
ΔF = 0 dF = 0, d2F > 0
Состояние системы с минимальной свободной энергией есть состояние термодинамического равновесия:
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Константа равновесия, ее зависимость от различных факторов.
Константа химиеского равновесия обратимого процесса равна отношению произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициэнтам при формулах, соответствующих веществ в уравнении химической реакции.
Значение константы равновесия определяет положение равновесия, т. е. относительное содержание исходных веществ и конечных продуктов в системе, находящейся в равносесном состоянии.
Если Кравн. > 1, то в системе выше содержание конечных продуктов, т.е. положение равновесия смещено вправо.()
Если Кравн. < 1, то в системе выше содержание исходных веществ, т.е. положение равновесия смещено влево.()
Константа химического равновесия зависит от природы реагирующих веществ и температуры, но не зависит от присутствия катализатора, поскольку он изменяет константы скоростей и прямой и обратной реакции в одинаковое число раз. Катализатор, увеличивая скорости прямой и обратной реакции, уменьшает время, необходимое для установления равновесия в системе.
Константа химического равновесия не зависит от концентраций реагирующих веществ и давления в системе, так как эти факторы не влияют на константы скоростей химических реакций.
Влияние изменения условий на химическое равновесие определяется принципом Ле Шателье
- Если на систему, находящуюся в равновесии производятся какие-либо внешние воздействия(изменение концентрации, температуры, давления), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
Влияние концентрации реагентов: увеличение концентрации исходных веществ смещает равновесие в сторону конечных продуктов. Увеличение концентрации конечных продуктов смещает равновесие в сторону исходных веществ.
Влияние давления: Повышение давления в системе смещает химическое равновесие в направлении реакции, идущей с образованием меньшего числа молей газообразных веществ, т.е в сторону уменьшения объема, а понижение давления в системе вызывает сдвиг равновесия в противоположную сторону.
Влияние температуры: повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение температуры – в сторону экзотермической.
Катализатор не вызывает смещения равновесия, а только ускоряет его наступление.
в природе существует принцип адаптивных перестроек.
Любая живая система при воздействии на нее перестраивается так, чтобы уменьшить это воздействие.
Соблюдение этого принципа в живых системах позволяет им поддерживать состояние гомеостаза. Основу гомеостаза составляет стационарное состояние системы, причем далекое от равновесия, из-за чего живые системы способны к эволюции.
Многие обратимые биохимические процессы совершаются при участии биокатализаторов - ферментов. Эти вещества, ускоряя протекание реакций, резко сокращают время установления состояния равновесия, что чрезвычайно важно для организма.
6.Коллигативные свойства разбавленных растворов неэлектролитов. Закон Рауля и следствия из него: понижение температуры кристаллизации, повышение температуры кипения растворов. Осмос. Осмотическое давление. Встречаемость в медико-биологической практике.(Дима)
Коллигативными свойствами называются свойства растворов, не зависящие от природы частиц растворенного вещества, а зависящие только от концентрации частиц в растворе.
Коллигативными свойствами разбавленных растворов являются:
- скорость диффузии
-осмотическое давление
-давление насыщенного пара растворителя над раствором
- температура кристаллизации раствора
- температура кипения раствора
Диффузия – взаимное проникновение молекул растворителя и растворенного вещества друг с другом.
Осмос – это односторонняя диффузия молекул растворителя через полупроницаемую перегородку(мембрану) из раствора с меньшей концентрацией в раствор с большей концентрацией.
Осмотическое давление – давление, которое надо приложить к системе, чтобы прекратить осмос.
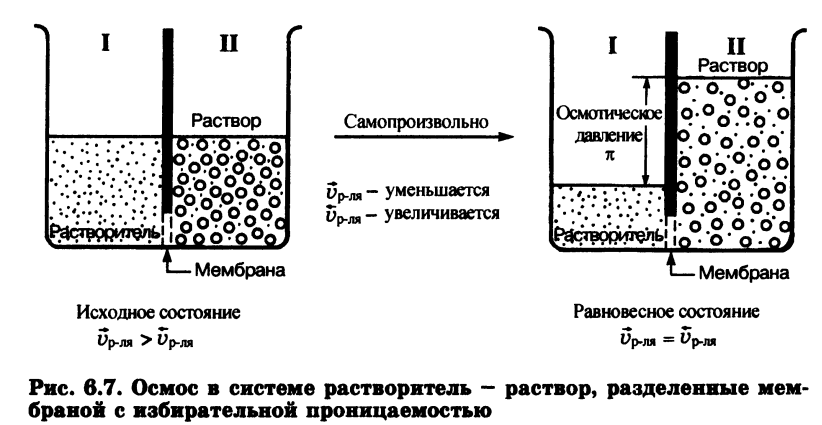
В.
Пфеффер и Я. Вант-Гофф, изучая количественную
зависимость осмотического давления от
внешних факторов, установили, что оно
подчиняется объединённому газовому
закону Менделеева – Клайперона:
![]()
Где, с – молярная концентрация вещества в растворе, моль/л.
Из этого уравнения видно, что осмотическое давление не зависит от сил природы от природы растворенного вещества, а зависит только от числа частиц в растворе и от температуры. Однако это уравнение справедливо только для растворов, в которых отсутствует взаимодействие частиц, т.е для идеальных растворов.
ЗАКОН РАУЛЯ:
-Относительное понижение насыщенного пара прямо пропорционально молярной доле вещества.
∆Р \ Р0 –понижение давления насыщенного пара над раствором, Па
∆Р \ Р0 = I *N(в-ва)
N(в-ва) + N(р-ля) = 1
(Р0 – Р) = ∆Р
Р – давление пара над раствором, Па
Р0 – давление пара над чистым растворителем, Па
Закон Рауля справедлив только для идеальных растворов, то есть растворов, образование которых не сопровождается химическим взаимодействием и изменением объема.
Температура замерзания жидкости – это температура, при которой давление насыщенного паранад жидкостью становится равным давлению насыщенного пара над кристаллом этой жидкости.
Температура кипения жидкости – это температура, при которой давление насыщенного пара над жидкостью становится равным внешнему давлению.
При осмосе молекулы растворителя приемущественно движутся через мембрану в том направлении, где концентрация частиц вещества больше, а концентрация растворителя меньше. Другими словами, в результате осмоса происходит всасывание растворителя в ту часть системы, где концентрация частиц вещества больше. Если осмотическое давление у растворов, то они называются изотоническими и между ними происходит подлинно равновесный обмен растворителем. В случае контакта двух растворов с разным осмотическим давлением гипертоническим раствором называется тот, у которого осмотическое давление больше, а гипотоническим – раствор с меньшим осмотическим давлением.
Вант-Гофф ввел в уравнение поправочный изотонический коэффициент
i = ∆Тзам (эксп) \ ∆Тзам (теор) = ∆Ткип (э) \ ∆Ткип (т) = П осм (э) \ П осм (т) = ∆Рэ \ ∆Рт
i показывает во сколько раз практически полученные величины выше теоретических, то есть расчетных.
Посм = i С(Х) R T
∆Тзам = i Kз b(X)
∆Ткип = i Kэ b(X)
∆Р = i Р0 χ(Х2)
i связан со степенью диссоциации уравнением:
α (ст.д.) = (i – 1) \ (n – 1)
1 < i < n (число ионов)
Роль осмоса в биологических системах.
Благодаря осмосу происходит поставка воды в клетки и межклеточные пространства.
Тугорд – упругость клеток, которая обеспечивает эластичность тканей и сохраняет определенную форму органов, обусловлена осмотическим давлением.
В организме человека при потере крови используют 0,9 %-ный раствор поваренной соли. Этот раствор в организме создает такое же осмотическое давление, что и плазма крови ( используют в качестве кровезаменителей)
Растворы, имеющие одинаковое давление с плазмой крови, называют изотоническими.
Растворы, имеющие более высокое давление, чем плазма крови – гипертоническими, а более низкое – гипотоническими.
При помещении клеток в изотонический раствор клетки сохраняют свой размер и нормально функционируют. При помещении в гипертонический раствор – вода из клетки уходит в раствор и наблюдается сморщивание – плазмолиз клеток. При помещении в гипотонический раствор – вода из раствора переходит внутрь клеток, что приводит к набуханию, а следовательно разрыву оболочек и вытеканию клеточного содержимого – лизис, в случае эритроцитов – гемолиз.
Явление осмоса используется в медицинской практике: в хирургии гипертонические повязки вводят в гнойные раны. Механизм: ток жидкости раны через марлю направляется наружу, в результате рана очищается от гноя, микроорганизмов и продуктов распада.
На явлении осмоса основано действие слабительных. Эти соли плохо высасываются при попадании в желудочно-кишечный тракт, в результате применения гипертонических растворов этих солей, в просвет кишечника устремляется большое количество воды через слизистую, что способствует послабляющему действию этих солей.
Гипертонические растворы в небольших количествах вводят при глаукоме, чтобы уменьшить количество влаги в передней камере глаза.
7.Электролитическая диссоциация. Взаимосвязь(Дима) между степенью диссоциации и константой диссоциации слабого электролита их зависимость от различных факторов(Дима). Расчет концентрации ионов сильного и слабого электролита(Дима). Физико-химические основы водно-электролитного баланса в организме. + см в тет по лекции. Электролитами называются вещества, расплавы, растворы которых содержат подвижные ионы и проводят электрический ток
Электролитическая диссоциация – процесс распада вещества на ионы, под действием растворителя в растворах или расплавах .
Все электролиты принято делить на сильные и слабые. Сильными электролитами являются сильные кислоты, щелочи и большинство солей(HCl, H2SO4, HNO3, KOH, NaOH, Ba(OH)2, NaCl, KNO3)
К слабым электролитам относятся слабые кислоты и слабые основания(CH3COOH, H2CO3, HCN, HF, HNO2, NH3 · H2O).Очень слабым электролитом является вода.
Пример. Написать уравнения электролитической диссоциации для следующих электролитов:
![]()
Степенью электролитической диссоциации называется отношение количества электролита, распавшегося на ионы, к общему количеству растворенного электролита.
Значение α в растворах может изменяться в пределах 0 < α < 1.
Константа диссоциации слабого электролита
Использую ЗДМ, электролитическое равновесие в растворах слабых электролитов можно кличественно выразить величиной константы диссоциации. В случае слабых кислот эта величина обозначается Ка(acid), в случае слабых оснований Кb(base):
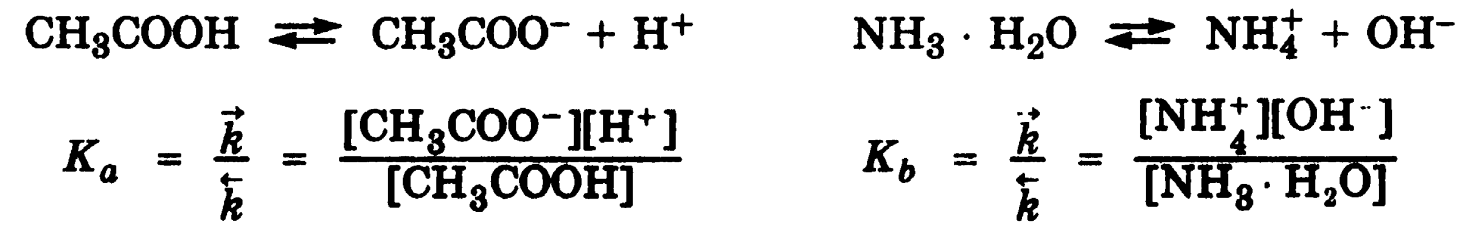
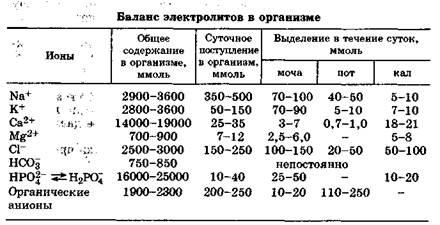
. Физико-химические основы водно-электролитного баланса в организме
Содержание воды в организме взрослого человека составляет в среднем 60 % массы тела, колеблясь от 45 % (у тучных пожилых людей) до 70 % (у молодых мужчин), что составляет примерно 40 л. Большая часть - 2/з воды, около 27 л, находится внутри клеток. Внеклеточная вода составляет 1/з от общей воды - 13 л, из них примерно 4,5 л приходится на внутрисосудистые жидкости (кровь - 3 л, лимфа - 1,5 л), а 8,5 л - на межклеточную жидкость, называемую интерстициальной. Интерстициальная жидкость - система наиболее подвижная и изменяющая свой объем при избытке или недостатке воды в теле. Эта водная система внутренней среды организма контактирует с внешней средой с помощью различных физиологических систем, обеспечивающих не только обмен метаболитами, но и регуляцию этих процессов (рис. 7.1).
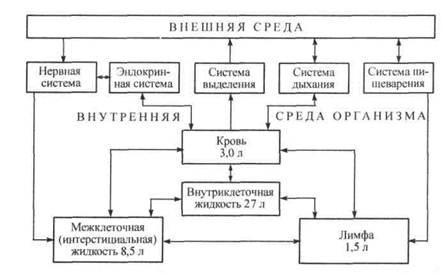
Рис. 7.1. Схема водно-электролитного баланса организма человека
В течение суток в организм человека поступает с питьем около 1,2 л воды, с пищей - примерно 1 л, около 300 мл воды образуется при окислении метаболитов. При нормальном водном балансе у здорового человека столько же воды (около 2,5 л) выделяется из организма: почками (1-1,5 л), с калом (5О-20О мл), посредством испарения кожей (0,5-1 л) и легкими (около 400 мл). Вся вода организма обновляется примерно через месяц, а вода внеклеточной жидкости - за неделю. Это свидетельствует о большой интенсивности протекающих обменных процессов. Система регуляции водного баланса обеспечивает два основных гомеостатических процесса: во-первых, поддержание постоянства общего объема жидкости в организме и, во-вторых, оптимальное распределение воды между указанными водными системами.
В организме большая часть молекул воды находится в связанном состоянии за счет гидратации ионов, молекул органических соединений и биополимеров, различных ассоциатов и мицелл (разд. 6.1). Кроме того, вода входит в состав различных клеточных органелл: рибосом, митохондрий, лизосом, меж- и внутриклеточных мембран. По мнению автора, именно вода участвует в качестве основного и самого динамичного компонента в формировании жидкокристаллического состояния соответствующих биосубстратов и тем самым способствует созданию подвижных внутри- и межклеточных структур. Благодаря этому достигается характерная для живого тонкая упорядоченность процессов в клетке и в организме в целом. Например, от насыщения водой рибосом зависит поддержание их структуры и способность осуществлять белковый синтез, от степени набухания митохондрий - интенсивность протекающего в них процесса окислительного фосфорилирования и т. п. По образному выражению А. Сент-Дьёрдьи, вода в организме является динамичной "матрицей жизни".
Избыточное поступление и образование воды при неадекватно малом ее выделении из организма приводит к накоплению воды, этот сдвиг водного баланса называется гипергидратацией. При гипергидратации вода накапливается в основном в интерстициальной (межклеточной) жидкости. При этом ее осмотическое давление становится ниже, чем внутри клеток, которые поглощают воду, набухают, и осмотическое давление в них тоже снижается.
Недостаточное поступление и образование воды или чрезмерно большое ее выделение из организма приводят к уменьшению содержания воды, прежде всего в интерстициальной жидкости, что называется дегидратацией и сопровождается высасыванием воды из клеток, пока их осмотическое давление не станет равным осмотическому давлению в межклеточном пространстве.
Большую роль в регуляции водного баланса играет баланс электролитов и полиэлектролитов (белков), которые обеспечивают определенную величину осмотического и онкотического давления в биожидкостях, тем самым влияя на обмен молекулами воды между ними. Основные минеральные и органические ионы организма и их содержание в водных системах приведены в табл. 7.4. Лимфа по составу и содержанию минеральных ионов близка к плазме крови, но из-за повышенного содержания гидрокарбонат-иона НСОз основность лимфы выше: рН = 8,4-9,2. Осмотическое давление лимфы близко к осмотическому давлению плазмы крови, а онкотическое - существенно ниже из-за меньшей концентрации в ней белков (6-14 моль/л).
Минеральные ионы поступают в организм с пищей и питьем, а гидрокарбонат-анион НСО3-, органические ионы и белки в основном являются продуктами обмена веществ. Для поддержания электролитного баланса и соответственно жизнедеятельности организм в сутки должен в среднем получать (моль): катионов натрия - 400, катионов калия - 100, анионов хлора - 200, фосфат-анионов - 25, катионов кальция - 30, катионов магния - 10, органических анионов - 230 (табл. 7.4). В табл. 7.4 также указано, каким путем и в каком количестве эти ионы выделяются из организма.
Анализируя
ионный состав биожидкостей человека
(табл. 7.5), прежде всего необходимо
обратить внимание на небольшое
разнообразие ионов и на то, что они
содержат больше всего из катионов
Na+ и
К+,
а из анионов - ![]() Причем
во внеклеточных жидкостях преобладают
катионы Na+ и анионы Сl-, а во внутриклеточной
- катионы К+ и
анионы
Причем
во внеклеточных жидкостях преобладают
катионы Na+ и анионы Сl-, а во внутриклеточной
- катионы К+ и
анионы ![]() Другая
важная особенность биожидкостей
оргавизма в том, что в межклеточных
жидкостях преобладают частицы с
положительной гидратацией, а во
внутриклеточной - частицы с отрицательной
гидратацией (разд. 6.1). Это, по мнению
автора, связано с тем, что внутри клетки
вода гидратирует кроме указанных частиц
еще и клеточные органеллы, что значительно
повышает содержание структурированной
воды внутри клетки. По-видимому, для
нормального функционирования организма
в биожидкостях должны поддерживаться
определенные соотношения: "связанная"
вода/"свободная" вода и
"структурированная"
вода/"деструктурированная" вода,
которые для внутриклеточной жидкости
должны быть больше, чем для межклеточной,
чтобы обеспечить тургор клетки. Указанные
соотношения в биожидкостях
поддерживаются в основном за счет
определенного соотношения в них
частиц с положительной и отрицательной
гидратацией. Кроме влияния на структуру
водной среды в организме электролиты
выполняют еще ряд функций.
Другая
важная особенность биожидкостей
оргавизма в том, что в межклеточных
жидкостях преобладают частицы с
положительной гидратацией, а во
внутриклеточной - частицы с отрицательной
гидратацией (разд. 6.1). Это, по мнению
автора, связано с тем, что внутри клетки
вода гидратирует кроме указанных частиц
еще и клеточные органеллы, что значительно
повышает содержание структурированной
воды внутри клетки. По-видимому, для
нормального функционирования организма
в биожидкостях должны поддерживаться
определенные соотношения: "связанная"
вода/"свободная" вода и
"структурированная"
вода/"деструктурированная" вода,
которые для внутриклеточной жидкости
должны быть больше, чем для межклеточной,
чтобы обеспечить тургор клетки. Указанные
соотношения в биожидкостях
поддерживаются в основном за счет
определенного соотношения в них
частиц с положительной и отрицательной
гидратацией. Кроме влияния на структуру
водной среды в организме электролиты
выполняют еще ряд функций.
|
| |
|
|
|
Катионы натрия и анионы хлора поддерживают осмотическое давление внеклеточных жидкостей, а катионы калия и фосфат-анионы - внутриклеточной жидкости. Изменение уровня содержания этих ионов неизбежно влечет за собой сдвиг осмотического давления в системе и в результате - объема жидкости в ней. Регуляция водного обмена в организме за счет концентрации ионов в основном происходит на уровне интерстициальной жидкости, где изменяется содержание катионов Na+. Уменьшение концентрации катионов Na+ в интерстициальной жидкости способствует перемещению воды в клетки, а увеличение их содержания вызывает выход воды из клеток.
Содержание белков в биожидкостях определяет онкотическое давление, которое в совокупности с гидростатическим и гидродинамическим давлением в системах регулирует перераспределение воды между ними (разд. 6.4.2), обеспечивая поддержание водного гомеостаза.
Катионы натрия, калия, кальция и анионы хлора участвуют в процессах возбуждения нервных клеток и проводимости нервных волокон (разд. 24.6).
Катионы кальция и фосфат-анионы являются основными компонентами костной ткани (разд. 11.4). Катионы кальция (ионизованный кальций) влияют на проницаемость мембран, свертывание крови и сокращение мышц.
Катионы магния являются в основном внутриклеточными катионами. Они входят в состав более 300 разных ферментов, обеспечивая их активность. Они способствуют синтезу белков, уменьшают возбудимость нервно-мышечной системы, сократимость миокарда и глазных мышц.
Анионы слабых кислот НС03-, НР03-2 =Н2Р04- и ионы белков участвуют в регуляции кислотно-основного равновесия организма, входя в состав буферных систем (разд. 8.5). Кроме того, гидрокарбонат-анион является транспортной формой для удаления С02 - продукта тканевого дыхания. Фосфаты - необходимый компонент нуклеиновых кислот, фосфолипидов, макроэргических соединений (АТФ) и костной ткани.
|
| |
|
|
|
Водно-электролитный баланс поддерживается в организме не только замечет определенного состава внутри- и межклеточных жидкостей, но и за счет физико-химических процессов (гидратация, диффузия, осмос, проницаемость мембран), а также в результате физиологических процессов: поступления компонентов в организм, перераспределения и депонирования их в клетках и межклеточных жидкостях и выделения из организма, которые рассматриваются в курсах физиологии. Благодаря водно-электролитному балансу, по-видимому, поддерживаются на необходимом уровне структурно-информационные свойства внутри- и межклеточных водных систем (разд. 6.1) и тем самым обеспечивается гомеостаз организма.
|
| |
|
|
|
8. Коллигативные свойства разбавленных растворов электролитов. Закон Рауля и следствия из него: понижение температуры кристаллизации, повышение температуры кипения растворов. Осмоляльность. Встречаемость в медико-биологической практике.
Тоже самое что и вопрос номер 6