
Posob.GFS
.pdf
Министерство здравоохранения Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
«Саратовский государственный медицинский университет имени В.И. Разумовского» Министерства здравоохранения Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава России)
Методические рекомендации к занятиям
по химии биологически важных
гетерофункциональных органических соединений
учебно – методическое пособие для студентов 1 курса медицинского университета
САРАТОВ
2013
УДК 541.64 : 547.1 : 577.1 (075.8)
ББК 24.23 + 28.072 я 73
Авт. знак М545
Методическое пособие предназначено для студентов I курса лечебного, педиатрического, стоматологического и медико – профилактического факультетов Саратовского государственного медицинского университета и разработано в соответствии с «Программой для студентов факультетов по специальности: Лечебное дело, Педиатрия, Стоматология, Медико - профилактическое дело медицинских вузов».
В пособии вопросы теории и практики соединены в единую форму занятий. Выполнение опытов построено как самостоятельное научное исследование. По каждой теме приведены план и вопросы для самоподготовки, теоретическая часть, упражнения и варианты тестированных заданий для самостоятельной работы студентов. Последовательность расположения заданий служит установлению логической связи между основными понятиями и раскрытию обобщающих закономерностей.
Составители:
Рецензенты:
Утверждено и рекомендовано к изданию Центральным координационно - методическим Советом и Ученым Советом Саратовского медицинского университета.
© Саратовский медицинский
университет, 2011.
©
2
“Гидрокси- и оксокислоты”
Цель занятия: изучение электронного, пространственного строения и хи-
мических свойств биологически важных гидрокси- и оксокислот.
Студент должен знать:
-классификацию гидрокси- и оксокислот;
-номенклатуру и изомерию гидрокси- и оксокислот;
-особенности химических свойств оксо - , гидрокси - и фенолокислот;
Студент должен уметь:
-писать уравнения химических реакций оксо - , гидрокси - и фенолокислот;
-объяснять химическое поведение гидроксикислот в организме;
-объяснять кето - енольную таутомерию, роль этого фактора в биохимии организма.
Перечень вопросов для подготовки по теме “ Гидрокси- и оксокислоты ”
1. Гидроксикислоты (одноосновные (молочная), двухосновные (винные,
яблочная) и трехосновные (лимонная) кислоты). Классификация. Номенк-
латура. Изомерия. Химические свойства как гетерофункциональных соеди-
нений. Специфические реакции -, - и -гидроксикислот алифатического ряда. Лактоны, лактиды, их отношение к гидролизу.
2. Фенолокислоты. Салициловая кислота. Получение и химические свойства как гетерофункционального соединения. Эфиры салициловой ки-
слоты, применяемые в медицине: метилсалицилат, фенилсалицилат, аце-
тилсалициловая кислота, п-аминосалициловая кислота (ПАСК).
3

3. Оксокислоты (альдегидо- (глиоксиловая) и кетонокислоты (пировино-
градная, ацетоуксусная, щавелевоуксусная, -кетоглутаровая)). Номенкла-
тура. Изомерия. Химические свойства как гетерофункциональных соедине-
ний. Специфические свойства в зависимости от взаимного расположения функциональных групп.
4. Кето-енольная таутомерия -оксокислот (ацетоуксусной и щавелево-
уксусной).
4
Гидрокси(окси)кислоты
Это гетерофункциональные органические вещества, содержащие одно-
временно одну или несколько гидроксильных (–ОН) и карбоксильных групп
(–СООН). Количество карбоксильных групп (–СООН) определяет основ-
ность, а гидроксильных ( –ОН) – атомность.
(COOH)n
В общем виде их формулу можно представить R /\(OH)m .
В простейшем случае n = m = 1.
Номенклатура.
По международной номенклатуре ИЮПАК в составе молекулы выделяют функциональные группы и определяют их старшинство. Карбоксильная группа старше гидроксильной, следовательно, определяет окончание назва-
ния, а младшая гидроксильная группа указывается приставкой гидрокси- или
окси-. Родоначальная структура (главная цепь) выбирается так, чтобы в нее входило максимальное количество карбоксильных и затем гидроксильных групп. Нумерация цепи начинается от углеродного атома карбоксильной группы и ведется таким образом, чтобы сумма номеров всех заместителей была минимальной. В названии цифрами указывается положение всех замес-
тителей и функциональных групп. Одинаковые заместители называют один раз, но с соответствующей цифровой приставкой: ди – 2, три -3, тетра- 4 и
т.д.
Для оксикислот распространена радикально-функциональная номенклатура.
Предварительно атомы углерода, следующие за карбоксильной группой ну-
меруют буквами греческого алфавита. Основу названия составляет тривиаль-
ное название соответствующей кислоты, а положение гидроксильных групп указывается приставкой гидроксиили окси- и буквой греческого алфавита того углеродного атома с которым она связана.
Тривиальная(историческая) номенклатура оксикислот очень распространена.
5
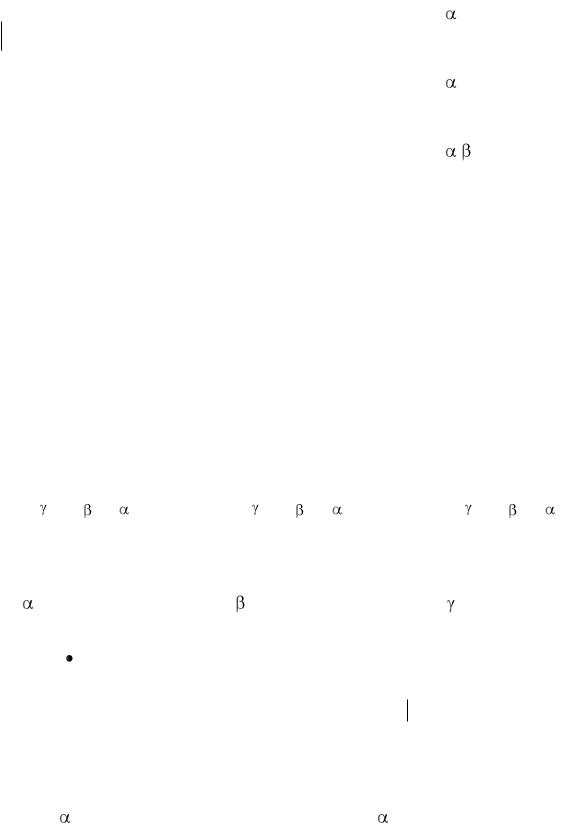
Таблица. Номенклатура гидроксикислот.
Формула |
|
|
|
|
|
|
|
|
|
|
|
Название по номенклатуре |
|
|||||||||||||||
кислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ИЮПАК |
радикально- |
|
триви- |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
заместитель- |
аль-ной |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ной |
|
|
CH2 |
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
2-гидроксиэтановая |
-окси- |
|
гликоле- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
уксусная |
|
вая |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H3C |
|
|
|
|
|
|
CH |
|
|
|
COOH |
2-гидрокси- |
-окси- |
|
молочная |
|||||||||||||
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пропановая |
пропионовая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
HOOC |
|
|
|
|
CH |
|
|
|
|
CH |
|
COOH |
2,3-дигидрокси- |
, -диокси- |
|
винная |
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бутандиовая |
янтарная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
3-гидрокси- |
- |
|
лимонная |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3-карбокси- |
|
|
|
HOOC |
|
|
|
|
CH2 |
|
|
|
C |
|
|
|
CH2 |
|
COOH |
пентандиовая |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изомерия.
Для оксикислот характерна структурная и пространственная изомерия.
Виды структурной изомерии:
 Изомерия положения гидроксильных групп
Изомерия положения гидроксильных групп
H3C |
|
CH2 |
|
|
CH |
|
COOH |
H3C |
|
|
CH |
|
CH2 |
|
|
COOH |
H2C |
|
CH2 |
|
CH2 |
|
COOH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
OH |
|
|
|
|
OH |
|||||||||||||||||||
-оксимасляная кислота |
-оксимасляная кислота |
-оксимасляная кислота |
||||||||||||||||||||||||||||||
|
|
Изомерия углеродного скелета |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
CH2 |
|
|
CH |
|
COOH |
|
|
|
H3C |
|
|
C |
|
COOH |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
-оксимасляная кислота |
|
|
|
|
|
|
-оксиизомасляная кислота |
||||||||||||||||||||||||
6
 Межклассовая изомерия Спирты изомерны простым эфирам, а карбоновые кислоты сложным
Межклассовая изомерия Спирты изомерны простым эфирам, а карбоновые кислоты сложным
эфирам. Можно привести примеры нескольких изомеров общей формулы С4Н8О3
4 |
3 |
2 |
1 |
O |
3 |
2 |
|
1 |
O |
3 |
2 |
1 |
O |
|||||||||
|
|
|
|
|||||||||||||||||||
H3C |
|
CH2 |
|
|
CH |
|
C |
OH |
CH3 |
|
|
CH |
|
C |
OH |
CH3 |
|
|
CH |
|
C |
OCH3 |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
OH |
|
|
|
|
|
OCH3 |
|
|
|
|
OH |
|
|
|
||||
2-гидроксибутановая ки- |
2-метоксипропановая |
метиловый эфир |
||||||||||||||||||||
слота |
|
|
|
|
|
|
|
кислота |
|
|
пропановой кислоты |
|||||||||||
Пространственная изомерия:
В ряду оксикарбоновых кислот важнейшим видом пространственной изомерии является оптическая изомерия. Она связана с наличием в молеку-
лах одного или нескольких асимметрических(хиральных) атомов углерода. В
ряду одноосновных двухатомных кислот атом углерода с четырьмя различ-
ными заместителями (хиральный) появляется в молочной кислоте, следова-
тельно, имеются оптические изомеры.
|
COOH |
|
|
COOH |
||||
H |
|
|
OH |
HO |
|
|
|
H |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
||||
D(–) – молочная |
L(+) – молочная |
|||||||
кислота |
кислота |
|
|
|
||||
Буквами D,L- обозначают относительную конфигурацию оптических изомеров. Таким способом определяют строение ассиметрического атома по сравнению со строением стандартного вещества. Стандартом в ряду окси-
кислот принимаются изомеры молочной кислоты. К D-ряду относится изо-
мер, в котором гидроксогруппа в формуле Фишера расположена справа от главной цепи, к L-ряду - гидроксогруппа слева.
7

Оптические изомеры обладают свойством оптической активности
(способность отклонять плоскость поляризации плоско поляризованного мо-
нохроматического света на определенный угол). Один изомер отклоняет плоскость поляризации по часовой стрелке (вправо) - это правовращающий изомер, его обозначают знаком «+». Второй изомер – левовращающий, обо-
значают знаком «–». Знак вращения плоскости поляризации света нельзя свя-
зывать с отнесением соединений к D – и L – рядам, его определяют только экспериментально прибором - поляриметром.
Число оптических изомеров определяется по формуле : N = 2n, где N-
число оптических изомеров, n- число хиральных атомов углерода.
Винная кислота имеет два ассиметрических атома углерода, по форму-
ле предсказывается наличие четырех оптических изомеров. Однако, изомеров существует только три: из них два оптически активных и одиннеактивная мезоформа. Мезоформа появляется при наличии в молекуле двух одинаковых ассиметрических атомов, между которыми создается плоскость симметрии.
|
|
COOH |
|
COOH |
|
COOH |
|||||||
H |
|
|
OH |
HO |
|
|
|
H |
H |
|
|
OH плоскость |
|
|
|
|
|
|
|
||||||||
HO |
|
|
|
H |
|
|
|
|
|
|
|
|
симметрии |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
H |
|
|
|
OH |
H |
|
|
OH |
||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
COOH |
|
COOH |
|||||||
D(+) – винная |
L(–) – винная |
|
мезовинная кислота |
||||||||||
|
|
кислота |
|
кислота |
|
|
|
|
|||||
Для оксикислот с двумя ассиметрическими атомами углерода опреде-
ление принадлежности к D,L – ряду затруднено. По договоренности опреде-
ляют принадлежность D либо L – ряду по расположению заместителей у ближнего к старшей функциональной группе хирального атома в сравнении с веществом-стандартом.
8

Химические свойства.
Наличие в молекуле двух типов функциональных групп приводит к тому,
что эти соединения проявляют характерные свойства карбоновых кислот и одновременно спиртов. За счет взаимного влияния групп происходит уси-
ление реакционной способности каждой из них. Кроме того, для оксикис-
лот возможны специфические реакции с участием обеих групп.
|
- I COOH |
|
|
|
|
O |
|||
R |
|
CH |
|
|
C |
||||
|
|
||||||||
O H
H
OH
-I OH
I. Реакции по карбоксильной группе.
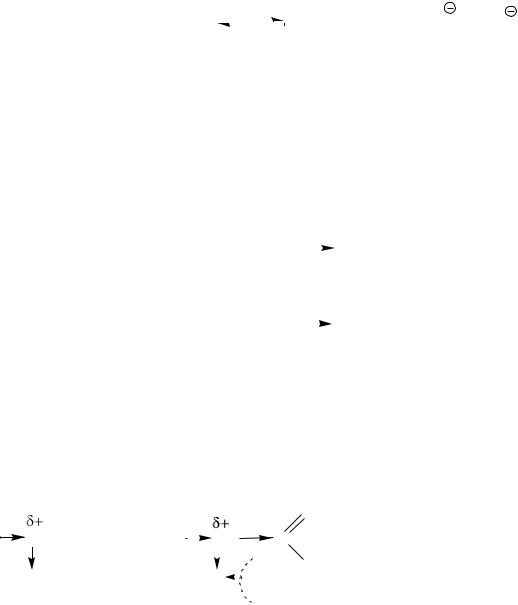
 Кислотные свойства Оксикислоты являются более сильными кислотами, чем соответствующие
Кислотные свойства Оксикислоты являются более сильными кислотами, чем соответствующие
им карбоновые кислоты. Это объясняется акцепторным влиянием гидро-
ксильной группы на карбоксильную. Например, -оксиуксусная кислотата
(гликолевая) в 5 раз сильнее уксусной кислоты. Гидроксильная группа за счет отрицательного индуктивного эффекта притягивает к себе электрон-
ную плотность ближайших углеродных атомов, тем самым увеличивает недостаток электронов на карбоксильном атоме углерода и облегчает дис-
социацию группы ОН.
|
O |
|
O |
H3C |
C |
CH2 |
C |
2 |
1 |
2 |
1 |
|
OH |
|
O H |
|
|
|
OH
- Iэф , ЭА
уксусная кислота |
-оксиуксусная кислота |
9
Оксикислоты в растворах диссоциируют по карбоксильной группе:
H3C |
|
CH |
|
COOH |
|
|
|
H C |
|
CH |
|
COO + H |
||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
OH |
||||
молочная кислота |
|
|
|
|
лактат-анион |
|||||||||
Соли образуются с активными металлами, основными оксидами, осно-
ваниями, солями более слабых кислот:
|
|
|
|
|
недостаток |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
+ NaOH |
|
|
|
H3C |
|
|
|
CH |
|
|
|
COONa + H2O |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H3C |
|
CH |
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
OH |
|
COONa + 2H2O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
+ 2NaOH |
|
|
H3C |
|
|
CH |
|
|
|||||
|
|
OH |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
избыток |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
ONa |
|
|
||||
Кислотные свойства гидроксильной группы по сравнению с соответст-
вующими спиртами усиливаются из-за акцепторного влияния карбоксильной группы.
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
H3C |
CH2 |
H3C |
|
|
|
CH |
|
C |
|||||
|
|
|
|||||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
OH |
|||||||||||||
|
|
|
|
|
|||||||||
|
|
|
O |
|
|
H - Iэф , ЭА |
|||||||
|
|
|
|
|
|||||||||
этанол |
молочная кислота («кар- |
||||||||||||
|
|
боксиэтанол») |
|||||||||||
Вследствие чего с избытком основания соли образуются и по спирто-
вой группе, что для одноатомных спиртов не характерно.
Двухосновные кислоты образуют два ряда солей - средние и кислые.
Кислые соли, как правило, мало растворимы в воде, средние – хорошо рас-
творимы. Это используют для обнаружения ионов калия в фармации и в ана-
литической химии:
10
