
Posob.GFS
.pdf
Изомерия.
Изомерия фенолокислот обусловлена взаимным расположением гидро-
ксильной (–ОН) и карбоксильной ( –СООН) групп.
COOH |
COOH |
COOH |
OH
OH
о-гидроксибензойная м-гидроксибензойная
OH
п-гидроксибензойная
Химические свойства.
I.Реакции по карбоксильной группе.
Фенолокислоты проявляют свойства и фенолов и кислот.
 Кислотные свойства Фенолокислоты являются сильными кислотами. Сила кислоты возрастает
Кислотные свойства Фенолокислоты являются сильными кислотами. Сила кислоты возрастает
при образовании внутримолекулярной водородной связи, это способствует диссоциации карбоксильной группы в растворе:
|
H |
|
H |
|
O |
O |
|
||
O |
O |
|||
|
|
|||
|
C |
|
C |
|
|
O |
H |
||
|
O |
|||
|
|
|
+ H
По этой причине салициловая кислотой обладает более кислотными свойст-
вами, чем ее мета- и пара-изомеры.
OH |
O |
OH |
O |
ONa |
O |
|
C |
|
C |
|
C |
|
OH |
NaOH |
|
ONa NaOH |
ONa |
|
|
- H2O |
|
- H2O |
|
Салициловая кислота более сильная чем угольная, вытесняет ее из со-
лей.
21
Для оксикислот характерны типичные реакции нуклеофильного за-
мещения по карбоксильной группе, с образованием сложных эфиров, ангид-
ридов, хлорангидридов, амидов.
|
|
|
OH |
O |
|
|
|
|
C |
OH |
O |
+ CH3OH |
|
|
|
|
|
|
|
|
C |
t0, H+ |
|
|
|
|
|
|
|
|
|
OH |
метилсалицилат |
|
|
|
+ |
OH |
O |
|
|
OH |
|
|
|
|
|
|
C |
|
|
t0, H+ |
|
|
O CH3
+ H2O
O
+ H2O
фенил салицилат (салол)
Метилсалицилат представляет собой бесцветную вязкую нераствори-
мую в воде жидкость с приятным запахом, используется в медицине в каче-
стве противоревматического средства.
Салол применяется как дезинфицирующее средство при кишечных за-
болеваниях. Однако в кислой среде желудка он не гидролизуется, а распада-
ется только в кишечнике, поэтому используется также в качестве материала для защитных оболочек некоторых лекарственных средств, которые не ста-
бильны в кислой среде желудка.
Под действием пентахлорида фосфора на хлор замещается только гид-
роксильная группа в составе карбоксильной группы, фенольный гидроксил устойчив к реакциям нуклеофильного замещения.
OH |
O |
OH |
O |
|
C |
|
C |
|
OH |
+ PCl5 |
Cl |
|
|
|
|
|
|
- HCl - POCl3 |
|
|
|
хлорангидрид |
|
|
|
салициловой кислоты |
|
22
При нагревании салициловой кислоты с аммиаком образуется ее амид:
OH |
O |
|
OH |
O |
|
|
C |
|
|
C |
|
|
OH |
t0 |
|
NH2 |
+ H2O |
|
|
+ NH3 |
|
|
амид салициловой кислоты
II. Реакции по гидроксильной группе.
Аналогично спиртам и фенолам салициловая кислота образует по гид-
роксильной группе простые и сложные эфиры.
Реакция алкилирования, приводит к образованию простого эфира:
COOH |
|
|
|
COOH |
||||||||||
|
|
O |
|
H |
|
|
|
|
|
O |
|
CH3 |
||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
+ I |
|
CH3 |
|
|
|
|
|
|
|
+ HI |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
||||||||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реакция ацилирования, идет с образованием сложного эфира:
COOH |
|
|
|
|
COOH |
|
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
H |
Cl |
|
|
|
|
|
|
O |
|
C |
||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H C |
|
C |
|
|
|
|
|
|
|
|
|
CH3 + HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетилсалициловая кислота |
|||||
|
|
|
|
|
|
|
|
|
|
|
(аспирин) |
|
|
|
||
Ацетилсалициловая кислота как сложный эфир способна гидролизо-
ваться в кислой и щелочной средах.
Поэтому следует учитывать условия хранения, которые должны ис-
ключать ее контакт с влагой. При взаимодействии салициловой кислоты с хлоридом железа (III) (FеС13) дают фиолетовую окраску, то есть подтвержда-
ется наличие фенольного гидроксила. Ацетилсалициловая кислота, у которой нет свободного фенольного гидроксила, такую реакцию не дает. Это разли-
чие используется при определении доброкачественности аспирина.
23
Ацетилсалициловая кислота (аспирин) и другие производные кислоты
– фенилсалицилат (салол), салицилат натрия широко используются в качест-
ве противовоспалительных средств и анальгетиков.
III. Реакции по бензольному кольцу
Фенолокислоты вступают в типичные реакции электрофильного заме-
щения (SЕ) по бензольному кольцу. Действие двух функциональных групп на бензольное кольцо согласованное.
При бромировании, нитрировании, сульфировании салициловой кисло-
ты заместители поступают в орто- и параположения по отношению к гидро-
ксильной группе и в метаположение по отношению к карбоксильной груп-
пе:
ЭД |
ЭА |
|
|
- I , + M |
- I , - M |
|
|
OH |
O |
|
OH |
|
|
||
|
|
|
|
|
C |
Br |
COOH |
|
|
|
|
|
OH |
|
|
|
|
+ 2 Br2 |
+ 2HBr |
Br
IV. Специфические реакции.
Фенолкислоты сравнительно легко декарбоксилируются:
 COOH
COOH
OH |
|
|
|
|
OH |
|
|
|
t0 |
|
|
+ CO2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дубильные вещества, содержащиеся в значительных количествах в растени-
ях, включают в свой состав остатки галловой (3, 4, 5-тригидроксибензойной)
24
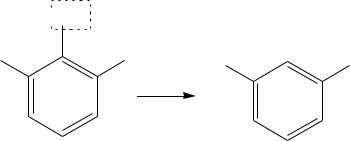
кислоты. Галловая кислота также легко декарбоксилируется с образованием трехатомного фенола пирогаллола.
 COOH
COOH
HO |
OH |
HO |
OH |
|
|
t0
+ CO2
|
|
|
|
|
|
|
|
|
|
OH |
|
|
||
OH |
||||
|
|
|||
Галловая кислота |
Пирогаллол |
|||
За счет гидроксильных групп галловая кислота проявляет антисептическое свойство, применяется как кровеостанавливающее средство, при ожогах для образования защитной бактерицидной пленки, реактив на алкалоиды, проти-
воядие при отравлении алкалоидами, для синтеза красителей.
Оксокислоты.
Это гетерофункциональные органические вещества, содержащие одно-
временно одну или несколько карбоксильных групп (–СООН) и карбониль-
ную группу (С=О). Количество карбоксильных групп (–СООН) определяет основность оксокислоты. По типу карбонильной группы выделяют альдеги-
доили кетокарбоновые кислоты. Многие оксокислоты являются естествен-
ными продуктами обмена веществ.
Номенклатура.
По международной номенклатуре ИЮПАК в составе молекулы выделяют функциональные группы и определяют их старшинство. Карбоксильная группа старше карбонильной, следовательно, определяет окончание назва-
ния, а младшая карбонильная группа указывается приставкой оксо-. Родона-
чальная структура (главная цепь) выбирается так, чтобы в нее входило мак-
симальное количество карбоксильных и карбонильная группа. Нумерация цепи начинается от углеродного атома карбоксильной группы и ведется та-
ким образом, чтобы сумма номеров всех заместителей была минимальной. В
25
названии цифрами указывается положение всех заместителей и функцио- |
|||||
нальных групп. Одинаковые заместители называют один раз, но с соответст- |
|||||
вующей цифровой приставкой: ди – 2, три -3, тетра- 4 и т.д. |
|
||||
Для оксокислот распространена радикально-функциональная номенклатура. |
|||||
Предварительно атомы углерода, следующие за карбоксильной группой, ну- |
|||||
меруют буквами греческого алфавита. Основу названия составляет тривиаль- |
|||||
ное название соответствующей кислоты, а положение карбонильной группы |
|||||
указывается приставкой оксо- и буквой греческого алфавита того углеродно- |
|||||
го атома, с которым она связана. |
|
|
|||
Тривиальная(историческая) номенклатура оксокислот очень распространена. |
|||||
Таблица. Номенклатура оксокислот. |
|
|
|||
Формула |
|
|
Название |
|
|
кислоты |
|
ИЮПАК |
радикально- |
тривиаль- |
|
|
|
|
|||
|
|
|
|
заместительное |
ное |
O |
|
|
2-оксоэтановая |
-оксоуксусная |
глиокса- |
C |
COOH |
|
|
левая |
|
H |
|
|
|
|
|
H3C |
C |
COOH |
2-оксопропановая |
- |
пировино- |
|
|
|
|
оксопропионовая |
градная |
|
O |
|
|
|
|
H3C |
C |
CH2 COOH |
3-оксобутановая |
-оксомасляная |
ацетоук- |
|
|
|
|
|
сусная |
|
O |
|
|
|
|
HOOC |
C |
CH2 COOH |
2-оксобутандиовая |
α-кетоянтарная |
щавеливо- |
|
|
|
|
|
уксусная |
|
O |
|
|
|
|
HOOC |
C |
CH2 CH2 COOH 2-оксопентандиовая |
α-кетоглутаровая |
|
|
|
O |
|
|
|
|
|
|
|
Изомерия. |
|
|
Для оксикислот характерна структурная и пространственная изомерия. |
|||||
|
Виды структурной изомерии: |
|
|
||
26
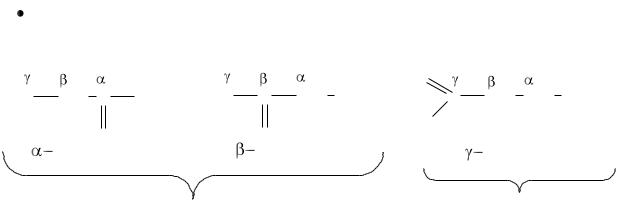
Изомерия положения карбонильной груп-
пы
|
|
O |
H3C CH2 C COOH H3C |
C CH2 COOH |
C CH2 CH2 COOH |
O |
O |
H |
|
||
оксомасляная |
оксомасляная |
оксомасляная |
кетонокислоты |
альдегидокислота |
|
 Изомерия углеродного скелета
Изомерия углеродного скелета
H C |
|
CH |
|
CH |
|
C |
|
COOH |
H3C |
|
CH |
|
C |
|
COOH |
|||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|||||||||||||||||
3 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
O |
|
|
CH3 |
O |
|
|
||||||||
2-оксопентановая кислота |
3-метил-2-оксобутановая кислота |
|||||||||||||||||||
Химические свойства.
Оксокислоты, имея в молекуле карбоксильную и карбонильную груп-
пу, обладают свойствами характерными для кислот и альдегидов (кетонов).
Так же, для них протекают специфические реакции, обусловленные взаим-
ным влиянием функциональных групп.
III.Реакции по карбоксильной группе.
Реакции по карбоксильной группе – смотрите реакции в разделе окси-
кислот. Как и оксикислоты, оксокислоты диссоциируют в водном растворе,
образуют соли, сложные эфиры, ангидриды, хлорангидриды, амиды.
 кислотные свойства
кислотные свойства
Кислотные свойства оксокислот сильнее, чем у карбоновых кислот с той же длинной цепи. Это объясняется акцепторным влиянием карбонильной груп-
пы.
27
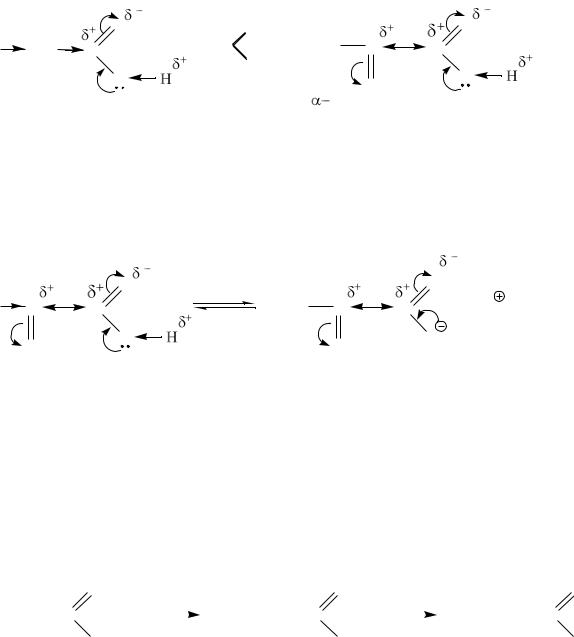
O |
|
O |
H3C CH2 C |
H3C C |
C |
O |
O |
O |
|
|
пропионовая кислота |
кетопропионовая кислота |
|
α-Кетопропионовая кислота (ПВК) в 500 раз сильнее пропионовой кислоты.
Наличие карбонильной группы облегчает диссоциацию карбоксильной груп-
пы в водном растворе:
|
O |
|
|
O |
H3C C |
C |
H3C C |
C |
+ H |
O |
O |
O |
|
O |
|
|
|
 Реакции нуклеофильного замещения гидроксильной группы. Для оксокислот протекают все реакции образования функциональных произ-
Реакции нуклеофильного замещения гидроксильной группы. Для оксокислот протекают все реакции образования функциональных произ-
водных.
Реакция с пентахлоридом фосфора в избытке реагента проходит с участием
одновременно и карбоксильной и карбонильной групп:
|
|
|
|
|
|
|
O |
|
|
|
Cl |
O |
|
|
|
|
Cl |
O |
|||||||
|
|
|
|
|
|
|
PCl5 |
|
|
|
PCl5 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
H3C |
|
C |
|
|
C |
|
|
H3C |
|
C |
|
C |
|
|
|
|
H3C |
|
C |
|
C |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
- POCl |
|
|
|
- POCl |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
OH |
3 |
|
|
|
|
|
|
OH |
- HCl |
3 |
|
|
|
|
|
|
Cl |
|
|
|
O |
|
|
|
Cl |
|
|
|
Cl |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
IV. Реакции по карбонильной группе.
По карбонильной группе идут все характерные реакции альдегидов и кетонов.
 Реакции нуклеофильного присоединения (АN) с водородом, си-
Реакции нуклеофильного присоединения (АN) с водородом, си-
нильной кислотой, спиртами.
28

|
|
|
|
|
|
|
|
|
|
|
O |
|
|
t0 , Ni |
|
|
|
|
|
|
|
|
|
|
|
O |
H3C |
|
|
C |
|
|
|
|
C |
|
+ H2 |
|
|
H C |
|
|
CH |
|
|
C |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
O |
|
|
|
|
|
|
|
OH |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
CN |
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
t0 , Ni |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
C |
|
|
|
C |
|
+ HCN |
|
H3C |
|
|
C |
|
|
|
|
C |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
OH |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
Реакции |
нуклеофильного |
замещения |
(SN) с пентахлоридом |
|||||||||||||||
фосфора (смотри выше), азотистыми нуклеофилами (гидразином, фенилгид-
разином, гидроксиламином, аминами).
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
t0 |
|
|
|
|
|
|
|
|
O |
|||||||||
|
|
|
|
|
|
|
|
|
|
+ NH2 |
|
|
NH2 |
|
|
|
|
|
|
|
|
|
+ H2O |
|||||||||
H3C |
|
|
C |
|
|
|
C |
|
|
|
|
|
H3C |
|
|
|
|
|
|
C |
|
|
C |
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
OH |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
O |
|
|
|
|
|
H2N |
|
|
|
|
N |
||||||||||||||||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
t0 |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
+ NH2 |
|
|
OH |
|
|
|
|
|
|
|
|
|
+ H2O |
|||||||||
H3C |
|
C |
|
|
C |
|
|
|
|
|
H3C |
|
|
|
C |
|
C |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||
|
|
|
|
O |
|
|
|
|
|
HO |
|
|
|
N |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Реакции протекают легче, чем для обычных кетонов, так как карбок-
сильная группа проявляет акцепторные свойства и увеличивает частичный положительный заряд на карбонильном атоме углерода.
III. Специфические реакции.
 Реакции декарбоксилирования.
Реакции декарбоксилирования.
Наличие карбонильной группы, ее акцепторное влияние так же объясняет способность кетокислот к реакции декарбоксилирования. Пировиноградная кислота при нагревании или действии фермента декарбоксилазы легко раз-
лагается:
|
|
|
|
|
|
|
t0 |
|||||||
H3C |
|
C |
|
|
COOH |
|
H3C |
|
C |
|
|
H + CO2 |
||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
O |
||||||
29

Ацетоуксусная кислота легко декарбоксилируется как и все -
кетокислоты даже при слабом нагревании:
|
|
|
|
|
|
|
|
|
t0 |
|||||||
H3C |
|
C |
|
|
CH2 |
|
COOH |
|
H3C |
|
C |
|
|
CH3 + CO2 |
||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
O |
|
|
|
O |
||||||||||
 Кето-енольная таутомерия
Кето-енольная таутомерия
Явление существования вещества в виде нескольких изомерных форм, легко переходящих друг в друга и находящихся в подвижном равновесии, называ-
ется таутомерией.
В зависимости от возникающих групп таутомерия называется по-разному:
кето-енольная, лактим-лактамная.
Для оксокислот характерно существование двух изомерных форм в раство-
рах: кетонной и енольной, легко переходящих друг в друга и находящихся в динамическом равновесии.
Кето-енольная таутомерия встречается и в обычных альдегидах и кето-
нах, однако енольной формы содержится в таких системах очень мало (около
0,00025%), то есть равновесие практически сдвинуто в сторону кетонной формы:
H3C |
|
C |
|
|
CH3 |
|
|
|
H3C |
|
C |
|
CH |
||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
OH |
|||||
Введение электронакцепторного заместителя у енолизированного ато-
ма углерода, например, карбоксильной группы (–СООН) в молекулах β- ок-
сокислот, смещает равновесие в сторону енола:
H |
O |
|
O |
|
|
||
CH3 C C C |
|
H3C C CH C |
|
O H |
OH |
O H |
OH |
|
|||
|
|
30
