
PosobieTEOR.OSN.ORG.KHIM
.pdf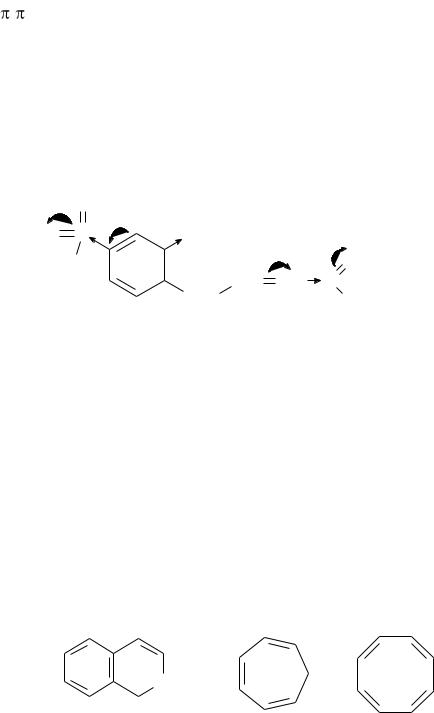
стой связью ( , -сопряжение). Но между собой эти два сопряженных фрагмента
молекулы не взаимодействуют, так как разделены двумя простыми связями.
II.Укажите электронные эффекты для всех функциональных групп, их электронодонорные и электроноакцепторные свойства:
-I, - M
O |
- I |
|
|
|
|
||
O S |
OH |
- I, - M |
|
HO |
|
O |
|
CH |
CH C |
||
|
|||
|
CH2 |
H |
В данном соединении альдегидная группа и сульфогруппа проявляют от-
рицательный мезомерный и отрицательный индукционный эффекты. Следова-
тельно, они являются электроноакцепторными заместителями. Гидроксильная группа не участвует в образовании сопряженной системы и проявляет только от-
рицательный индукционный эффект. Поэтому она также является электроноак-
цептором.
III.Какие из приведенных соединений являются ароматическими? Дай-
те объяснения.
а) |
б) |
в) |
 N
N
Для каждого соединения проверим, выполняются ли критерии ароматич-
ности.
а) Система циклическая, плоская, т.к. все атомы обоих циклов находятся в состоянии sp2 – гибридизации. В образовании сопряженной системы принимают участие 10 электронов, что соответствует формуле Хюккеля (4n + 2 = 10) для n = 2. Сопряженная система делокализована по всей молекуле. Следовательно, со-
единение ароматическое.
51
б) Система циклическая, плоская, содержит сопряженную систему из 3-х
двойных связей. Эта система содержит 6 π- электронов, что соответствует фор-
муле Хюккеля (4n+2) для n=1. Однако в данном случае в образовании сопряжен-
ной системы принимают участие не все атомы цикла – один из атомов является насыщенным и находится в состоянии sp3-гибридизации. Следовательно, данное соединение не является ароматическим.
в) Система циклическая, неплоская, все атомы цикла находятся в sp2 – гиб-
ридном состоянии. В состав молекулы входят 8 π-электронов, что не соответст-
вует формуле Хюккеля (4n + 2) ни одного из натуральных чисел. Следовательно,
соединение не является ароматическим.
Вопросы для самоконтроля:
1. Что такое субстрат и реагент?
1.Какие способы разрыва ковалентной связи вам известны? Чем они разли-
чаются?
2.Дайте определения понятиям: электрофил, нуклеофил, свободный радикал.
3.По каким признакам классифицируются органические реакции? Приведите примеры различных типов органических реакций.
4.Что такое сопряженные системы? Какие виды сопряжения вы знаете? При-
ведите примеры.
5.Что такое ароматичность? Каковы условия ароматичности?
6.Примеры ароматических систем.
7.Что такое положительный индуктивный эффект? Приведите примеры.
8.Что такое отрицательный индуктивный эффект? Приведите примеры.
9.Что такое положительный мезомерный эффект? Приведите примеры.
10.Что такое отрицательный мезомерный эффект? Приведите примеры.
11.Какие заместители называют электронодонорными и электроноакцептор-
ными? Приведите примеры.
12. Приведите примеры ориентантов I и II рода. Какое влияние оказывают
они на протекание реакций электрофильного замещения?
52
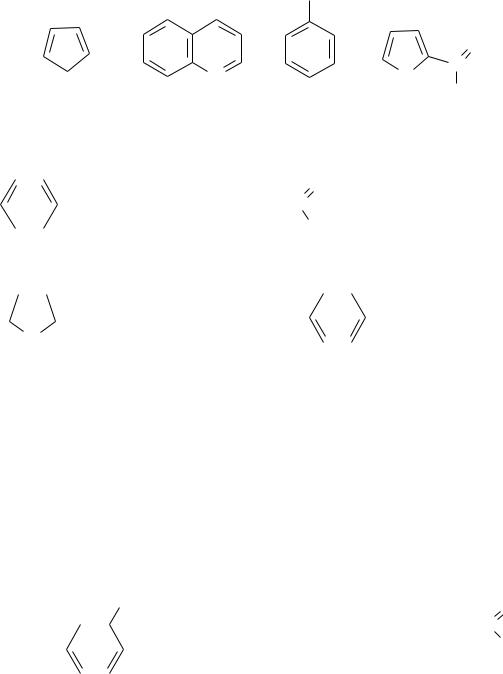
13. Что такое согласованная и несогласованная ориентация? Приведите при-
меры.
Упражнения для самостоятельной работы студентов
1.Укажите, какие из ниже приведенных соединений являются ароматиче-
скими? Дайте пояснения.
|
|
|
OH |
|
|
а) |
б) |
в) |
г) |
|
O |
|
N |
|
|
O |
C |
|
|
|
|
||
|
|
|
|
|
H |
2.В каких случаях имеет образование сопряженной системы? Укажите тип сопряжения:
а) |
|
|
|
|
|
|
|
|
в) |
|
O |
|
|
|
|||||||||
|
|
|
|
|
|
CH2 |
|
OH |
CH3 |
|
C |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
б) |
|
|
|
|
г) |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
HOOC |
|
|
|
|
|
|
|
CH2 |
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
N |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
H |
|
|
|
|
|
|
|
|
|||||
3.В приведенных ниже соединениях укажите электронные эффекты для всех функциональных групп, их донорные или акцепторные свойства:
а) HOOC |
|
|
|
CH |
|
CH |
|
COOH |
в) |
CH3 |
|
|
|
CH |
|
CN |
|||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
OH OH |
|
|
|
|
|
CH3 |
|
|
|
|
||||||||||||
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) |
|
|
|
|
|
|
|
|
г) |
HS |
|
|
CH2 |
|
|
CH2 |
|
C |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
CH2 |
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
53
Рекомендуемая литература:
1.Биоорганическая химия. Учебник. /Тюкавкина Н.А., Бауков Ю.И., С.Э. Зу-
рабян. – М: ГЭОТАР-Медиа, 2012. – 416 стр., ил.
Глава 2, стр. 29-46
2.Биоорганическая химия: руководство к практическим занятиям: учеб. По-
собие для студентов мед. Вузов / по ред. Н.А. Тюкавкина – М.: ГЭОТАР-
Медиа, 2010. – 168 с.
3.Химия: учебник.-2-ое изд., испр. и доп./С.А. Пузаков – М: ГЭОТАР - Ме-
диа, 2006.-640 стр.
Глава 6, стр. 69-85
54
4.КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель занятия: сформировать у студентов представление о кислотно-
основных свойствах органических соединений, зависимости этих свойств от строения органических соединений и влиянии кислотно-основных свойств на физико-химические и биологические процессы, протекающие в живых организмах.
Студент должен знать:
- определения кислот и оснований в соответствии с различными теориями
(классической, протолитической теорией Бренстеда - Лоури, электронной тео-
рией Льюиса);
-типы органических кислот и оснований;
-факторы, влияющие на кислотно-основные свойства органических соединений.
Студент должен уметь:
- определять кислотно-основные свойства различных классов органических со-
единений
-сравнивать кислотность и основность моно-, поли- и гетерофункциональных соединений;
-объяснять различия в этих свойствах.
Важными аспектами реакционной способности органических соединений яв-
ляется их кислотные и основные свойства. Существует несколько определений кислот и оснований. Наиболее распространенными являются следующие:
1. Классическое определение:
Кислоты – это электролиты, при диссоциации которых в качестве поло-
жительных ионов образуются только ионы Н+.
55

Основания – это электролиты, при диссоциации которых в качестве отри-
цательно заряженных ионов образуются только ионы ОН−. 2. Определение Бренстеда и Лоури:
Кислоты – это нейтральные молекулы или ионы, способны отдавать про-
тон (доноры протона).
Основания – это нейтральные молекулы или ионы, способные присоеди-
нять протон.
3. Определение Льюиса:
Кислоты – это нейтральные молекулы или ионы, способные присоединить электронную пару (акцепторы электронной пары).
Основания – это нейтральные молекулы или ионы, способные отдавать электронную пару (доноры электронной пары).
Для описания кислотных и основных свойств органических соединений наи-
более часто используют теорию кислот и оснований Бренстеда и Лоури (протоли-
тическую теорию).
Согласно этой теории, любое соединение, в состав которого входит атом во-
дорода, может отдавать его в виде протона и проявлять свойства кислоты. Способ-
ность отдавать протон могут проявлять не только нейтральные молекулы (HCl, ROH), но и заряженные частицы – катионы (NH4+) и анионы кислот (HSO4- и др.).
Например:
CH3COOH  CH3COO + H+
CH3COO + H+
HSO4  SO42 + H+
SO42 + H+
В роли оснований могут выступать анионы – частицы, несущие отрицатель-
ный заряд, например С1−, OH−, HSO4−. Основаниями могут быть и нейтральные молекулы, в состав которых входит атом, имеющий неподелѐнную пару электронов,
например спирты (ROH), амины (RNH2), вода.
56

.. |
|
|
H + H+ |
+ |
|
|||||||||
R |
|
O |
|
|
R |
|
O |
|
|
H |
||||
|
|
|
||||||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
H |
|||||
|
SO42 |
|
|
+ H+ |
|
|
|
|||||||
|
|
|
HSO4 |
|||||||||||
Нейтральные молекулы или ионы, способные в зависимости от природы вто-
рого компонента проявлять свойства кислот или оснований называются амфотер-
ными. Например, вода может быть кислотой, отдавая протон, и основанием, прини-
мая протон:
|
|
.. |
|
|
|
|
H+ + OH |
|
|
|
||||
H |
|
|
O |
|
|
H |
|
|
||||||
|
|
|
|
|||||||||||
|
|
.. |
|
|
H + H+ |
H |
|
O+ |
H |
|||||
H |
|
|
O |
|
|
|
||||||||
|
||||||||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||
Согласно теории Бренстеда – Лоури, кислотность и основность – не абсолют-
ные, а относительные понятия. Кислотные свойства соединение проявляет только в присутствии оснований, а основные – только в присутствии кислот. Таким образом,
кислота и основание образуют сопряжѐнную кислотно – основную пару. Кислота,
отдавая протон, превращается в сопряженное основание (частицу, способную при-
соединить протон), а основание, приняв протон, превращается в сопряженную кислоту(частицу, способную отдать протон). Кислоту обычно обозначают АН, а
основание – В.
|
|
BH+ |
|
|
|
AH |
+ B |
+ A |
|||
кислота |
основа- |
сопря- |
сопря- |
||
|
ние |
женная |
женное |
||
|
|
кислота |
основа- |
||
|
|
|
ние |
||
Например:
CH3COOH + H2O  CH3COO + H3O+
CH3COO + H3O+
57

где CH3COOH – кислота, H2O – основание, Н3О+ - сопряженная кислота,
СH3COO− – сопряженное основание.
Чем сильнее кислота, тем слабее сопряженное основание, и наоборот.
Количественно силу кислот оценивают величиной константы кислотности
(Ka). Например, для приведенной выше реакции константа равновесия будет иметь следующий вид:
K =
[H3O+] [CH3COO ]
[CH3COOH] [H2O]
Так как концентрация воды является практически постоянной, предыдущее уравнение можно преобразовать, умножив и левую, и правую части на [H2O].
Полученная величина и называется константой кислотности:
|
[H O+] [CH COO |
|
] |
||
|
|
||||
Ka = K [H2O] = |
3 |
3 |
|
|
|
|
|
[CH3COOH] |
|||
|
|
|
|||
Чем больше константа кислотности, тем сильнее кислота.
Для характеристики кислотных свойств соединения используют также по-
казатель константы кислотности (pKa), который представляет собой отрицатель-
ный десятичный логарифм константы кислотности: pKa = − lg Ka
Чем меньше значение pKa , тем сильнее кислота.
4.1. Кислотность органических соединений
В органических соединениях в зависимости от природы элемента, с кото-
рым связан протон, различают следующие кислоты:
SH – кислоты (тиолы),
ОН – кислоты (карбоновые кислоты, фенолы, спирты),
NH – кислоты (амины, амиды, имиды),
СН – кислоты (углеводороды и их производные).
Кислотным центром называется соответствующий элемент и связанный с ним атом водорода.
58

На силу органических кислот влияют следующие факторы:
1.Природа гетероатома в кислотном центре.
2.Стабильность образующегося аниона – сопряженного основания.
3.Строение радикала, связанного с кислотным центром.
4.Способность анионов к сольватации.
1. Зависимость кислотности от природы гетероатома.
На кислотность соединений влияют такие свойства атомов, как электроот-
рицательность и поляризуемость. Чем больше электроотрицательность атома в кислотном центре, тем выше кислотность соединения. Поэтому, например, ки-
слотные свойства спиртов сильнее, чем кислотные свойства аминов:
CH3 CH2 OH  CH3 CH2 NH2
CH3 CH2 NH2
Однако это справедливо только при сравнении элементов, находящихся в одном периоде. Для элементов, находящихся в одной группе, кислотные свойства зави-
сят от поляризуемости. Чем больше поляризуемость атома кислотного центра,
тем выше кислотность соединения. Поляризуемость в свою очередь зависит от радиуса атома – чем больше радиус атома, тем сильнее поляризуемость. Напри-
мер, тиолы являются более сильными кислотами, чем спирты:
CH3 CH2 SH  CH3 CH2 OH
CH3 CH2 OH
Это связано с тем, что поляризуемость атома серы больше, чем атома кислорода.
2. Зависимость кислотности от стабильности аниона - сопряженного
основания.
Чем стабильнее анион (сопряженное основание), который образуется при отрыве H+ от молекулы кислоты, тем выше кислотность соединения. Стабиль-
ность аниона определяется степенью делокализации образующегося отрицатель-
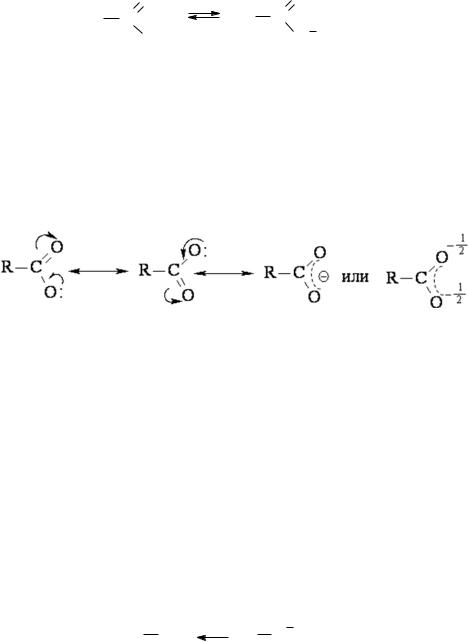
ного заряда. Например, при отрыве протона от молекулы карбоновой кислоты,
образуется стабильный карбоксилат-анион:
59
O |
|
O |
R C |
R C |
+ H+ |
OH |
|
O |
Стабильность данного аниона обеспечивается высокой степенью делока-
лизации заряда. Электроны, оставшиеся у атома кислорода после отрыва Н+,
участвуют в сопряжении с электронами π-связи С=О, при этом электронная плотность равномерно распределяется всем трем атомам бывшей карбоксильной группы:
Стабильный анион с делокализованным зарядом образуется легко, т.е. ки-
слота легко отдает протон. Поэтому карбоновые кислоты проявляют ярко выра-
женные кислотные свойства: в водных растворах диссоциируют, окрашивают индикаторы в соответствующий цвет и т. д.
В отличие от карбоновых кислот, спирты проявляют очень слабые кислот-
ные свойства – они являются более слабыми кислотами, чем вода. Это объясня-
ется тем, что при отрыве протона от гидроксильной группы спирта образуется неустойчивый алкоголят-анион:
R OH  R O + H+
R O + H+
Неустойчивость алкоголят-аниона обусловлена невозможностью делока-
лизации заряда, который полностью сосредоточен на атоме кислорода.
3. Зависимость кислотности от строения радикала, связанного с ки-
слотным центром.
На кислотные свойства соединения существенное влияние оказывает природа заместителей, связанных с кислотным центром. Электронодонорные заместители понижают кислотность соединения, а электроноакцепторные за-
местители повышают ее.
60
