
PosobieTEOR.OSN.ORG.KHIM
.pdf
щей неподеленную электронную пару. В результате образуется единое элек-
тронное облако, включающее и электроны π-связи, и электроны свободной элек-
тронной пары хлора.
Примером сопряженной системы с замкнутой цепью сопряжения является
бензол.
H  H
H
C C
H C 
 C H
C H
C C
H 
 H
H
В молекуле бензола все атомы углерода находятся в состоянии sp2-
гибридизации. За счет гибридных орбиталей атомы углерода образуют связи друг с другом и с атомами водорода. Так как все гибридные орбитали лежат в одной плоскости, молекула бензола является плоской. У каждого атома углерода остается по одной негибридизованной p-орбитали. Эти орбитали располагаются перпендикулярно плоскости молекулы и параллельно друг другу. Негибридизо-
ванные p-орбитали перекрываются своими боками над и под плоскостью моле-
кулы, причем каждая орбиталь перекрывается с двумя соседними. В результате образуется единое электронное облако, делокализованное (равномерно распре-
деленное) по всему кольцу и включающее 6 π-электронов. При этом выделяется большое количество энергии, что делает бензол термодинамически очень ста-
бильным. Образование сопряженной системы приводит к полному выравнива-
нию длин углерод-углеродных связей, которые в бензоле равны 0,139 нм.
Строение бензола определяет его свойства – высокую устойчивость к дей-
ствию окислителей, склонность к реакциям замещения (в которых сопряженная система сохраняется) и затруднения при протекании реакций присоединения ( в
которых сопряженная система разрушается).
Совокупность свойств бензола, обусловленную его строением, принято на-
зывать ароматичностью. Голландский ученый Э. Хюккель сформулировал кри-
терии ароматичности, получившие название «правило Хюккеля». Согласно
41
этому правилу, ароматические соединения должны быть плоскими, цикли-
ческими, содержать сопряженную систему, делокализованную по всему циклу и включающую 4n + 2 р- или π-электрона (где n – натуральное число, т.
е. 0, 1, 2, 3 и т. д.)
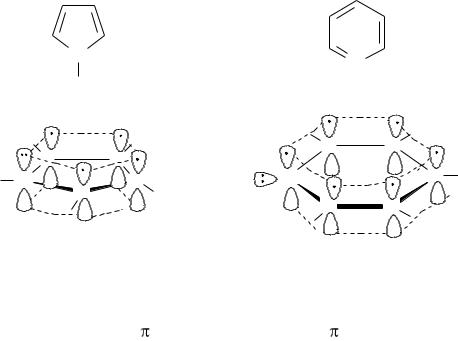
Ароматическими могут быть не только карбоциклические, но и гетероцик-
лические соединения. Например, к ароматическим гетероциклическим соедине-
ниям относятся пиррол и пиридин.
|
N |
|
|
|
N |
|
|
|
|
|
|
|
H |
|
|
|
|
H |
|
H |
|
H |
H |
|
|
C |
C |
||
.. C |
|
C |
|
||
|
|
. N |
C H |
||
H N |
C |
C |
H |
||
|
|
C |
C H |
||
|
|
|
|||
|
H |
|
|
||
|
|
|
|
H |
|
пиррол |
|
|
пиридин |
||
У пиррола, в отличие от бензола и пиридина, в образовании ароматической |
|||||
системы участвуют не только |
-, но и р-электроны (4 |
- и 2 р-электрона). |
|||
3.3. Взаимное влияние атомов в молекуле
В химическую реакцию молекула органического соединения вступает не целиком, с реагентом взаимодействует только определенная часть молекулы. Эта часть молекулы называется реакционным центром. Наличие в молекуле реак-
ционных центров и их природа зависит от распределения электронной плотности в молекуле. Распределение электронной плотности в молекуле определяется вза-
имным влиянием атомов. Способы передачи взаимного влияния атомов могут быть различными, в органической химии их называют электронными эффек-
42

тами. Наиболее распространены и наиболее изучены два электронных эффекта:
индукционный (индуктивный) эффект и мезомерный эффект.
Индукционный или индуктивный эффект (Iэф) - это смещение электрон-
ной плотности по -связям или изолированным -связям. Это смещение вызвано различием в электроотрицательности атомов, образующих связь, или наличием на них полных или частичных зарядов.
Индукционный эффект может быть положительным (+I) или отрицатель-
ным (− I). Отрицательный индукционный эффект проявляют атомы или группы атомов, которые притягивают к себе электронную плотность, понижая ее на ато-
ме углерода. К таким заместителям относятся атомы с большей, чем у атома уг-
лерода, электроотрицательностью, а также заместители, атомы которых имеют полный или частичный положительный заряд:
|
|
|
|
|
|
|
δ - |
δ - |
|
||
|
|
+ |
O |
δ+ |
O δ+ |
O |
δ+ |
δ - |
|||
- OR, |
- NR , - F, - Cl, - Br, - I, - SO H, - N |
|
|
- C |
- C |
|
- C |
|
N и т. д. |
||
|
|
|
|
||||||||
|
|
|
|
||||||||
2 |
3 |
|
|
, |
|
R , |
OR , |
|
|||
|
|
|
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|||
Графически индукционный эффект изображают прямой стрелкой на месте соответствующей ζ-связи и направленной к тому атому, к которому смещаются электроны. Например, в молекуле хлорметана хлор проявляет отрицательный электронный эффект:
H
H Cδ+ Clδ - H
Чем больше электроотрицательность атома, тем сильнее проявляемый им отрицательный индукционный эффект. Так, гидроксильная группа (ОН) прояв-
ляет больший отрицательный индукционный эффект, чем аминогруппа (NH2), а
в ряду галогенов сила отрицательного индукционного эффекта уменьшается от фтора к йоду. Заместитель, имеющий полный положительный заряд, проявляет более сильный отрицательный индукционный эффект, чем незаряженный. На-
пример, аммониевая группа ( - NH3+) проявляет более сильный отрицательный
43
индукционный эффект, чем незаряженная аминогруппа ( - NH2). Чем больше частичный положительный заряд на атоме углерода заместителя, тем сильнее проявляемый отрицательный индукционный эффект. Так, карбонильная группа проявляет больший отрицательный индукционный эффект, чем карбоксильная,
поскольку δ+ на атоме углерода карбонильной группы больше, чем в карбок-
сильной.
|
Oδ - |
|
δ - |
δ+ |
δ+ |
O |
|
- C |
- C |
||
|
R |
|
OR |
Положительный индукционный эффект проявляют заместители, которые подают электронную плотность на атом углерода (отталкивают электронную плотность от себя). К ним относятся заместители, электроотрицательность кото-
рых меньше, чем у атома углерода, а также заместители, имеющие полный или частичный отрицательный заряд:
O , BR2, SiR3, Li, MgBr, HgCl и т. д.
Следует отметить, что хотя водород имеет меньшую электроотрицатель-
ность, чем углерод, его индукционный эффект принят равным нулю. Положи-
тельный индукционный эффект проявляют также алкильные радикалы, причем,
чем больший объем имеет радикал, тем сильнее проявляемый им положитель-
ный индукционный эффект:
|
|
|
CH3 |
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH |
|
C |
|
CH |
|
CH3 |
|
CH2 |
|
||
|
|
||||||||||
|
|
|
|
|
|||||||
3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
Индукционный эффект, как положительный, так и отрицательный, быстро затухает по цепи и передается не более, чем на три связи:
δδδ+ |
δδ+ |
δ+ |
δ - |
CH3 |
CH2 |
CH2 |
Cl |
44
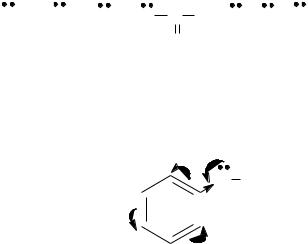
Мезомерный эффект (Мэф) – это передача электронного влияния замести-
теля на сопряженную систему, при этом заместитель сам становится частью со-
пряженной системы.
Мезомерный эффект, как и индукционный, может быть положительным
(+М) и отрицательным ( − М). Положительный мезомерный эффект проявляют заместители, которые повышают электронную плотность в сопряженной систе-
ме. К ним относятся заместители, атомы которых, непосредственно связанные с сопряженной системой, имеют неподеленную электронную пару:
-NH2, -OH, -OR, -O C R, -Cl, -Br, -I и т. д. O
Например, в молекуле фенола электронная пара кислорода взаимодейству-
ет с сопряженной системой бензольного кольца, образуя с ней единое электрон-
ное облако (т. е. заместитель становится частью сопряженной системы).
|
δ - |
O H |
δ+ |
|

 δ - δ -
δ - δ -
δ+
При этом электронная пара кислорода смещается к бензольному кольцу
(смещение электронов π-связей и свободных электронных пар обозначают изо-
гнутой стрелкой), в результате чего электронная плотность в бензольном кольце повышается. Реакции электрофильного замещения, характерные для ароматиче-
ских соединений, будут протекать легче, чем в незамещенном бензоле.
Влияние заместителя передается по всем сопряженным связям одинаково,
т. е. их электроны смещаются в том же направлении, что и электроны заместите-
ля. Это приводит к чередованию зарядов в сопряженной системе. Электронная плотность повышается в положениях 2,4,6 (о- и п-положениях) и понижается в положениях 3 и 5 (м-положениях). Действие электрофилов будет направлено на атомы с избытком электронной плотности, т. е. в положения 2,4,6. Заместители,
облегчающие протекание реакций электрофильного замещения в бензольном кольце и направляющие их в положения 2,4,6 называются ориентантами I рода
или о, п - ориентантами.
45
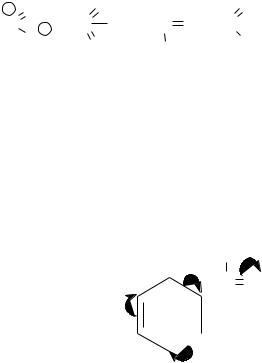
Помимо +М-эффекта гидроксильная группа, как известно, обладает –I-
эффектом, за счет которого притягивает электронную плотность от бензольного кольца. Однако мезомерный эффект почти всегда проявляется сильнее, чем ин-
дукционный, поэтому в результате совокупного действия –I и +М - эффектов электронная плотность в бензольном кольце будет повышаться. Заместители, ко-
торые в результате совокупного действия всех своих эффектов повышают элек-
тронную плотность на реакционном центре, называются электронодонорными.
Если в результате совокупного действия всех своих эффектов заместители по-
нижают электронную плотность на реакционном центре, то такие заместители называются электроноакцепторными.
Отрицательным мезомерным эффектом обладают заместители, понижаю-
щие электронную плотность в сопряженной системе. К ним относятся замести-
тели, атомы которых, непосредственно связанные с сопряженной системой, об-
разуют также кратную связь с более электроотрицательным атомом:
|
|
|
|
|
O |
|
O |
O |
|||
-N |
|
, - S |
OH, - C O, - C |
, - C |
|
N и т. д. |
|||||
O |
|
||||||||||
|
|||||||||||
|
|
|
|
|
|
O |
R |
OR |
|||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
Например, в молекуле бензальдегида электроны π-связи карбонильной группы взаимодействуют с π-электронами бензольного кольца, образуя единое электронное облако, т. е. заместитель становится частью сопряженной системы.
Входящий в эту систему атом кислорода притягивает к себе электронную плот-
ность, обедняя ею бензольное кольцо:
H
δ - δ+ C Oδ - 
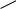 δ+
δ+
δ+  δ+ δ -
δ+ δ -
Понижение электронной плотности в бензольном кольце затрудняет взаи-
модействие его с электрофилами. Как уже отмечалось, электронная плотность всех сопряженных связях смещается одинаково, в том же направлении, в каком
46
она смещается в заместителе. Это, как и в случае +М-эффекта, приводит к чере-
дованию зарядов. Электронная плотность наиболее сильно понижается в поло-
жениях 2,4,6. В положениях 3 и 5 она тоже понижается, но в меньшей степени
(можно считать, что относительно положений 2,4,6 она будет повышена). По-
этому реакции электрофильного замещения будут протекать труднее, чем в не-
замещенном бензоле, и будут направлены в положения 3 и 5 (м-положения). За-
местители, затрудняющие протекание реакций электрофильного замещения в бензольном кольце и направляющие их в положения 3 и 5 называются ориен-
тантами II рода или м-ориентантами.
Таким образом, направление реакций электрофильного замещения в бен-
зольном кольце определяется природой заместителя.
|
|
Направление атаки электро- |
Ориентанты I рода |
Электронные |
|||||
|
|
|
фила, |
|
|
|
|
|
эффекты |
|
|
X – ориентант I рода. |
|
|
|
|
|
|
|
Е |
+ |
|
|
Е |
+ |
Все алкильные группы |
|
||
|
|
:X |
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
+ Iэф |
|
|
|
|
орто- |
|
|
-СН3, -С2Н5 и т.д. |
|||
|
|
орто- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пара- |
|
|
|
|
|
|
|
|
|
|
|
|
.. |
.. .. .. |
|
|
|
|
|
|
|
|
- ОН, -ОR, -SH, -NH2, |
|
||
|
|
|
Е+ |
|
|
.. |
.. |
.. .. |
– Iэф , + Мэф |
|
|
|
|
|
-NHR, NR2, - Cl, - Br и др. |
|
|||
|
|
|
электрофил |
|
|
|
|
|
|
47
Направление атаки электрофила, |
Ориентанты II рода Электронные |
X – ориентант II рода. |
эффекты |
|
X |
|
|
|
|
О |
|||||
|
|
|
|
|
|
|
О |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
С |
|
|
|
С |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
ОН , |
|
|
|
Н , |
|
|
|
|
|
|
|
|||||
мета- |
|
|
|
мета- |
|
|
|
|
– Iэф , - Мэф |
||
|
|
|
О |
|
|
|
О |
||||
|
+ |
|
|
|
|||||||
|
|
|
|
S ОН |
|||||||
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Е+ |
|
|
|
Е+ |
О- , |
|
|
|
O .. |
||
электрофил |
|
|
|
|
|
|
|
|
|
|
|
Например:
OH |
OH |
|
|
Br |
Br |
+ 3 Br2 |
|
+ 3HBr |
|
Br |
|
H C O |
H C O |
|
|
Fe |
+ HBr |
+ Br2 |
|
Br
В случае наличия двух и более заместителей в бензольном кольце направ-
ление действия заместителей может совпадать (согласованная ориентация), а
может не совпадать (несогласованная ориентация). Если несогласованную ориентацию проявляют заместители разного рода, то направление атаки элек-
трофила всегда определяет ориентант I рода.
48
Например: |
|
|
|
|
|
|
Согласованная ориентация |
Несогласованная ориентация |
|||||
Ориентант |
|
|
|
|
|
|
II рода |
|
|
Ориентант |
E+ |
|
|
|
δ - |
|
II рода |
|
|
|
|
|
|
|
|
||
HO |
O |
Ориентант |
OH |
|
|
Ориентант |
C |
|
I рода |
|
|
I рода |
|
|
O |
H |
δ -O C |
|
δ - |
O H |
δ - |
|
|
δ - |
|
|
|
δ - |
|
|
|
δ - |
|
|
|
|
|
|
|
||
E+ |
|
E+ |
E+ |
|
|
E+ |
салициловая (о-гидроксибензойная) |
|
м-гидроксибензойная |
||||
кислота |
|
|
|
|
кислота |
|
В тех случаях, когда несогласованную ориентацию проявляют заместители
одного рода, общих закономерностей нет.
Примеры:
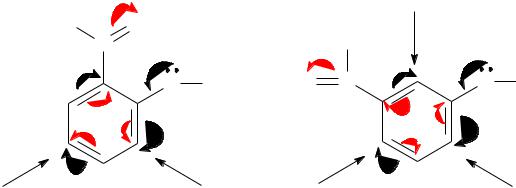
I.В каких соединениях имеет место сопряжение? Укажите тип со-
пряжения:
а) СН3-СН=СН-СН2-СН=СН2; |
г) СН2=СН-ОСН3; |
б) Br-СН2-CH=CH2; |
д) CH3CO-С6Н4-СН2-CH=CH-CHO. |
в) H2N-CH=CH-(NH2)C=NH; |
|
а) СН3-СН=СН-СН2-СН=СН2 В этом соединении сопряжение отсутствует, так как двойные связи изоли-
рованы (разделены более чем одной простой связью).
б) Br-СН2-CH=CH2
В данном соединении сопряжение также отсутствует, т.к. атом брома,
имеющий неподеленную пару электронов, и двойная связь разделены двумя одинарными связями.
49
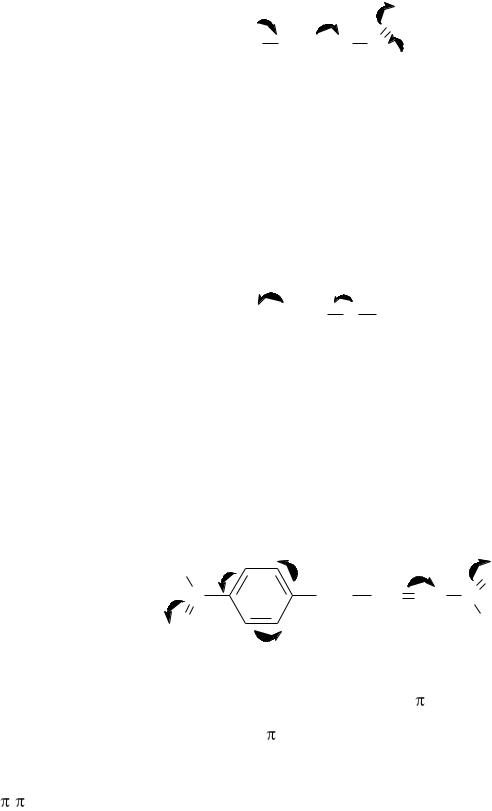
в) H2N-CH=CH-(NH2)C=NH
Напишем структурную формулу данного соединения:
.. NH
H2N CH  CH C
CH C .. NH2
.. NH2
В данном соединении электроны π-связей отделены друг от друга и от электронов неподеленных электронных пар только одной простой связью, сле-
довательно, образуется сопряженная система. Так как в образовании сопряжен-
ной системы участвуют электроны двух π-связей и неподеленных электронных пар азота, имеет место как π,π-, так и р,π-сопряжение.
г) СН2=СН-ОСН3
..
CH2 CH O CH3
CH O CH3
В данном соединении электроны свободной электронной пары кислорода отде-
лены одной простой связью от π-электронов двойной углерод-углеродной связи.
Следовательно, эти электроны образуют сопряженную систему и имеет место р,π-сопряжение.
д) CH3CO-С6Н4-СН2-CH=CH-CHO
Напишем структурную формулу данного соединения:
H3C |
O |
C |
CH2 CH CH C |
O |
H |
В молекуле этого соединения кетонная карбонильная группа непосредст-
венно связана с бензольным кольцом. Электроны -связи кетонной карбониль-
ной группы взаимодействуют с -электронами бензольного кольца и образуют единое электронное облако, т.е. сопряженную систему, при этом имеет место
, -сопряжение. Альдегидная карбонильная группа также образует сопряжен-
ную систему с двойной связью С – С, так как они разделены только одной про-
50
