
- •Перший закон термодинаміки
- •Основні поняття хімічної термодинаміки
- •1.2. Сутність та формулювання першого закону термодинаміки
- •Теплоємкість. Теплота нагрівання
- •Загальні відомості. Класифікація
- •Вплив чинників на величину теплоємкості
- •2.3. Розрахунки теплоємкості
- •2.4. Теплота нагрівання
- •3. Термохімія
- •3.1. Загальні положення. Тепловий ефект реакції
- •3.2. Закон Гесса. Визначення стандартних теплових ефектів хімічних реакцій
- •3.3. Залежність теплових ефектів реакцій від температури.
- •4. Другий закон термодинаміки
- •4.1. Загальні положення. Формулювання закону
- •4.2. Два методи визначення можливості і напрямку
- •4.3. Методи розрахунків ентропії речовин і зміни ентропії
- •4.4. Статистичний характер другого закону термодинаміки. Ентропія і імовірність
- •5. Характеристичні функції і термодинамічні потенціали
- •5.1. Термодинамічні потенціали
- •5.2. Характеристичні функції. Умови рівноваги
- •5.4. Методи обчислення стандартної хімічної спорідненості
- •6. Хімічна рівновага
- •6.1. Константа хімічної рівноваги
- •6.2. Визначення виходу продуктів реакції
- •Гомогенні реакції.
- •Гетерогенні реакції.
- •6.3. Зміщення стану рівноваги. Принцип Ле-Шательє
- •6.4. Залежність константи рівноваги від температури. Рівняння ізобари реакції
- •6.5. Третій закон термодинаміки
- •6.6. Розрахунки констант хімічної рівноваги
- •7. Елементи термодинаміки необоротних процесів
- •7.1. Загальні відомості. Класифікація необоротних процесів
- •7.2. Основні закономірності термодинаміки необоротних процесів
Вплив чинників на величину теплоємкості
Теплоємкість залежить від хімічної природи речовини і її агрегатного стану. Наприклад:
Ср,Fe = 25,00 Дж/(мольК);
Ср,FeО = 49,92 Дж/(мольК);
![]() = 75,30 Дж/(мольК);
= 75,30 Дж/(мольК);
![]() = 33,61 Дж/(мольК).
= 33,61 Дж/(мольК).
Вплив тиску на величину теплоємкості незначний. Наприклад, при підвищенні тиску азоту у 500 разів, його теплоємкість збільшується лише на 70%.
Вплив температури на теплоємкість досить суттєвий. При абсолютному нулі (0 К) теплоємкість будь-якої індивідуальної кристалічної речовини дорів-нює нулю (постулат Планка).
При підвищенні температури теплоємкість речовин (за винятком інертних газів) зростає. Кількісно залежність теплоємкості від температури не може бути визначена на основі інших властивостей речовин за допомогою законів термодинаміки. Тому вона досліджується в кожному випадку експериментально, тоді як теорія цієї проблеми розробляється на основі квантової статистичної фізики.
Залежність мольної істинної ізобарної теплоємкостівід температури в широкому інтервалі температур, що відповідають існуванню речовини в даному агрегатному стані, досить добре описуєтьсяемпіричними ступеневими рядами:
Ср= а + вТ + сТ2(для органічних речовин);
Ср= а + вТ + с'Т-2(для неорганічних речовин);
Ср = а + вТ + сТ2 + с'Т-2 (загальний ряд), (2.9)
де а, в, с і с'– коефіцієнти, що залежать тільки від природи і агрегатного стану речовини. Вони одержані дослідним шляхом і наводяться у довідниках (табл. Д.2). Розмірність коефіцієнтів становить відповідно: Дж/(мольК); Дж/(мольК2); Дж/(мольК3); (ДжК)/моль.
Часто користуються стандартною
теплоємкістю речовин -
![]() .
Це теплоємкість за стандартних умов:
Т = 298 К; Р = 1,013105Па. Величини стандартної мольної істинної
ізобарної теплоємкості багатьох речовин
наводяться у довідниках (табл. Д.2).
.
Це теплоємкість за стандартних умов:
Т = 298 К; Р = 1,013105Па. Величини стандартної мольної істинної
ізобарної теплоємкості багатьох речовин
наводяться у довідниках (табл. Д.2).
На рис. 2.1 наведена якісна схема впливу температури на теплоємкість металів, у яких в твердому стані відсутні поліморфні перетворення. Видно, що вплив температури значний і різний для різних температурних інтервалів. При 0 К Со= 0. В інтервалі 0298 К зміна теплоємкості має вигляд кубічної параболи і теплоємкість може бути визначена за рівнянням Дебая
С = аТ3,
де Т – температура, К; а – коефіцієнт, що залежить від природи металу, Дж/(мольК4). В інтервалі температур 298Тплтеплоємкість змінюється по кривій, що досить точно описується емпіричним ступеневим рядом (2.9). Теплоємкість рідких металів характеризується меншими величинами і від температури не залежить. Теплоємкість металів в газоподібному стані ще нижча і також не залежить від температури. Для газоподібного стану металів слушно рівняння Майера (2.2).
С,
Дж/(мольК)
|
Рис. 2.1. Схема залежності теплоєм-кості металів від температури |
Рис. 2.2. Схема, що показує фізичний зміст функцій тепловмісту |
2.3. Розрахунки теплоємкості
Мольну істинну ізобарну теплоємкість звичайно визначають за рівнянням емпіричного ступеневого ряду теплоємкості (2.9).
Середню мольну ізобарну теплоємкість можна визначити за допомогою ступеневого ряду
![]()
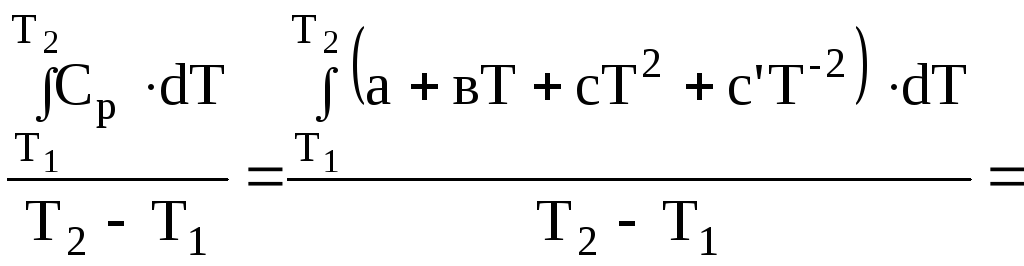
![]() (2.10)
(2.10)
або з використанням функцій тепловмісту
![]()
![]()
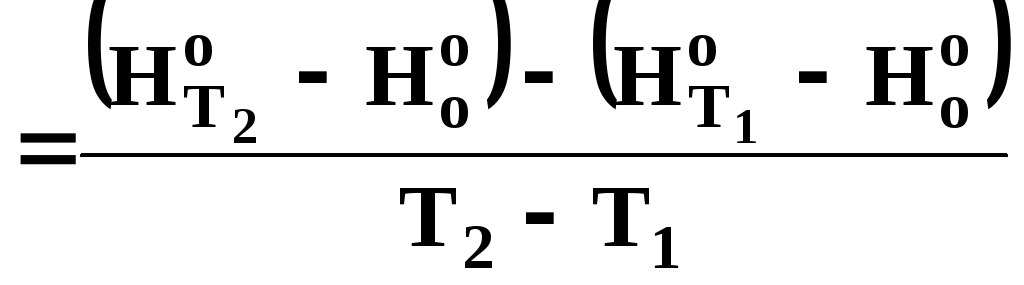 . (2.11)
. (2.11)
Тепловміст
![]() - величина, що показує кількість теплоти,
яка потрібна для нагрівання одного моль
речовини (при Р = 1,013105Па) від 0 до Т К (рис. 2.2). Величини тепловмісту
наводяться у довідниках (табл. Д.4).
Розмірність тепловмісту – Дж/моль.
- величина, що показує кількість теплоти,
яка потрібна для нагрівання одного моль
речовини (при Р = 1,013105Па) від 0 до Т К (рис. 2.2). Величини тепловмісту
наводяться у довідниках (табл. Д.4).
Розмірність тепловмісту – Дж/моль.
В металургійній практиці важливо знати теплоємкість сталі, чавуну, кольорових сплавів, шлаків і т.д. Беручи до уваги, що теплоємкість – екстенсивна властивість системи і до неї придатне правило адитивності, теплоємкість будь-якої суміші можна визначити за рівнянням
![]() , (2.12)
, (2.12)
де
![]() -
питома теплоємкість і-го компоненту
суміші, Дж/(кгК);
%мас.1,2,…і– масовий відсоток і-го
компоненту суміші.
-
питома теплоємкість і-го компоненту
суміші, Дж/(кгК);
%мас.1,2,…і– масовий відсоток і-го
компоненту суміші.
