
- •Перший закон термодинаміки
- •Основні поняття хімічної термодинаміки
- •1.2. Сутність та формулювання першого закону термодинаміки
- •Теплоємкість. Теплота нагрівання
- •Загальні відомості. Класифікація
- •Вплив чинників на величину теплоємкості
- •2.3. Розрахунки теплоємкості
- •2.4. Теплота нагрівання
- •3. Термохімія
- •3.1. Загальні положення. Тепловий ефект реакції
- •3.2. Закон Гесса. Визначення стандартних теплових ефектів хімічних реакцій
- •3.3. Залежність теплових ефектів реакцій від температури.
- •4. Другий закон термодинаміки
- •4.1. Загальні положення. Формулювання закону
- •4.2. Два методи визначення можливості і напрямку
- •4.3. Методи розрахунків ентропії речовин і зміни ентропії
- •4.4. Статистичний характер другого закону термодинаміки. Ентропія і імовірність
- •5. Характеристичні функції і термодинамічні потенціали
- •5.1. Термодинамічні потенціали
- •5.2. Характеристичні функції. Умови рівноваги
- •5.4. Методи обчислення стандартної хімічної спорідненості
- •6. Хімічна рівновага
- •6.1. Константа хімічної рівноваги
- •6.2. Визначення виходу продуктів реакції
- •Гомогенні реакції.
- •Гетерогенні реакції.
- •6.3. Зміщення стану рівноваги. Принцип Ле-Шательє
- •6.4. Залежність константи рівноваги від температури. Рівняння ізобари реакції
- •6.5. Третій закон термодинаміки
- •6.6. Розрахунки констант хімічної рівноваги
- •7. Елементи термодинаміки необоротних процесів
- •7.1. Загальні відомості. Класифікація необоротних процесів
- •7.2. Основні закономірності термодинаміки необоротних процесів
4.4. Статистичний характер другого закону термодинаміки. Ентропія і імовірність
Розглядаючи зміну ентропії в різних процесах, можна помітити, що збільшення ентропії завжди супроводжується зростанням хаотичності молекулярного стану. Наприклад, перехід системі з кристалічного в рідкий або газоподібний стани супроводжується зменшенням упорядкування і зростанням хаотичності у розподілі молекул. Одночасно зростає і ентропія системи.
Макроскопічний стан системи є сукупністю мікростанів, в яких беруть участь молекули з різними ознаками. Імовірність кожного макростану пропорційна числу мікростанів, через які він здійснюється. Це число називають термодинамічною імовірністю (W). У 1896 році Больцман дав визначенню ентропії як термодинамічної імовірності
![]() , (4.11)
, (4.11)
де К – стала Больцмана (1,3810-23 ДжК-1).
Поняття термодинамічної імовірності дозволяє уточнити зміст другого закону термодинаміки. З точки зору статичної термодинаміки, процеси, що наближають систему до стану рівноваги, відповідають переходу системи від менш імовірних станів до більш імовірних. Процеси, що віддаляють систему від стану рівноваги не є неможливими, а є менш імовірними.
Розрахунки свідчать, що для систем, які складаються з великої кількості частинок, більш імовірний напрямок самодовільного процесу абсолютно неминучий, а процеси, що виводять систему з стану рівноваги – практично неможливі. Чим з меншого числа частинок складається система, тим менш строго дотримується це ствердження. Отже другий закон термодинаміки виконується лише для систем з великою кількістю частинок, тобто має статистичний характер.
Задача 4.1. Визначити ентропію 10 кг міді при 2000 К, якщо температура плавлення міді 1356 К, температура кипіння – 2843 К, теплота плавлення – 12,98 кДж/моль. Необхідні для розрахунку дані взяти з таблиць довідника.
Розв'язання. Ентропію міді при 2000 К можна обчислити за рівнянням (4.8)
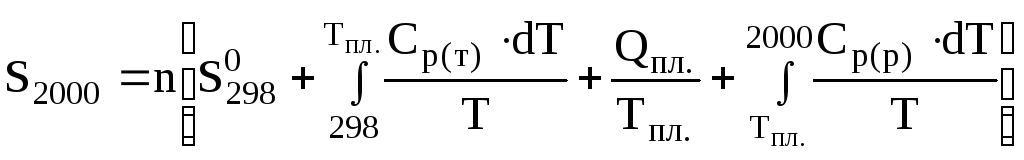 .
.
Враховуючи рівняння (4.6), ентропія 10 кг міді при 2000 К дорівнюватиме
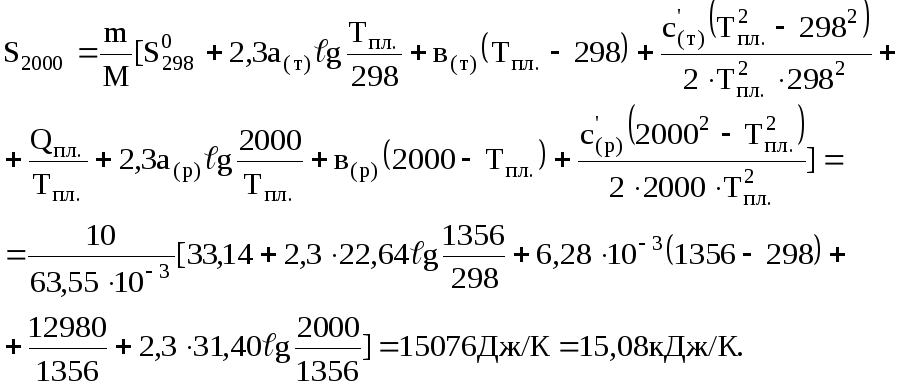
Задача 4.2. По зміні ентропії визначити напрямок реакції одержання цинку пірометалургійним методом за реакцією
ZnO +C = Zn + CO
в ізольованій системі при 1000 К. Необхідні для розрахунків дані взяти з таблиць довідника.
Розв'язання. Зміну ентропії реакції можна знайти за рівнями (4.10)
![]() .
.
Користуючись даними табл. Д.4, визначимо:
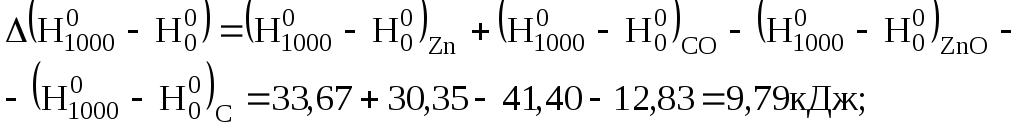
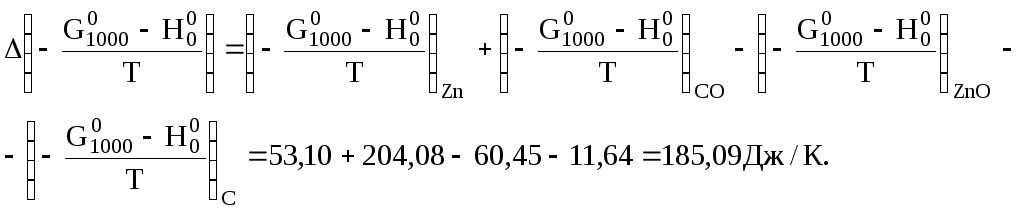
Отже, зміна ентропії реакції дорівнюватиме
![]() Дж/К.
Дж/К.
Оскільки S1000 0 (ентропія зростає), то реакція при 1000 К в ізольованій системі проходитиме самодовільно в прямому напрямку.
5. Характеристичні функції і термодинамічні потенціали
5.1. Термодинамічні потенціали
В ізольованих системах зміна ентропії може служити критерієм напрямку самодовільних процесів. Проте, в металургійній практиці більшість процесів протікає не в ізольованих, а у відкритих системах. Для цих випадків в якості критеріїв напрямку процесів потрібні інші термодинамічні функції. Якщо процеси відбуваються при сталій температурі, то критерієм їх напрямку може служити робота. Важливим є те, що величина роботи дорівнює зміні деякої функції стану системи. Виведемо цю функцію для ізобарно-ізотермічного процесу.
Елементарна робота (W) складається з об'ємної роботи (Wоб = PdV) і суми інших робіт – корисної роботи (W'), тобто
W=PdV+W'.
Зваживши, що при оборотному процесі Q= ТdS(4.1), запишемо на основі першого закону термодинаміки рівняння:
dU = Q - W = ТdS – PdV - W';
-W' =dU- ТdS+PdV. (5.1)
Враховуючи, що UіS– функціїстану системи, а V– параметр стану, рівняння (5.1) можна подати у вигляді
-W' =d(U– ТS+PV). (5.2)
Вводячи в (5.2) позначення: Н = U+PVіG= Н – ТS, одержуємо:
-W' =dG;
W' = G1 – G2 = -G, (5.3)
де G–функція стану системи, яка у 1875 році була запропонована Гіббсом у якості критерія напрямку ізобарно-ізотермічних процесів і одержала назву ізобарно-ізотермічного (коротко ізобарного) термодинамічного потенціалу системи або вільної енергії Гіббса.
Таким чином, в оборотних процесах максимальна корисна робота при ізобарно-ізотермічних процесах дорівнює зменшенню ізобарного потенціалу.
В необоротних процесах, де TdSQ(4.2), робота одержується меншою, ніж зміна ізобарного потенціалу
W'-G. (5.4)
Щоб визначити вплив температури і тиску на величину ізобарного потенціалу, диференцюємо рівняння
G = H – TS = U + PV – TS
за змінними Р і Т
dG = dU – TdS + SdT + PdV + VdP.
Оскільки,
dU = TdS – PdV - W' (5.1),
то
dG = -SdT + VdP - W'.
З цього рівняння при сталих Р і Т одержуємо в диференціальній формі рівняння (5.3). При відсутності корисної роботи одержуємо для оборотних процесів
dG= -SdT+VdP,
а для необоротних процесів
dG-SdT+VdP.
Часткові похідні функції G:
![]() і
і![]()
показують, що ізобарний потенціал зростає із збільшенням тиску і зменшується при підвищенні температури (рис. 5.1).

Рис. 5.1. Вплив температури і тиску на величину ізобарно-ізотермічного
потенціалу
Якщо процес відбувається необоротно, то при сталих тиску і температурі маємо (G)р,т -W', тобто одержуємо рівняння (5.4) в диференціальній формі. При відсутності корисної роботи одержуємо рівняння (G)р,т 0.
Взагалі (G)р,т 0, звідки випливає, що ізобарний потенціал системи, яка знаходиться при сталих тиску і температурі не змінюється при оборотних процесах і зменшується при необоротних процесах.
Це можна переформулювати таким положенням: ізобарно-ізотермічний потенціал системи, що знаходиться при сталих тиску і температурі, прагне зменшитись у природних (самодовільних) процесах. Коли він досягає мінімального значення, то в системі встановлюється стан рівноваги.
Таким чином, умовами рівноваги для ізобарно-ізотермічних процесів є:
(G)р.т = 0; (2G)р.т 0.
Останні співвідношення справедливі тільки в тому випадку, коли системою не виконуються інші види робіт, крім об'ємної.
Якщо вираз G=H–TSзаписати для ізобарно-ізотермічного процесу, то одержимо рівняння Гіббса-Гельмгольца
G=H-TS,(5.5)
яке можна переписати таким чином
H=G+TS.
Останнє рівняння свідчить, що зміна ентальпії системи складається з двох частин. Перша частина – це зміна ізобарного потенціалу, що дорівнює роботі, яку можна одержати у випадку проведення оборотного процесу. Друга частина TS– це теплота, що при жодних умовах не може бути перетворена в роботу, але яка при оборотному процесі передається іншій системі або розсіюється в навколишньому середовищі.
З рівняння Гіббса-Гельмгольца видно, що навіть при здійсненні процесу (реакції) в ідеальних умовах оборотності неможливо перетворити всю ентальпію вихідних речовин в роботу. Ту частину енергії, що може бути перетворена в роботу (G), називають вільною(роботоспроможною). TSназивають зв'язаною енергією (нероботоспроможною), оскільки вона не перетворюється в роботу.
Розмірковуючи аналогічно вищевикладеному, для ізохорно-ізотермічних процесів можна одержати
W' = -F,
де F – функція стану системи, що називається ізохорно-ізотермічним (коротко ізохорним) термодинамічним потенціалом або вільною енергією Гельмгольца. Звичайно при проведенні металургійних процесів об'єм системи змінюється, тому ізохорний потенціал для металургів-практиків менш цікавий і більш докладно на його властивостях не зупиняємось.
