
minikurs
.pdf
|
|
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ |
|
А19 |
|
|
|
|
|
|
|
||
№ |
Признак классификации |
Примеры реакций в неорганической химии |
|
Примеры реакций в органической химии |
||
|
|
|
|
|
|
|
I.ПО ЧИСЛУ И СОСТАВУ РЕАГИРУЮЩИХ ВЕЩЕСТВ
|
1. |
Без изменения состава |
Процессы получения аллотропных модификаций: |
Реакции изомеризации: |
|
|
|
|
|
С(графит) ↔ С(алмаз) |
3О2 (кислород) ↔ 2О3 (озон) |
CH3-CH2-CH2-CH2-CH3 → CH3-CH(CH3)-CH2-CH3 |
|
|
2. |
С изменением состава |
|
|
|
|
|
2.1 |
Реакции соединения |
1) Из двух простых веществ образуется одно сложное: |
1) Реакция гидрирования - присоединение водорода: |
||
|
|
|
S + O2 → SO2 |
|
CH2=CH2 + H2 → C2H6 |
|
|
|
|
2) Из простого и сложного веществ образуется одно сложное: |
2) Реакция гидратации – присоединение воды: |
||
|
|
|
2 SO2 + O2 ↔ 2 SO3 |
CH2=CH2 + HOH → C2H5OH |
|
|
|
|
|
3) Из двух сложных веществ образуется одно (более сложное): |
3) Реакции галогенирования – присоединение галогена: |
||
|
|
|
SO3 + H2O → H2SO4 |
CH2=CH2 + Br2 → CH2Br-CH2Br |
|
|
|
|
|
|
|
4) Реакции гидрогалогенирования – присоединение НГ: |
|
|
|
|
4) 4 NO2 + O2 + 2 H2O → 4 HNO3 |
CH3-CH=CH2 + HCl → CH3-CH(Cl)-CH3 |
||
|
|
|
|
|
5) Реакция полимеризации: |
Разновидности: |
|
|
|
|
|
nCH2=CH2 → (-CH2-CH2-)n |
3 CH≡CH → C6H6 |
|
|
|
|
|
CH≡CH + CH≡CH → CH2=CH-C≡CH |
|
|
2.2 |
Реакции разложения |
1) Из одного сложного вещества образуются два простых: |
1) Реакции отщепления (элиминирования) |
|
|
|
|
|
t |
|
а) дегидратация – отщепление воды: |
|
|
|
|
2 HgO → 2 Hg + O2↑ |
t,kt |
|
|
|
|
|
2) Из одного сложного образуется одно простое и одно сложное: |
C2H5OH → CH2=CH2 + H2O |
|
|
|
|
|
t |
|
б) Дегидрирование – отщепление водорода: |
|
|
|
|
2 KNO3 → 2 KNO2 + O2↑ |
t,kt |
|
|
|
|
|
3) Из одного сложного образуется три вещества: |
CH3-CH3 → CH2=CH2 + H2↑ |
|
|
|
|
|
t |
|
2) Реакция крекинга (расщепления): |
|
|
|
|
2 KMnO4 → K2MnO4 + MnO2 + O2↑ |
t |
|
|
|
|
|
|
|
CH3-CH2-CH3 → CH2=CH2 + CH4 |
|
|
2.3 |
Реакции замещения |
Взаимодействие простых веществ со сложными: |
Взаимодействие простых веществ со сложными: |
||
|
|
|
2 Na + 2 H2O → 2 NaOH + H2↑ |
hν |
|
|
|
|
|
Zn + 2 HCl → ZnCl2 + H2↑ |
CH4 + Cl2 → CH3Cl + HCl |
|
|
|
|
|
FeBr3 |
|
||
|
|
|
Fe + CuSO4 → FeSO4 + Cu |
|
||
|
|
|
C6H6 + Br2 → C6H5Br + HBr |
|
||
|
|
|
|
t |
! особенность – реакции между некоторыми сложными в-вами |
|
|
|
|
2 Al + Cr2O3 → Al2O3 + 2Cr |
являются реакциями замещения, а не обмена, например: |
||
|
|
|
|
|
||
|
|
|
|
|
C6H6 + HO-NO2 → C6H5NO2 + H2O |
|
|
|
|
|
|
C2H5OH + HCl → C2H5Cl + H2O |
|
|
2.4 |
Реакции обмена |
Два сложных вещества обмениваются своими частями: |
Два сложных вещества обмениваются своими частями: |
||
|
|
|
NaOH + HNO3 → NaNO3 + H2O ( р. Нейтрализации) |
CH3COOH + NaOH → CH3COONa + H2O |
||
|
|
|
2 NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O |
2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 + H2O |
||
|
|
|
CuSO4 + 2 KOH → Cu(OH)2↓ + K2SO4 |
CH3COONa + HCl → 2 NaCl + CH3COOH |
||
|
|
|
|
|
CH3COOH + CH3OH → CH3COOCH3 + H2O |
|
|
|
|
|
|
(реакция этерификации) |
|
II. |
ПО ИЗМЕНЕНИЮ СТЕПЕНИ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, ОБРАЗУЮЩИХ ВЕЩЕСТВА |
||||||||||
|
1. |
ОВР – реакции, идущие с |
1.Все реакции замещения, например: |
|
1.Реакции горения и окисления: |
||||||
|
|
изменением степеней окисления |
Mg + H2SO4 → MgSO4 + H2 |
|
t |
t,kt |
|||||
|
|
|
|
|
|
|
|
|
|
CH4 + 2O2 → CO2 + 2H2O CH3COH+Ag2O → CH3-COOH+2Ag |
|
|
|
|
|
2. Реакции соединения и разложения с участием хотя бы одного |
2. Реакции восстановления: |
||||||
|
|
|
|
t,kt |
|
||||||
|
|
|
|
простого вещества: |
|
|
|
|
|
CH3-CH2OH |
|
|
|
|
|
t |
|
|
|
t |
|
CH3COH + H2 → |
|
|
|
|
|
|
|
|
|
3. Реакции замещения: |
|||
|
|
|
|
2Cu + O2 → 2 CuO |
2 KNO3 → 2 KNO2 |
+ O2↑ |
|||||
|
|
|
|
2 CH3COOH + Mg → (CH3COO)2Mg + H2↑ |
|||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
2. |
не ОВР – реакции, идущие без |
1.Все реакции ионного обмена: |
|
|
|
Все реакции обмена: |
||||
|
|
изменения степеней окисления |
Na2CO3 + 2 HCl → 2 NaCl + CO2 + H2O |
|
2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 + H2O |
||||||
|
|
|
|
2. Многие реакции соединения и разложения: |
|
2 CH3COOH + MgO → (CH3COO)2Mg + H2O |
|||||
|
|
|
|
Li2O + H2O → 2 LiOH |
|
t |
|
в том числе, реакции этерификации: |
|||
|
|
|
|
2 Fe(OH)3 → Fe2O3 + 3 H2O |
CH3COOH + CH3OH → CH3COOCH3 + H2O |
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
III. |
ПО ТЕПЛОВОМУ ЭФФЕКТУ |
|
|
|
|
|
|
|
|
||
|
1. |
Экзотермические |
+Q |
1.Почти все реакции соединения. |
|
1.Реакции присоединения: |
|||||
|
|
(с выделением тепла) |
|
ИСКЛЮЧЕНИЯ: |
|
2 SO2 + O2 → 2 SO3 + Q |
|
CH2=CH2 + H2 → C2H6 + Q |
|||
|
|
|
|
|
|
|
|
|
2. Реакции горения: |
||
|
|
|
|
|
|
N2 + O2 → 2 NO – Q |
|
|
CH4 + 2O2 →CO2 + 2H2O + Q |
||
|
|
|
|
|
|
H2(г.) + I2(т.) → 2 HI – |
Q |
|
3. Многие реакции замещения: |
||
|
|
|
|
2. Реакции горения: |
|
|
|
|
hν |
||
|
|
|
|
|
|
4P + 5 O2 → 2 P2O5 + Q |
|
CH4 + Cl2 → CH3Cl + HCl + Q |
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
2. |
Эндотермические |
-Q |
|
|
|
t |
|
|
t |
|
|
|
( с поглощением тепла) |
|
Реакции разложения: CaCO3 → CaO + CO2 – Q |
|
Реакции разложения: C4H10 → C2H6 + C2H4 – Q |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IV. |
ПО УЧАСТИЮ КАТАЛИЗАТОРА |
|
|
|
|
|
|
|
|||
|
1. |
Некаталитические |
|
t |
|
|
|
|
|
|
t |
|
|
|
|
2 HgO → 2 Hg + O2↑ |
|
|
|
C2H4 + 3 O2 → 2 CO2 + 2 H2O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
2. |
Каталитические |
|
t,kt |
2 KCl + 3 O2 |
|
t,kt |
||||
|
|
|
|
2 KClO3 → |
|
C2H5OH → |
CH2=CH2 + H2O |
||||
|
|
|
|
|
|
|
|
|
|
|
|
V. |
ПО НАПРАВЛЕНИЮ |
|
|
|
|
|
|
|
|
|
|
|
1. |
Обратимые |
|
N2 + 3H2 ↔ 2 NH3 |
|
|
CaCO3 ↔ CaO + CO2 |
|
Гидрирование ↔ дегидрирование |
||
|
|
(таких реакций большинство) |
2SO2 + O2 ↔ 2SO3 |
|
|
2 H2 + O2 ↔ 2 H2O |
|
Гидратация ↔ дегидратация |
|||
|
|
|
|
4 NO2 + 2H2O + O2 |
↔ 4 HNO3 |
N2 + O2 ↔ 2 NO |
|
Этерификация ↔ гидролиз сложного эфира |
|||
|
|
|
|
|
|
|
|
|
|
Гидролиз белков, ди – и - полисахаридов ↔ их образование |
|
|
2. |
Необратимые |
|
1. Все реакции горения. |
|
|
|
1. Все реакции горения. |
|||
|
|
|
|
2. Все реакции обмена, сопровождающиеся образованием: |
|
2. Все реакции обмена, сопровождающиеся образованием: |
|||||
|
|
|
|
- осадка ↓; |
|
|
|
|
|
- осадка ↓; |
|
|
|
|
|
- газа ↑; |
|
|
|
|
|
- газа ↑; |
|
|
|
|
|
- воды (H2O) или другого слабого электролита(H3PO4). |
|
- воды (H2O) или другого слабого электролита (CH3COOH). |
|||||

|
|
|
|
|
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ |
|
А20 |
|
|
||
|
|
|
|
|
|
|
|
||||
|
|
C |
моль |
|
1. |
Скорость химической реакции – изменение количества вещества в единицу времени. |
|
||||
|
|
υх.р. = ── |
─── |
|
2. |
Скорость химической реакции – изменение концентрации одного из веществ |
|
||||
|
|
t |
л ٠ сек |
|
|
|
|
в единицу времени. |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
№ |
|
ФАКТОР, ВЛИЯЮЩИЙ НА СКОРОСТЬ РЕАКЦИИ |
ОБЪЯСНЕНИЕ, ПРИМЕРЫ |
||||||||
|
|
|
|
|
|
|
|||||
1. |
Природа реагирующих веществ (их состав и строение, активность) |
Скорость реакции определяется энергией активации частиц: чем больше столкновений, |
|||||||||
|
|
|
|
|
|
|
тем больше скорость реакции. |
|
|
|
|
|
Cu + HCl → реакция не идет |
|
|
|
Так, мгновенно протекают все реакции ионного обмена в растворах, так как |
||||||
|
|
|
|
разноименно заряженные ионы мгновенно притягиваются. |
|||||||
|
Zn + 2 HCl → ZnCl2 + H2↑ |
|
|
|
|||||||
|
|
|
|
Со средней и большой скоростью протекают реакции взаимодействия активных |
|||||||
|
|
|
|
|
|
|
металлов с водой, с кислородом; металлов, стоящих в ряду активностей до водорода- с |
||||
|
|
|
|
|
|
|
кислотами; обесцвечивание бромной воды непредельными углеводородами. |
||||
|
|
|
|
|
|
|
Медленно протекают реакции, требующие нагревания, например, синтез аммиака из |
||||
|
|
|
|
|
|
|
водорода и азота; многие реакции разложения. |
|
|
|
|
|
|
|
|
|
|
|
Не взаимодействуют: неактивные металлы с водой, с кислотами – не окислителями; а |
||||
|
|
|
|
|
|
|
хром, железо, алюминий – с конц. HNO3, H2SO4 |
при обычных условиях (пассивация). |
|||
|
|
|
|
|
|
|
|||||
2. |
Концентрация реагирующих веществ (жидких и газообразных) |
Скорость химической реакции пропорциональна произведению концентраций (ж. и г.) |
|||||||||
|
|
|
|
|
|
|
веществ, взятых в степенях, равных их коэффициентам в уравнении реакции. |
||||
|
Связь прямая: чем больше концентрация, тем и скорость больше. |
Например, в реакции: 1 N2 + 3 H2 → 2 NH3 при повышении концентрации водорода |
|||||||||
|
в 5 раз, скорость реакции увеличится в 53 , то есть, в 125 раз. А при повышении в 5 раз |
||||||||||
|
! Термин «концентрация» не применим к твердым веществам. |
концентрации всех реагирующих веществ, расчет будет таков: 51 ∙ 53 = 625 (раз) |
|||||||||
|
! Не влияет на скорость реакции концентрация веществ, которые образуются в ходе |
||||||||||
|
|
|
|
|
|
|
реакции. |
|
|
|
|
|
|
|
|
|
|
|
|||||
3. |
Поверхность (площадь) взаимодействия твердых веществ |
Приемы увеличения поверхности взаимодействия твердых веществ: |
|||||||||
|
|
|
|
|
|
|
1) Измельчение кусочков вещества (на гранулы, стружку, порошок, пыль и т.п.), |
||||
|
Связь прямая: чем больше поверхность, тем и скорость больше. |
растворение. |
|
|
|
|
|||||
|
2) В производстве используют принцип «кипящего слоя» (обжиг колчедана – в |
||||||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
производстве серной кислоты, каталитический крекинг нефтепродуктов и др.) |
||||
|
|
|
|
|
|
|
|
|
|||
4. |
Температура |
|
|
|
|
Повышение температуры на каждые 10°C приводит к увеличению скорости реакции в |
|||||
|
|
|
|
|
|
|
2, 3, 4 раза. Эта величина называется температурным коэффициентом. Например, при |
||||
|
Связь прямая: при повышении температуры скорость реакции |
коэффициенте 3 повышение температуры от 20 до 70°C (на 5 десятков) вызовет |
|||||||||
|
увеличение скорости реакции в 35 = 243 раза. |
|
|
|
|
||||||
|
повышается. |
|
|
|
|
|
|
|
|
|
|
5. |
Катализатор |
|
|
|
|
Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее |
|||||
|
|
|
|
|
|
|
скорость или направление, но по окончании реакции остающиеся неизменными |
||||
|
|
|
|
|
|
|
количественно и качественно. Ингибиторы – замедлители реакции. |
||||

|
|
|
|
ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
|
|
А21 |
|
|
2 SO2 + O2 → 2 SO3 + Q |
прямая реакция |
|
|
|
ПРИНЦИП |
||||
|
|
|
|||||||
2 SO3 → 2 SO2 + O2 – Q |
обратная реакция |
|
υпрямой реакции = υ обратной реакции |
СМЕЩЕНИЯ РАВНОВЕСИЯ – |
|||||
2 SO2 + O2 ↔ 2 SO3 |
обратимая реакция |
|
ПРИНЦИП ПРОТИВОДЕЙСТВИЯ |
||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
№ |
ФАКТОР, ВЛИЯЮЩИЙ НА СМЕЩЕНИЕ РАВНОВЕСИЯ |
|
ОБЪЯСНЕНИЕ, ПРИМЕРЫ |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
1. |
Концентрация |
|
|
|
|
2 SO2 + O2 ↔ 2 SO3 |
|
|
|
|
↑ С исходных веществ |
|
|
При повышении концентрации исходных веществ SO2 илиO2 |
|||||
|
|
|
|
|
равновесие смещается вправо. |
|
|
|
|
|
|
|
↑ С продуктов реакции |
При повышении концентрации продукта реакции SO3 |
равновесие |
||||
|
|
|
|
|
смещается влево. |
|
|
|
|
|
|
|
|
|
Другими словами, компенсируется недостаток вещества. |
||||
2. |
Температура |
|
|
|
При повышении температуры равновесие смещается в сторону |
||||
|
↑ Т |
- Q |
|
|
эндотермической реакции (– Q), то есть, в сторону разложения SO3. |
||||
|
↓ T |
+ Q |
|
|
2 SO3 → 2 SO2 + O2 – Q |
|
|
|
|
|
|
|
При понижении температуры равновесие смещается в сторону |
||||||
|
|
|
|
|
|||||
|
|
|
|
|
экзотермической реакции (+ Q), то есть, в сторону образования SO3. |
||||
|
|
|
|
|
2 SO2 + O2 → 2 SO3 + Q |
|
|
|
|
3.Давление (газообразных веществ)
↑ P : |
3 моль |
2 моль |
2 SO2(г) + O2(г) ↔ 2 SO3(г) |
|
2 моль + 1 моль |
↔ 2 моль |
|||
↓ P : |
3 моль |
2 моль |
3 моль |
↔ 2 моль |
|
|
|
При увеличении давления равновесие смещается в сторону уменьшения |
|
|
|
|
кол-ва моль газообразных веществ, то есть, в сторону образования SO3. |
|
|
|
|
При уменьшении давления равновесие смещается в сторону увеличения |
|
|
|
|
кол-ва моль газообразных веществ, то есть, в сторону разложения SO3. |
|
|
|
|
|
|
|
|
|
Катализатор повышает скорость и прямой, и обратной реакции. |
|
4. Катализатор не влияет на смещение равновесия! |
На смещение равновесия он не влияет. |
|
||
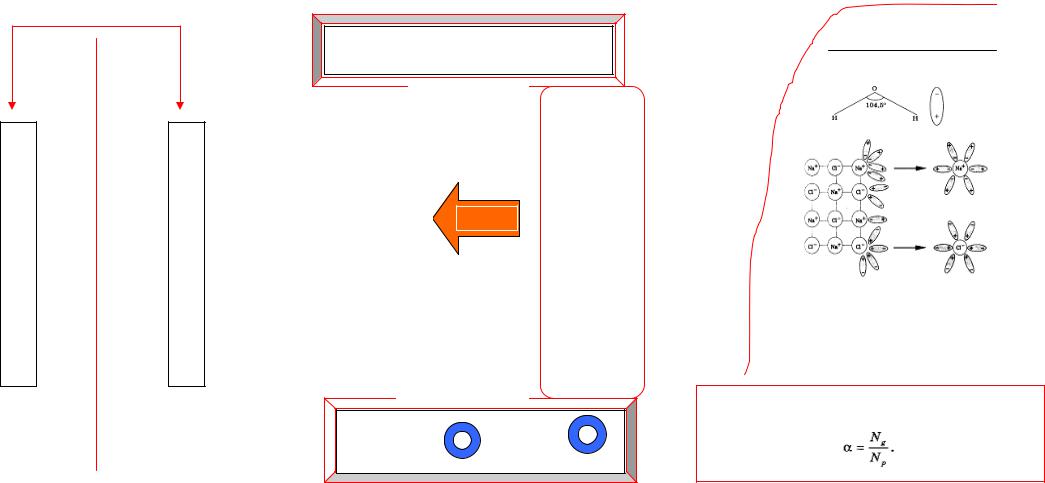
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД) |
А22 |
В Е Щ Е С Т В А
Н |
|
Е |
|
Э |
Э |
Л |
Л |
Е |
Е |
К |
К |
Т |
Т |
Р |
Р |
О |
О |
Л |
Л |
И |
И |
Т |
Т |
ЫЫ
КА |
диссоциация |
К+ |
+ А- |
→↔ |
|||
|
ассоциация |
ионы |
|
|
РАСПЛАВЫ |
|
|
|
|
|
|
|
|
Электролитическаядиссоциация |
электролитамолекулраспадэто– на ионы |
иливодеврастворенииприрасплавлении |
|
действиемПодтока направляютсякатионы к анионы,катоду– к аноду |
|
|
|
|
|
|
|||
|
|
|
|
|
|||||
ТОК |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
РАСТВОРЫ |
(H2O) |
|
KA ↔ K+ |
|
+ A- |
|
ионы |
гидратированные |
МЕХАНИЗМ
ДИССОЦИАЦИИ
H2O
NaCl ↔ Na+ + Cl-
+H2O + -
HCl ↔→ H3O + Cl
Ион гидроксония
Степень диссоциации
отношение числа диссоциированных молекул к общему
Неэлектролиты |
|
Электролиты (проводят ток) |
Диссоциируют |
|||||
(не проводят ток) |
|
Слабые |
|
Сильные |
ступенчато |
|||
1) Оксиды |
1) |
Все трудно растворимые соли |
1) |
Все растворимые соли |
1) Двух-и трехосновные кислоты: |
|||
2) Большинство органических |
2) |
Неорганические кислоты: HF, H2S, HCN |
2) |
Неорганические кислоты: |
H3PO4 = H+ + (H2PO4)- |
|||
веществ (углеводороды, спирты, |
HNO2, H2SO3, H2CO3, H3PO4, HClO2, HClO, H2SiO3 |
HCl, HBr, HI |
(H2PO4)- ↔ H+ + (HPO4)2- |
|||||
альдегиды, кетоны, эфиры, |
(если разница между количеством атомов кислорода и водорода меньше 2) |
HNO3, H2SO4, HClO4, HClO3, HMnO4, H2Cr2O7, H2CrO4 |
(HPO4)2- ↔ H+ + (PO4)3- |
|||||
|
|
2) Двух-трехкислотные основания: |
||||||
углеводы, амины) |
3) |
Органические кислоты: HCOOH, CH3COOH, C6H5OH |
(если разница между количеством атомов кислорода и водорода равна 2 или |
|||||
Сa(OH)2 = (СaOH) |
+ |
- |
||||||
|
4) Амфотерные гидроксиды: Zn(OH)2, Be(OH)2, Al(OH)3 |
больше 2 – то кислота сильная) |
|
+ OH |
||||
|
|
Щелочи: KOH, LiOH, NaOH, RbOH, CsOH, Ba(OH)2, |
(СaOH)+ ↔ Сa2+ + OH- |
|||||
|
5) Нерастворимые основания: Mg(OH)2, Cu(OH)2 |
3) |
3) Кислые и основные соли: |
|||||
|
6) Другие вещества: NH4OH, H2O |
|
Ca(OH)2- изв.вода и Sr(OH)2 – стронциевая вода |
NaHCO3 = Na+ + (HCO3)- |
||||
|
|
|
|
|
(HCO3)- ↔ H+ + (CO3)2- |
|||

|
|
РЕАКЦИИ ИОННОГО ОБМЕНА |
А23 |
ТРИ СЛУЧАЯ, |
|
|
|
когда реакции ионного обмена идут до конца |
УРАВНЕНИЯ РЕАКЦИЙ |
||
1. Один из продуктов реакции – осадок |
↓ |
BaCl2 + H2SO4 → BaSO4↓ + 2 HCl |
|
|
|
Ba2+ + 2Cl- + 2H+ + SO42- → BaSO4↓ + 2H+ + 2Cl- |
|
Участниками реакции являются те ионы, которые |
Ba2+ + SO 2- → BaSO ↓ |
||
4 |
4 |
||
остались в сокращенном уравнении. Именно они |
CuSO4 + 2 NaOH → Cu(OH)2↓ + Na2SO4 |
||
образуют осадок. Они не могут вместе находиться |
|||
в растворе (мгновенно образуют молекулу осадка). |
Cu2+ + SO42- + 2 Na+ + 2 OH- → Cu(OH)2↓ + 2 Na+ + SO42- |
||
|
|
Cu2+ + 2 OH- → Cu(OH)2↓ |
|
2. Один из продуктов реакции – газ |
↑ |
Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2↑ |
|
Участниками реакции являются те ионы, |
CO2 |
2 Na+ + CO32- + 2 H+ + 2 Cl- → 2 Na+ + 2 Cl- + H2O + CO2↑ |
|
|
CO32- + 2 H+ → H2O + CO2↑ |
||
которые образуют газ или газ и воду. |
SO2 |
Na2SO3 + 2 HCl → 2 NaCl + H2O + SO2↑ |
|
|
|||
Они также не живут в растворе вместе. |
|
2 Na+ + SO32- + 2 H+ + 2 Cl- → 2 Na+ + 2 Cl- + H2O + SO2↑ |
|
|
|
SO32- + 2 H+ → H2O + SO2↑ |
|
|
H2S |
Na2S + 2 HCl → 2 NaCl + H2S↑ |
|
|
|
2 Na+ +S2- + 2 H+ + 2 Cl- → 2 Na+ + 2 Cl- + H2S↑ |
|
|
|
S2- + 2 H+ → H2S↑ |
|
|
NH3 |
NH4Cl + NaOH → NaCl + NH3↑ + H2O |
|
|
NH4+ + Cl- + Na+ + OH- → Na+ + Cl- + NH3↑ + H2O |
||
|
|
NH4+ + OH- → NH3↑ + H2O |
|
3. Один из продуктов реакции - вода |
H2O |
2 KOH + H2SO4 → K2SO4 + 2 H2O |
|
|
|
2 K+ + 2 OH- + 2 H+ + SO42- → 2 K+ + SO42- + 2 H2O |
|
Участниками реакции являются ионы, образующие |
OH- + H+ → H2O |
|
|
Н2О, то есть, Н+ и ОН- |
|
NaHCO3 + NaOH → Na2CO3 + H2O |
|
(иногда участников бывает больше) |
|
||
|
Na+ + (HCO3)- + Na+ + OH- → 2 Na+ + CO32- + H2O |
||
|
|
(HCO3)- + OH- → H2O + CO32- |
|
или другой слабый электролит (CH3COOH) |
CH3COONa + HCl → CH3COOH + NaCl |
||
|
|
CH3COO- + Na+ + H+ + Cl- → CH3COOH + Na+ + Cl- |
|
Участниками реакции являются ионы, образующие |
CH3COO- + H+ → CH3COOH |
||
молекулу слабого электролита. |
|
|
|
|
Классификация неорганических веществ |
А7, В1 |
|
|
|
ВЕЩЕСТВА |
|
Сложные |
|
Растворимые в воде: NH4OH |
Простые |
|
|
|
|
|
Щелочи: KOH, NaOH, Ba(OH)2, Ca(OH)2 – изв.вода |
|
|
|
|
|
Металлы |
Основания |
Нерастворимые в воде: Cu(OH)2, Mg(OH)2, Fe(OH)2 |
Na, Mg, Fe, Ca, Cu, Cs, Cr |
|
|
|||
|
|
Бескислородные кислоты |
Неметаллы |
|
|
HCl, HI, HBr, H2S, HCN |
S, C, P, H2, Cl2, O2, N2 |
Кислоты |
|
Кислородсодержащие кислоты |
|
|
|
|
|
|
HNO3, HNO2, H2SO4, H2SO3, H3PO4, HClO4, HClO3, H2CrO4 |
Благородные (инертные) |
|
|
|
|
|
Амфотерные гидроксиды |
|
|
газы: He, Ar, Ne |
|
Гидроксиды |
|
|
Zn(OH)2 или H2ZnO2 |
|
|
|
Al(OH)3 или H3AlO3, HAlO2 |
|
|
|
Fe(OH)3, Cr(OH)3, Be(OH)2 |
|
|
|
|
|
Несолеобразующие |
Основные |
|
|
CO, NO, N2O, SiO, Н2О |
|
|
|
|
Na2O, CaO, MgO, CuO, FeO, CrO |
Оксиды |
|
Солеобразующие |
Кислотные |
|
|
|
|
|
|
|
SO2, SO3, P2O5, CO2, N2O5, N2O3, NO2, CrO3 |
|
Средние |
Na2SO4, NH4Cl, CuCl2, CaCO3, KClO3 |
Амфотерные |
|
|
|
ZnO, Al2O3, BeO, Cr2O3, Fe2O3, Н2О |
|
Кислые KHSO4, Na2HPO4, NaH2PO4, NH4H2PO4 |
|
|
|
Основные FeOHCl, Cu(OH)NO3, Al(OH)2Cl |
|
|
Соли |
|
|
|
|
Комплексные Na[Al(OH)4], K4[Fe(CN)6] |
|
|
|
Двойные KMgCl3 или KCl•MgCl2 |
|
|
Важнейшие кислоты и их соли
Формула кислоты |
Название кислоты |
Название кислотных остатков |
Примеры солей |
||
|
|
|
|
|
|
HF |
Фтороводородная (плавиковая) |
F- |
|
фторид |
NaF, CaF2, AlF3 |
HCl |
Хлороводородная (соляная) |
Cl- |
|
хлорид |
KCl, BaCl2, CrCl3 |
HBr |
Бромоводородная |
Br- |
|
бромид |
NH4Br, MgBr2, FeBr3 |
HI |
Иодоводородная |
I- |
|
иодид |
NaI, CuI2, AlI3 |
|
|
|
|
|
|
H2S |
Сероводородная |
S2- |
|
сульфид |
K2S, CuS, Al2S3 |
|
|
(HS)- |
гидросульфид |
KHS, NH4HS, NaHS |
|
H2SO3 |
Сернистая |
SO3)2- |
|
сульфит |
Na2SO3, CaSO3 |
|
|
(HSO3)- гидросульфит |
NaHSO3, KHSO3 |
||
H2SO4 |
Серная |
(SO4)2- |
|
сульфат |
Cs2SO4, BaSO4, Al2(SO4)3 |
|
|
(HSO4)- гидросульфат |
NaHSO4, NH4HSO4 |
||
|
|
|
|
|
|
HNO3 |
Азотная |
(NO3)- |
|
нитрат |
LiNO3, Sr(NO3)2, Fe(NO3)3 |
HNO2 |
Азотистая |
(NO2)- |
|
нитрит |
KNO2, NH4NO2, Ca(NO2)2 |
|
|
|
|
|
|
H3PO4 |
Фосфорная (ортофосфорная) |
(PO4 )3- |
|
фосфат |
Na3PO4, Ca3(PO4)2, AlPO4 |
|
|
(HPO4 )2- гидрофосфат |
Na2HPO4, MgHPO4 |
||
|
|
(H2PO4)- дигидрофосфат |
NaH2PO4, Ba(H2PO4)2 |
||
|
|
|
|
|
|
H2CO3 |
Угольная |
(CO3)2- |
|
карбонат |
K2CO3, CaCO3, (NH4)2CO3 |
|
|
(HCO3)- гидрокарбонат |
KHCO3, Ca(HCO3)2 |
||
H2SiO3 |
Кремниевая |
(SiO3)2- |
|
силикат |
Na2SiO3, BaSiO3 |
|
|
|
|
||
HClO4 |
Хлорная |
(ClO4)- перхлорат |
NaClO4 |
||
HClO3 |
Хлорноватая |
(ClO3)- |
|
хлорат |
KClO3 |
HClO2 |
Хлористая |
(ClO2)- |
|
хлорит |
KClO2 |
HClO |
Хлорноватистая |
(ClO)- |
гипохлорит |
NaClO, Ca(ClO)2 |
|
|
|
|
|
||
H2CrO4 |
Хромовая |
(CrO4)2- хромат |
Na2CrO4 |
||
HMnO4 |
Марганцовая |
(MnO4)- перманганат |
KMnO4 |
||
|
|
|
|
|
|
HCOOH |
Муравьиная (метановая) |
(HCOO)- |
формиат |
HCOO Na |
|
CH3COOH |
Уксусная (этановая) |
(CH3COO)- |
ацетат |
(CH3COO)2 Ca |
|

|
|
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ |
|
|
|
|
|
|
|
А8, |
В5, |
С2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
металл |
Na, Li, K |
Ca, Ba Mg |
|
Al |
|
|
Fe, Cr |
|
|
Cu |
|||||||
с кем? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2 |
→ NaH, LiH, KH |
→ CaH2, BaH2, MgH2 |
|
- |
|
|
- |
|
|
|
- |
|
|
|
|
||
|
(гидриды) |
(гидриды) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2 |
→ оксид Li2O |
→ CaO, BaO (BaO2), |
|
→ Al2O3 |
|
|
t |
|
|
t |
|
! не окисляются |
|||||
|
пероксиды: Na2O2, K2O2 |
MgO |
|
|
|
|
|
→Fe3O4(Fe2O3•FeO), |
→CuO |
|
|||||||
|
|
|
|
|
|
Cr2O3 |
|
|
|
|
|
Ag, Pt, Au |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Металлы |
- |
- |
|
М о г у т |
о б р а з о в ы в а т ь |
с п л а в ы |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Неметаллы: |
→ |
→ |
|
t |
|
|
t |
|
|
|
t |
||||||
Галогены |
NaCl, LiF, KBr …. |
CaBr2, BaCl2, MgBr2 … |
|
→ |
|
|
→ |
|
|
|
→ CuCl2 |
||||||
|
AlCl3 |
|
|
FeCl3, CrCl3 |
|
t |
|||||||||||
Сера |
Na2S, Li2S, K2S …. |
t |
|
Al2S3 |
|
|
FeS, Cr2S3 |
|
→ CuS |
||||||||
Фосфор |
Na3P, Li3P, K3P …. |
→ CaS, BaS, MgS |
|
AlP |
|
|
Fe2N |
|
|
|
- |
|
|
|
|
||
Ca3P2, Ba3P2, Mg3P2 |
|
|
|
|
|
|
|
|
|
|
|||||||
Азот |
Na3N, Li3N, K3N …. |
Ca3N2, Mg3N2 |
|
AlN |
|
|
Fe3C (при t 1600 °C) |
|
- |
|
|
|
|
||||
Углерод, кремний |
t |
CaC2 |
|
Al4C3 |
|
|
FeSi2 (сплавл.) |
|
- |
|
|
|
|
||||
|
→Na4Si (сплавл.), Na4C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вода |
→ Me(OH) + H2↑ |
→ Me(OH)2 + H2↑ |
|
t |
|
|
t |
Cr2O3+H2↑ |
|
- |
|
|
|
|
|||
|
|
→ MgO + H2↑ |
|
→Al(OH)3 + H2↑ или Al2O3+H2↑ |
|
|
→ Fe3O4+H2↑; |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные оксиды |
- |
t |
|
- |
|
|
- |
|
|
|
- |
|
|
|
|
||
|
|
2 Mg + SiO2→ Si + 2 MgO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 Mg + CO2 → C + 2 MgO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные оксиды |
- |
- |
|
Алюмотермия |
|
- |
|
|
|
- |
|
|
|
|
|||
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 Al + Fe2O3 → 2 Fe + Al2O3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислоты: |
_ |
Ca + 2HCl → CaCl2 + H2↑ |
|
2Al+6HCl → 2AlCl3 + 3H2↑ |
|
|
Cr+ 2HCl → CrCl2 + H2↑ |
|
_ |
|
|
|
|
||||
HCl, H2SO4 (разб.) |
|
|
|
|
|
|
|
|
|||||||||
|
|
Mg+ H2SO4 → MgSO4 + H2↑ |
|
2Al+3H2SO4 →Al2(SO4)3 +3H2↑ |
|
|
Fe + H2SO4 → FeSO4 + H2↑ |
|
|
|
|
|
|
|
|||
H2SO4 (конц.) |
|
|
|
|
. |
|
|
|
|
|
|||||||
→Me2SO4 + H2S↑ + H2O |
→ MgSO4 + H2S↑ + H2O |
|
Без нагревания - пассивация |
|
|
|
. |
→ CuSO4 + SO2↑ + H2O |
|||||||||
|
|
Без нагревания - пассивация |
|||||||||||||||
|
|
||||||||||||||||
|
|
|
|
t |
|
|
t |
|
|
|
|
|
|
|
|
|
|
HNO3 (разб.) |
|
|
|
→ Al2(SO4)3 + SO2↑+ H2O |
|
|
→ Fe2(SO4)3 + SO2↑+ H2O |
|
|
|
|
|
|
|
|||
|
|
|
→ Al(NO3)3 + NO↑ + H2O |
|
|
|
→ Fe(NO3)3 + NO↑ + H2O |
→ Cu(NO3)2 + NO↑ + H2O |
|||||||||
|
→ MeNO3 + NH4NO3 + H2O |
→ Me(NO3)2 + N2O↑ + H2O |
|
|
|
|
|||||||||||
|
|
Без нагревания - пассивация |
. |
|
|
|
|
|
|
|
|
||||||
HNO3 (конц.) |
|
|
|
Без нагревания - пассивация |
. |
→ Cu(NO3)2 + NO2↑ + H2O |
|||||||||||
|
|
|
t |
|
|
t |
|
|
|||||||||
|
|
|
|
→ Al(NO3)3 + NO2↑+ H2O |
|
|
→ Cr(NO3)3 + NO2↑+ H2O |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Основания (щелочи) |
_ |
_ |
|
В растворе:→ Na[Al(OH)4] +H2 |
|
_ |
|
|
|
_ |
|
|
|
||||
|
|
|
|
В расплаве:→ NaAlO2 +H2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Соли |
_ |
_ |
|
Более активный металл (стоящий в ряду активностей левее) вытесняет менее активный. |
|||||||||||||
|
|
|
|
Fe + CuSO4 → Cu + FeSO4; |
Cu + FeSO4 → реакция не идет |
||||||||||||

|
|
ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ |
|
|
А8, |
В5, |
С2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|||
неметалл |
H2 |
O2 |
F2, |
Cl2 |
S |
N2, |
P |
C, |
Si |
|||
с кем? |
|
|
|
|
|
|
|
|
|
|
|
|
|
_ |
→ H2O |
→ HF, HCl |
→ H2S |
→ NH3 |
- |
t |
- |
|
|
||
H2 |
|
|
|
|
|
|
|
→ CH4 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
→ H2O |
_ |
→ OF2 |
--- |
→ SO2 |
→ NO |
P2O3 |
t |
SiO2 |
|||
O2 |
|
|
! Остальные галогены с |
|
|
P2O5 |
→CO2 |
|||||
|
|
|
кислородом не реагируют |
|
|
|
|
|
|
|
|
|
|
→ NaH, CaH2 … |
→MexOy |
→ NaF |
|
→ Na2S |
→ Li3N |
|
t |
|
|
|
|
Металлы |
|
|
|
t |
t |
|
Ca3P2 |
→ CaC2 |
|
|
|
|
|
|
|
|
|
Mg2Si |
|||||||
|
|
|
|
→ CuCl2 |
→ FeS |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
→ H2S, NH3, CH4 |
→ SO2, NO, CO2, |
→ ICl, IBr, SCl2 |
→ SF6, SCl2, CS2 |
→ PCl3, PCl5, P2S3 |
t |
|
|
|
|||
Неметаллы |
….. |
P2O5, SiO2 … |
|
|
|
|
|
→ SiC, SiF4, CS2 |
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
_ |
_ |
→ HF + O2 |
_ |
_ |
|
t |
|
|
|
||
Вода |
|
|
→ HCl + HClO |
|
|
|
С+ H2O → СО + Н2 |
|||||
|
|
|
|
|
Si + H2O → не идет |
|||||||
|
_ |
t |
|
_ |
_ |
_ |
|
t |
|
|
|
|
Кислотные оксиды |
|
2SO2 + O2 → 2SO3 |
|
|
|
|
|
SiO2 + 2C→ Si + 2CO |
||||
|
|
|
|
|
|
|
P2O5 + 5C → 2P + 5CO |
|||||
|
t |
|
|
_ |
_ |
_ |
|
t |
|
|
|
|
Основные оксиды |
CuO + H2 → Cu + H2O |
|
|
|
|
|
|
C + CuO→ Cu + CO |
||||
|
|
|
|
|
|
|
|
3С +CaО → СаС2 + СО |
||||
|
|
недост |
|
|
|
|
|
|
|
|
|
|
Кислоты: |
|
H2S +O2 → S +H2O |
|
|
S + H2SO4 (конц.) → SO2 |
P + H2SO4 (конц.) → |
C + H2SO4 (конц.) → SO2 |
|||||
|
изб. |
|
|
|||||||||
Конц. H2SO4 |
|
|
|
+ H2O |
H3PO4 + SO2 + H2O |
+ CO2 + H2O |
|
|
|
|||
|
H2S +O2 →SO2 +H2O |
|
|
|
|
|
||||||
Конц. HNO3 |
_ |
_ |
I2 + HNO3(конц.) → HIO3 |
S + HNO3 (конц.) → |
P + HNO3 (конц.) → |
C + HNO3 (конц.) → CO2 |
||||||
|
|
|||||||||||
|
|
+ NO + H2O |
H2SO4 + NO2 + H2O |
H3PO4 + NO |
|
+ NO2 + H2O |
|
|
|
|||
|
|
|
|
|
|
(NO2) |
Si + HF → SiF4 + 2 H2 |
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH3 + O2 → N2 + H2O |
(Br2,I2) |
|
|
|
|
|
|
|
|
|
Основания |
_ |
кат. |
Cl2 + NaOH → NaCl + |
S + NaOH → Na2S + |
P + NaOH + H2O → |
Si + NaOH + H2O → |
||||||
(щелочи) |
|
NH3 + O2→ NO + H2O |
NaClO + H2O |
Na2SO3 + H2O |
PH3 + NaH2PO2 |
Na2SiO3 + H2↑ |
|
|
|
|||
|
|
Fe(OH)2 +O2→ Fe(OH)3 |
(при t - NaClO3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_ |
t |
FeCl2 + Cl2 → FeCl3 |
_ |
t |
|
_ |
|
|
|
||
Соли |
|
FeS + O2→ Fe2O3 + SO2 |
NaBr + Cl2 → NaCl+Br2 |
|
P + KClO3 → KCl + |
|
|
|
|
|
||
|
|
|
|
|
|
P2O5 |
|
|
|
|
|
|
