
minikurs
.pdf
H2SO4 – концентрированная серная кислота
I. С металлами
Cu + 2 H2SO4 (конц.) → CuSO4 + SO2 + 2 H2O
! Fe, Cr, Al - пассивация без нагревания
t
2 Fe + 6 H2SO4 (конц.) → Fe2 (SO4)3 + 3 SO2 + 6 H2O
t
2 Cr + 6 H2SO4 (конц.) → Cr2(SO4)3 + 3 SO2 + 6 H2O
t
2 Al + 6 H2SO4 (конц.) → Al2(SO4)3 + 3 SO2 + 6 H2O
Zn + 2 H2SO4 (конц.) → ZnSO4 + SO2 + 2 H2O
3 Zn + 4 H2SO4(конц.) → 3 ZnSO4 + S + 4 H2O уменьшение концентрации кислоты
4 Zn + 5 H2SO4(конц.) → 4 ZnSO4 + H2S + 4 H2O
4 Mg + 5 H2SO4 (конц.) → 4 MgSO4 + H2S + 4 H2O
8 Na + 5 H2SO4 (конц.) → 4 Na2SO4 + H2S + 4 H2O
4 Ca + 5 H2SO4(конц.) → 4 CaSO4 + H2S + 4 H2O
2 Li + 2 H2SO4 (конц.) → Li2SO4 + SO2 + 2 H2O
II. С неметаллами
t
C + 2 H2SO4 (конц.) →CO2 + 2 SO2 + 2 H2O
t
S + 2 H2SO4 (конц.) →3 SO2 + 2 H2O
t
2 P + 5 H2SO4 (конц.) →2 H3PO4 + 5 SO2 + 2 H2O
III.
t
H2S + 3 H2SO4 (конц.) →4 SO2 + 4 H2O
|
|
|
|
|
|
|
|
|
ОВР углеводородов |
|
С3 |
||||||
KMnO4 |
|
|
|
Mn+2 (MnSO4) |
- в кислой среде |
|
|
||||||||||
|
|
|
+4 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
MnO2 |
- внейтральной среде |
|
|
||||||
|
|
|
|
|
|
|
|
+6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K2MnO4 |
- в щелочной среде |
|
|
||||||
-2 |
|
|
-2 |
|
+7 |
-1 -1 |
+4 |
|
|
||||||||
1) 3 CH2=CH2 + 2 KMnO4 + 4 H2O → 3 HO-CH2-CH2-OH + 2 MnO2 + 2 KOH |
|||||||||||||||||
|
|
↓ |
|
↓ |
|
↑ |
|
|
|
|
|
|
|
|
|
||
|
|
1ē |
2 |
1ē |
|
3ē |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-1 |
-2 |
+7 |
0 |
-1 |
+4 |
|
||||||
2) 3 CH3-CH=CH2 + 2 KMnO4 + 4 H2O → 3 CH3-CH(OH)-CH2(OH) + 2 MnO2 + 2 KOH |
|||||||||||||||||
|
|
|
|
|
↓ |
↓ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1ē |
1ē |
3ē |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
3) -1 |
-2 |
|
|
0 |
|
-1 |
|
|
|||||||||
|
|
|
|
CH=CH2 |
|
|
|
|
|
|
CH(OH)-CH2(OH) |
|
|
||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
3 |
|
|
|
|
|
|
+ 2 KMnO4 + 4 H2O → |
3 |
|
|
|
|
|
+ 2 MnO2 |
+ 2 KOH |
||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
↓↑
2ē 3ē
|
-1 |
-1 |
+7 |
|
|
|
|
|
+3 |
+2 |
||||
4) |
5 CH3-CH=CH-CH3 + 8 KMnO4 + 12 H2SO4 → 10 CH3COOH + 8 MnSO4 + 4 K2SO4 + 12 H2O |
|||||||||||||
|
|
|
|
↓ |
↓ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
4ē |
4ē |
5ē |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
-1 |
|
-2 |
+7 |
+3 |
+4 |
+2 |
|||||||
5) |
CH3-CH=CH2 + 2 KMnO4 + 3 H2SO4 → CH3COOH + CO2 + 2 MnSO4 + K2SO4 + 4 H2O |
|||||||||||||
|
|
|
↓ |
↓ |
↑ |
|
|
|
|
|
|
|
||
|
|
|
4ē |
6ē |
5ē |
|
|
|
|
|
|
|
||
|
10 |
|
|
|
|
|
|
|
|
|||||
6) |
-3 |
|
|
|
+3 |
|
|
|
||||||
|
5 |
|
|
CH3 |
+ 6 KMnO4 + 9 H2SO4 → 5 |
|
|
|
COOH |
+ 6 MnSO4 + 3 K2SO4 + 14 H2O |
||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
↓↑
6ē 5ē
-2 |
-3 |
+7 |
+3 |
+4 |
+2 |
7) 5 C6H5-CH2-CH3 + 12 KMnSO4 + 18 H2SO4 → 5 C6H5-COOH + 5 CO2 + 12 MnSO4 + 6 K2SO4 + |
|||||
↓ |
↓ |
↑ |
|
|
28 H2O |
5ē |
7ē |
5ē |
|
|
|
|
12 |
|
|
|
|

-1 -1 +7 +3 +3 +2
8) 5 |
↓ |
+ 8 KMnO4 + 12 H2SO4 → 5 HOOC-COOH + 8 MnSO4 + 4 K2SO4 + 12 H2O |
||||
↓ |
|
↑ |
|
|
|
|
4ē |
4ē |
|
5ē |
|
|
|
|
8 |
|
|
|
|
|
|
0 |
-1 |
+7 |
+3 |
+4 |
+2 |
9) 5 + 8 KMnO4 + 12 H2SO4 → 5CH3COOH + 5CO2 + 8 MnSO4 + 4 K2SO4 + 12 H2O
+ 8 KMnO4 + 12 H2SO4 → 5CH3COOH + 5CO2 + 8 MnSO4 + 4 K2SO4 + 12 H2O
↓ |
↓ |
↑ |
|
|
|
3 |
5 |
5 |
|
|
|
|
8 |
|
|
|
|
0 |
-1 |
+7 |
+3 |
+4 |
+6 |
10)  + 8 KMnO4 + 11 KOH → CH3COOK + K2CO3 + 8 K2MnO4 + 6 H2O
+ 8 KMnO4 + 11 KOH → CH3COOK + K2CO3 + 8 K2MnO4 + 6 H2O
↓ |
↓ |
↑ |
|
|
|
3 |
5 |
1 |
|
|
|
8 |
|
|
|
|
|
0 |
-1 |
+7 |
+3 |
+4 |
+4 |
11)3 + 8 KMnO4 + H2O → 3 CH3COOK + 3 KHCO3 + 8 MnO2 + 2 KOH
+ 8 KMnO4 + H2O → 3 CH3COOK + 3 KHCO3 + 8 MnO2 + 2 KOH
↓ |
↓ |
↑ |
|
3 |
5 |
3 |
|
|
8 |
|
|
-3 |
+7 |
+3 |
+6 |
12)C6H5-CH3 + 6 KMnO4 + 7 KOH → C6H5-COOK + 6 K2MnO4 + 5 H2O
↓↑
6 1
13)
H3C |
|
|
CH-CH3 |
|
|
|
|
COOH |
|||
|
|
|
|
|
|||||||
5 |
|
|
|
|
|
+ 18KMnO4 + 27H2SO4 → 5 |
|
|
|
|
+10 CO2 +18 MnSO4 + 9K2SO4 + 42H2O |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
14)
H3C CH-CH3 OH
|
|
|
|
|
|
кат. |
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
+ O2 → |
|
|
|
|
|
||||
|
|
|
|
CH3 |
|
|
|
|
COOH |
||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
CH3 |
|
|
|
|
|
COOH |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||
15) 5 |
|
|
|
|
|
+ 12 KMnO4 + 18 H2SO4 |
→ 5 |
|
|
|
|
+ 12 MnSO4 + 6 K2SO4 + 28 H2O |
|||
|
|
|
|
|
|
|
|
|
|||||||
ГИДРОЛИЗ |
А24, |
|
В4 |
Гидролиз – это реакции обменного разложения веществ водой.
Гидролизу подвергаются различные вещества: неорганические – соли, карбиды и гидриды металлов, галогениды неметаллов; органические – галогеналканы, сложные эфиры, жиры, ди-и полисахариды, белки.
Во всех случаях, кроме солей, при гидролизе происходит полное разложение сложного вещества на составляющие и их обмен с H+ и OH- из воды (HOH):
Al4C3 + 12 HOH → 4 Al (OH)3 ↓+ 3 CH4↑
NaH + HOH → NaOH + H2↑ неорганические вещества
PCl3 + 3 HOH → 3 HCl + H3PO3
C2H5Cl + HOH → C2H5OH + HCl
CH3COOCH3 + HOH → CH3COOH + CH3OH
органические вещества
+ 
(C6H10O5) n + n H2O → n C6H12O6
Гидролиз солей
Не подвергаются гидролизу |
|
Соли, подвергающиеся гидролизу |
||
С + С |
С + Сл |
|
Сл + С |
Сл + Сл |
(соль образована сильным |
(соль образована сильным |
|
(соль образована слабым |
(соль образована слабым |
основанием и сильной |
основанием и слабой |
|
основанием и сильной |
основанием и слабой |
кислотой) |
кислотой) |
|
кислотой) |
кислотой) |
- |
По аниону |
|
По катиону |
По катиону и аниону |
Среда -нейтральная |
Среда - щелочная |
|
Среда - кислотная |
Среда - нейтральная |
NaCl |
Na2S |
|
AlCl3 |
Al2S3 |
ПРАВИЛО:
ГИДРОЛИЗ ИДЕТ ПО ТОМУ, ЧТО СЛАБОЕ (по катиону или по аниону), А СРЕДА (кислая или щелочная) ОПРЕДЕЛЯЕТСЯ ПО ТОМУ, ЧТО СИЛЬНОЕ.
Гидролиз по аниону:
Na2S ↔ 2 Na+ + S2-
S2- + HOH → (HS)- + OH- Na2S + HOH → NaHS + NaOH
Гидролиз по катиону:
AlCl3 ↔ Al3+ + 3 Cl-
Al3+ + HOH → (AlOH)2+ + H+ AlCl3 + HOH → AlOHCl2 + HCl
Гидролиз по катиону и аниону:
Al2S3 + 6 HOH → 2 Al (OH)3↓ + 3 H2S↑
2 Al3+ + 3 S2- + 6 HOH → 2 Al (OH)3↓ + 3 H2S↑
Среда - щелочная
Среда - кислотная
Среда - нейтральная
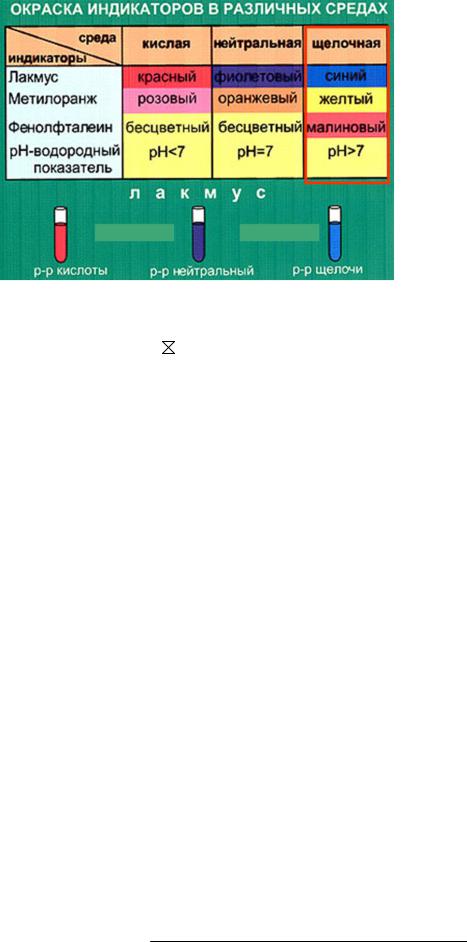
рН |
< 7 |
7 |
> 7 |
кислая |
нейтральная |
щелочная |
Среда растворов кислых солей
Среда растворов кислых солей бывает не только кислой, но и щелочной. Это объясняется одновременным протеканием двух процессов – электролитической диссоциации и гидролиза. За счет диссоциации в растворах кислых солей появляются катионы водорода, а за счет гидролиза– гидроксиданионы.
Если константа диссоциации >, чем константа гидролиза, то среда кислотная: NaHSO3 Если больше константа гидролиза, то щелочная: NaHCO3, NaHS
В гидрофосфатах: NaH2PO4 - кислотная, Na2HPO4 – щелочная.
Сильные и слабые кислоты и основания
Сильные |
Слабые |
|
|
Неорганические кислоты: |
Неорганические кислоты: |
HCl, HBr, HI |
HF, H2S, HCN |
HNO3, H2SO4, HClO4, HClO3 |
HNO2, H2SO3, H3PO4, H2CO3 |
HMnO4, H2CrO4, H2Cr2O7 |
HClO2, HClO, H2SiO3 |
|
|
Щелочи: |
Амфотерные гидроксиды: |
KOH, LiOH, NaOH, RbOH, CsOH, Ba(OH)2 |
Zn(OH)2, Al(OH)3, Be(OH)2, Cr(OH)3 и др. |
|
|
Ca(OH)2 – известковая вода |
Нерастворимые основания: |
Sr(OH)2 - стронциевая вода |
Mg(OH)2, Cu(OH)2, Fe(OH)2 и т.д. |
|
Другие: |
|
NH4OH, (CH3NH3)OH – гидроксиды аммония |
|
Органические кислоты: |
|
HCOOH, CH3COOH, HOOC-COOH (щавелевая) |
|
C6H5OH (карболовая), C6H2OH(NO2)3 (пикриновая) |
|
|
ЭЛЕКТРОЛИЗ |
В3 |
Электролиз – это окислительно-восстановительные реакции под действием электрического
тока.
Подвергаются электролизу расплавы или растворы электролитов.
На катоде разряжается катион (катион принимает электроны) – это восстановление. На аноде разряжается анион (анион отдает электроны) – это окисление.
ЭЛЕКТРОЛИЗ РАСПЛАВОВ СОЛЕЙ
Это просто разложение молекул солей (как правило, берут соли с безкислородными анионами) на металл и неметалл. На катоде получаются металлы, на аноде – неметаллы.
эл.ток |
Cu + Cl2 |
|
CuCl2 → |
|
|
эл.ток |
2 Na + F2 |
! активный металл и фтор получают только из расплавов |
2 NaF → |
||
эл.ток |
2 Al + 3 Cl2 |
|
2 AlCl3 → |
|
Иначе подвергаются электролизу расплавы солей органических кислот:
|
|
|
|
|
|
|
эл.ток |
|
2 Na + C2H6 + 2 CO2 |
|
|
|
|
|||
|
|
|
|
|
2 CH3COONa → |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
на катоде |
на аноде |
|
|
|
|
|||
|
|
|
|
|
ЭЛЕКТРОЛИЗ РАСТВОРОВ СОЛЕЙ |
|
|
|
|
|||||||
|
|
|
|
|
эл.ток |
|
|
|
|
|
эл.ток |
|
|
|
|
|
Участники электролиза: соль КА → К+ + А- и вода НОН → Н+ + ОН- |
|
|
||||||||||||||
На катоде разряжается или К+, или Н+, на аноде – А- или ОН- |
|
|
|
|
||||||||||||
Рассмотрим 4 случая: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
ΙV |
|
|
|
|
ΙΙI |
|
|
|
|
|
ΙΙ |
|
|
|
I |
|
Na2SO4 |
|
|
NaCl |
|
|
|
CuSO4 |
|
CuCl2 |
|||||||
На катоде |
|
На аноде |
На катоде |
На аноде |
|
На катоде |
|
На аноде |
|
На катоде |
|
На аноде |
||||
- |
|
- |
|
|
- |
анион |
|
катион |
|
- |
|
катион |
|
анион |
||
Только НОН, |
|
|
Н+ из |
|
- |
|
|
- |
|
ОН- из |
|
НОН, |
||||
а соль не участвует |
|
воды |
|
|
|
|
|
|
воды |
|
не участвует |
|||||
H2 |
|
O2 |
|
|
H2 |
|
Cl2 |
|
Cu |
|
O2 |
|
Cu |
|
Cl2 |
|
|
|
|
|
|
|
|
||||||||||
В электролизере |
|
В электролизере |
|
В электролизере |
|
В электролизере |
||||||||||
H2SO4 + NaOH |
|
NaOH |
|
|
|
H2SO4 |
|
|
- |
|||||||
На катоде: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
катионы очень активных металлов |
металлов средней активности |
|
неактивных металлов |
||||||||||||
|
|
Li, K, Ca, Na, Rb, |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Cs, Ba, Sr, Mg, Al |
|
Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb |
Cu, Hg, Ag, Pt, Au |
|||||||||||
|
|
↓ (не восстанавливаются) |
|
|
|
↓ |
|
|
|
|
↓ |
|
|
|||
Получаются: |
Только H2 |
|
|
и металл, и H2 |
|
только металл |
||||||||||
|
|
(активный металл получают |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
электролизом расплавов) |
|
|
|
|
|
|
|
|
|
|
|
|||
На аноде: |
анионы: |
|
|
|
|
|
|
анионы: |
|
|
|
|
||||
|
|
I-, Br-, S2-, Cl- |
|
|
|
F-, |
OH-, SO42-, NO3- |
и все кислородсодержащие анионы |
||||||||
|
|
↓ |
↓ |
↓ |
↓ |
|
|
|
↓ |
|
|
↓ |
|
|
|
неорганические |
|
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
|
|
|
Получаются: |
I2, |
Br2, |
S, |
Cl2 |
|
|
|
|
|
O2 |
|
|
|
|
||
|
|
|
|
|
|
|
(F2 |
получают |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
электролизом расплавов) |
|
|
|
|
|
|
||||
Инертные аноды: угольный (графит), платиновый. Активные – медный, серебряный.
УРАВНЕНИЯ РЕАКЦИЙ ЭЛЕКТРОЛИЗА РАСТВОРОВ СОЛЕЙ

УРАВНЕНИЯ РЕАКЦИЙ ЭЛЕКТРОЛИЗА СОЛЕЙ |
|||||
эл-з |
|
|
На катоде: Cu2+ + 2ē → Cu0 |
||
I. CuCl2 → Cu + Cl2 |
|
|
|||
|
|
|
На аноде: 2 Cl- - 2ē → Cl2 |
||
эл-з |
|
|
|
|
|
II. 2 CuSO4 + 2 H2O → 2 Cu + O2 + 2 H2SO4 |
На катоде: Cu2+ + 2ē → Cu0 |
||||
|
|
|
|||
|
|
|
На аноде: |
4OH- - 4ē → O2 + 2H2O |
|
эл-з |
+ Cl2 |
+ 2 NaOH |
|
|
|
III. 2 NaCl + 2 H2O → H2 |
На катоде: |
2H+ + 2ē → H2 |
|||
|
|
|
|||
|
|
|
На аноде: |
|
2 Cl- - 2ē → Cl2 |
эл-з |
|
+ NaOH + H2SO4 |
Идет только электролиз H2O, |
||
IV. Na2SO4 + H2O → H2 + O2 |
|||||
|
|
↓ |
соль в процессе не участвует. |
||
|
|
Na2SO4 + H2O |
|
|
|
Проще: |
|
|
На катоде: 2 H2O + 2ē → H2 + 2 OH- |
||
эл-з |
|
|
На аноде: |
2 H2O - 4ē → O2 + 4 H+ |
|
2 H2O → 2 H2 + O2 |
|
|
|||
V. Электролиз раствора соли органической кислоты: |
|
|
эл-з |
|
+ 2 NaOH |
2 CH3COONa + 2 HOH → H2 + C2H6 + 2 CO2 |
||
↓ |
|
↓ |
на катоде |
на аноде |
в электролизере |
|
|
|
|
|
|
|
|
ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ |
|
А4 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
В Н У Т Р И М О Л Е К У Л Я Р Н Ы Е |
|
МЕЖМОЛЕКУЛЯРНЫЕ |
|||||||
|
|
|
|
К О В А Л Е Н Т Н Ы Е |
|
|
|
ИОННАЯ |
МЕТАЛЛИЧЕСКАЯ |
ВОДОРОДНАЯ |
|||||
НЕПОЛЯРНАЯ |
|
ПОЛЯРНАЯ |
|
ДОНОРНО- |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
АКЦЕПТОРНАЯ |
|
|
|
|
|
|
|
H2, Cl2, O2, N2, I2 … |
|
HCl, HI, HBr |
|
Ион аммония [NH4]+ |
|
Оксиды металлов: |
Металлы: |
H2O, HF, NH3 |
|||||||
O3, P4 |
|
NH3, PH3, H2S … |
|
в солях аммония и |
|
|
Na2O, K2O, Li2O |
|
|
|
|
||||
|
|
|
|
|
|
CH4, C2H4, C6H6 |
|
аминов |
|
|
BaO, CaO, MgO … |
Li, Na … |
|
|
|
|
|
|
|
|
|
и все углеводороды |
|
|
|
|
|
Be, Mg, Ca … |
|
|
|
|
|
|
|
|
|
Амины: CH3NH2 … |
|
|
|
|
|
Al, Zn, Cu … |
|
|
|
C-C |
|
H2O, CO2, NO2 … |
|
Ион гидроксония |
|
|
Бинарные соединения: |
Fe, Cr, Mn … |
Спирты, фенолы, |
||||||
|
|
|
|
|
|
|
|
(H3O)+ |
|
|
NaH, Na3N, CaC2, Ca3P2 |
|
карбоновые кислоты |
||
В молекулах типа: |
|
|
|
Все комплексные |
|
|
Гидроксиды металлов: |
|
Амины, аминокислоты, |
||||||
H-O |
|
|
O-H |
|
H2SO4, HNO3, |
|
соединения |
|
|
NaOH, Cu(OH)2, Al(OH)3 |
|
белки, нуклеиновые |
|||
- |
|
|
|
||||||||||||
|
|
|
|
|
|
H3PO4 … |
|
Na[Al(OH)4] |
|
|
Гидроксид аммония: |
|
кислоты |
||
|
|
|
|
|
|
|
|
|
NH4OH, (CH3NH3)OH |
|
|||||
Na-O |
- |
O-Na |
|
|
|
|
|
|
|
|
|
|
|||
|
CH3COOН, C6H5OН, |
|
HNO3,N2O5, нитраты |
|
Соли: |
|
Растворы углеводов |
||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
NaCl, CH3COONa |
|
(моно-и-дисахариды) |
|||
|
|
|
|
|
|
C2H5OН, CH3COН… |
|
|
|
|
|
||||
|
|
|
|
|
|
|
CO, O3 |
|
|
C6H5ONa, C2H5ONa |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH4Cl, (CH3NH3)Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
{Ван-дер-ваальсовое |
||
|
|
|
|
В ОДНОЙ МОЛЕКУЛЕ НЕСКОЛЬКО ТИПОВ СВЯЗЕЙ |
|
притяжение любых |
|||||||||
|
|
|
|
NaOH |
Na2SO4 |
NH4Cl |
Na-O-O-Na |
|
молекул} |
||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
(ионная и |
(ионная и |
(ионная и |
(ионная и ков. |
|
|
|
|
||||
|
|
|
|
ков. полярная) |
ков.полярная) |
ков.полярная) |
|
неполярная) |
|
|
|
|
|||
|
|
|
|
|
|
H-H |
H-Cl |
C = O |
Na+Cl- |
|
…O-H…O-H… |
O = O |
O = C = O |
|
(NH4)+Cl- |
|
H H |
N ≡ N |
C ≡ N |
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ |
|
|
А6 |
|
||
|
|
|
|
|
|
|
|
|
|
|
МОЛЕКУЛЯРНЫЕ |
|
|
Н Е М О Л Е К У Л Я Р Н Ы Е |
|
|
|
|
|
|
|
|
АТОМНАЯ |
|
ИОННАЯ |
|
МЕТАЛЛИЧЕСКАЯ |
||
H2, O2, N2 |
|
C – алмаз и графит |
1) Соли |
|
Металлы: |
||||
F2, Cl2, Br2, I2 |
|
|
NaCl, NH4Cl, Na2SO4, CH3COONa |
|
|
|
|
||
S, S8; P4 (фосфор белый) |
|
Si, SiC, SiO2 |
|
|
|
Li, Na … |
|||
H2O, HCl, H2S, PH3 … |
|
|
2) Оксиды металлов |
|
Be, Mg, Ca … |
||||
H2SO4, H3PO4 … |
B (бор и его соединения) |
Na2O, K2O, CuO, MgO, FeO … |
|
Al, Zn, Cu … |
|||||
C60 (фуллерены) |
|
|
|
|
|
Fe, Cr, Mn … |
|||
CO2, CO, H2CO3 |
|
Р красный |
3) Гидроксиды металлов |
|
|
|
|
||
CH4 |
и все углеводороды |
|
|
NaOH, Mg(OH)2, Fe(OH)3 |
|
|
|
|
|
CH3OH и все спирты |
|
Al2O3 |
|
|
|
|
|
|
|
C6H5OH и фенолы |
|
|
4) Гидроксид аммония и аминов |
|
|
|
|
||
|
|
|
|
NH4OH, (CH3NH3)OH |
|
|
|
|
|
|
и все альдегиды |
|
|
5) Бинарные соединения |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
металлов |
|
|
|
|
|
|
карбоновые кислоты |
|
|
Na3N, CaC2, Mg2Si, NaH, Ca3P2 |
|
|
|
|
|
Углеводы |
|
|
|
|
|
|
|
|
|
Эфиры |
|
|
|
|
|
|
|
|
|
Амины и аминокислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
С В О Й С Т В А |
В Е Щ Е С Т В |
|
|
|
|
||
|
Легкоплавкость |
|
Прочность |
|
Твердость |
|
Ковкость |
||
|
Летучесть |
|
Твердость |
|
Прочность |
|
Пластичность |
||
|
Малая твердость |
|
Высокая Т плавления |
|
Тугоплавкость |
|
Металлический блеск |
||
|
Нестойкость |
|
(тугоплавкость) |
|
Не летучи |
|
Электропроводность |
||
|
Отсутствие |
|
Отсутствие |
|
В растворах и расплавах |
|
Теплопроводность |
||
|
электропроводности |
|
электропроводности |
|
электропроводны |
|
|
|
|
|
|
|
(кроме графита) |
|
|
|
|
|
|
|
|
|
Нерастворимы |
|
|
|
|
|
|

ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ, ВАЛЕНТНОСТЬ, СТЕПЕНЬ ОКИСЛЕНИЯ |
|
|
А5 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ТЕРМИНЫ |
|
|
|
ОБЪЯСНЕНИЕ, |
ФАКТИЧЕСКИЙ МАТЕРИАЛ |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Электроотрицательность |
|
|
Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства: |
|
|
|
|
|||||||||
ЭО – это мера неметалличности, то есть, |
|
|
F > O > Cl > N > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs |
|
|
|
|
|||||||||
свойство атомов элемента оттягивать на себя |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
электроны от атомов других элементов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Валентность |
Валентные возможности атомов определяются: |
|
|
|
|
|
|
|
|
|
|
|||||
|
1) числом неспаренных электронов; 2) наличием свободных орбиталей; 3) наличием неподеленных электронных пар. |
|||||||||||||||
Определяет число химических связей, которыми |
Валентность не имеет знака и не бывает нулевой. |
|
|
|
|
|
|
|
|
|
|
|||||
данный атом соединен с другими. |
Различают валентность по водороду и по кислороду. Валентность водорода всегда I, кислорода II. |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
По |
Li – I |
Be – II |
B – III |
|
C – II, IV |
N–I,II,III,IV |
|
O – |
F – I |
|
Ne – |
|||
|
|
кислороду |
Na – I |
Mg – II |
Al – III |
|
Si – II, IV |
P – III, V |
|
S – IV, VI |
Cl - I,III,V,VII |
|
Ar - |
|
||
|
|
По |
Li – I |
Be – II |
B – III |
|
C – IV |
N – III |
|
O – II |
F – I |
|
Ne – |
|
||
|
|
водороду |
Na – I |
Mg – II |
Al – III |
|
Si – IV |
P – III |
|
S – II |
Cl - I |
|
Ar - |
|
||
|
|
Атомы элементов 2-го периода N, O, F не имеют высшей валентности, равной номеру группы (V,VI,VII) как раз |
||||||||||||||
|
! |
|||||||||||||||
|
по причине отсутствия у них свободных d-орбиталей. |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|||||||||||
Степень окисления |
Степень окисления может иметь отрицательное, положительное или нулевое значение, например: |
|
|
|
|
|||||||||||
|
|
|
|
|
-3 +1 +1 -2 -4 +1 |
+1 +5 -2 |
|
|
|
|
|
|
|
|||
СО численно равна валентности. |
|
|
|
|
Cl20, NH3, Na2S, CH4, HNO3 |
|
|
|
|
|
|
|||||
Нулевое значение степени окисления имеют атомы в свободном состоянии и атомы в молекулах простых веществ: |
||||||||||||||||
|
||||||||||||||||
S0, Me0, Cl20
В сложных веществах суммарная степень окисления равна нулю. Ионы имеют свой заряд. Находим неизвестную СО:
+ X -2 |
+1 X -2 |
X -2 |
Cl2O7 +2x -14 =0 |
Na2SO4 +2 +x-8 = 0 |
(SO4)2- х+ (-2 ∙ 4) = -2 |
х = +7 |
х = +6 |
х – 8 = -2; х = +6 |
Аналогично, зная степени окисления элементов, можно составить формулу соединения:
6 |
10 |
+3 -2 |
+5 -2 |
AlxOy → Al2O3 |
PxOy → P2O5 |
Степень окисления водорода +1 (H2S), -1 (NaH); кислорода -2 (H2O), +2 (OF2), -1 (H2O2), фтора -1 (всегда);
ЗАПОМНИ: металлы всегда электроположительны: Na+, Ca2+, Al3+, Fe2+, Fe3+, Cu2+, Cu+, Cr2+, Cr3+, Cr6+ неметаллы могут быть и в “-“, и в “+”, например: Cl-, Cl+, Cl+3, Cl+5, Cl+7
В органических веществах:H+1, O-2, Cl-1, Br-1, N-3, C – от -4 до +4, включая 0, например:
+1 -3 -3 +1 |
+1+2 -2 - 2 +1 -2 +1 -3 +1 -2 +1 |
+1 -1 -1 +1 |
+1 0 +1 -2 |
-2 +1 -1 |
-2 +1 -1 +1 -1 +1 -2 +1 |
H3C - CH3 |
H C O O H CH3 – NH-CH3 |
HC≡CH |
H – CH= O |
CH3Cl |
CH2=CH-CH=CH2 |
