
- •Домашние задания по химии и методические указания по их выполнению для студентов дневной формы обучения
- •Содержание
- •Введение
- •Раздел 1. Основные классы неорганических соединений
- •Раздел 2. Газовые законы. Закон Авогадро и следствия из него. Уравнение Клапейрона-Менделеева. Моль. Молярный объём газов.
- •Примеры решения задач 71-82.
- •Раздел 3. Эквиваленты. Нахождение формул вещества. Стехиометрические расчеты.
- •Раздел 4. Строение атома и периодическая система д.И. Менделеева.
- •Раздел 5. Химическая связь и строение молекул
- •Относительная электроотрицательность атомов
- •Типовые задачи с решениями по разделу 5.
- •Раздел 6 Термохимия. Элементы химической термодинамики.
- •Раздел 7.Окислительно-восстановительные реакции
- •Раздел 8 Скорость химической реакции. Химическое равновесие.
- •Примеры решения задач к разделу 8:
- •Раздел 9.Концентрации растворов. Коллигативные свойства растворов
- •Раздел 10. Растворы электролитов. Константа и степень диссоциации. Водородный показатель. Реакции ионного обмена. Произведение растворимости
- •Типовые задачи с решениями по разделу 10:
- •Раздел 11. Гидролиз солей. Обменные реакции в растворах электролитов
- •Раздел 12.Электродные потенциалы. Химические источники электрической энергии
- •Типовые задачи к разделу 12.
- •Раздел 13. Комплексные соединения
- •Содержание
- •Литература
Раздел 12.Электродные потенциалы. Химические источники электрической энергии
Потенциалы, возникающие на металлах, погруженных в растворы собственных солей, называются электродными потенциалами. Измерить их можно с помощью другого электрода – электрода сравнения, в качестве которого часто применяется водородный электрод. Потенциал водородного электрода (Н2/2Н+) в стандартных условиях (Т = 2980К; P= 1,01 . 105 Па (760 мм.рт.ст.), концентрация ионов водорода в растворе 1 моль/1000г Н2О) принят равным нулю.
Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях всех участвующих в нем веществ, равных единице.
Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получают электрохимический ряд напряжений металлов, или ряд стандартных электродных потенциалов: Li, Rb, K, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Числовые значения стандартных потенциалов приведены в таблице 3:
Таблиц 3
Значения стандартных электродных потенциалов φº, В
|
Электрод |
φº, В |
|
Электрод |
φº, В |
|
Li+/Li |
-3.02 |
|
Ni2+/Ni |
-0.25 |
|
Rb+/Rb |
-2.99 |
|
Sn2+/Sn |
-0.14 |
|
K+/K |
-2.92 |
|
Pb+2/Pb |
-0.13 |
|
Ba2+/Ba |
-2.90 |
|
2H+/H2 |
0.00 |
|
Sr2+/Sr |
-2.89 |
|
Bi3+/Bi |
+0.20 |
|
Ca2+/Ca |
-2.87 |
|
Sb3+/Sb |
+0.23 |
|
Na+/Na |
-2.71 |
|
Cu2+/Cu |
+0.34 |
|
La3+/La |
-2.37 |
|
Cu+/Cu |
+0.52 |
|
Mg2+/Mg |
-2.34 |
|
Hg22+/2Hg |
+0.79 |
|
Al3+/Al |
-1.67 |
|
Ag+/Ag |
+0.80 |
|
Mn2+/Mn |
-1.05 |
|
Pd2+/Pd |
+0.83 |
|
1 |
2 |
|
1 |
2 |
|
Zn2+/Zn |
-0.76 |
|
Hg2+/Hg |
+0.86 |
|
Cr3+/Cr |
-0.71 |
|
Pt2+/Pt |
+1.20 |
|
Fe2+/Fe |
-0.44 |
|
Au3+/Au |
+1.42 |
|
Cd2+/Cd |
-0.40 |
|
Au+/Au |
+1.691 |
|
Co2+/Co |
-0.28 |
|
|
|
Величина электродного потенциала металла зависит от свойств металла, концентрации его ионов в растворе, температуры и выражается уравнением Нернста:
![]() lnCмс
,
lnCмс
,
где:
![]() - потенциал металла в вольтах при данной
концентрации его в растворе;
- потенциал металла в вольтах при данной
концентрации его в растворе;![]() -
стандартный электродный потенциал
металла;R
= 8,314 Дж/К·моль – универсальная газовая
постоянная; Т- температура в градусах
абсолютной шкалы; n
– заряд (валентность) иона металла; F
= 96500 Кл – число Фарадея; Сме
– концентрация ионов металла в растворе,
в моль/л.
-
стандартный электродный потенциал
металла;R
= 8,314 Дж/К·моль – универсальная газовая
постоянная; Т- температура в градусах
абсолютной шкалы; n
– заряд (валентность) иона металла; F
= 96500 Кл – число Фарадея; Сме
– концентрация ионов металла в растворе,
в моль/л.
При подстановке в уравнение значений R и F, приняв температуру равной 25 0С, получаем:
![]()
Два металла, погруженные в растворы их солей, соединенные между собой, образуют гальванический элемент. Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом. Роль анода в гальваническом элементе выполняет пластинка более активного металла в растворе своей соли.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция:
Ni + 2AgNO3 = Ni(NO3)2 + 2Ag
Изображается следующим образом:
(-) Ni
![]() Ni(NO3)2
Ni(NO3)2
![]()
![]() AgNO3
AgNO3
![]() Ag
(+).
Ag
(+).
Эта же схема может быть изображена в ионной форме:
(-) Ni
![]() Ni2+
Ni2+
![]()
![]() Ag+
Ag+
![]() Ag
(+)
Ag
(+)
На аноде никель
окисляется: Ni0
– 2e
![]() Ni2+
и в форме ионов переходит в раствор. На
катоде восстанавливается серебро: Ag+
+ 1e
Ni2+
и в форме ионов переходит в раствор. На
катоде восстанавливается серебро: Ag+
+ 1e![]() Ag0
и в виде металла осаждается на электроде.
Складывая уравнения электродных
процессов (с учетом числа принимаемых
и отдаваемых электронов), получаем
суммарное уравнение реакции:
Ag0
и в виде металла осаждается на электроде.
Складывая уравнения электродных
процессов (с учетом числа принимаемых
и отдаваемых электронов), получаем
суммарное уравнение реакции:
Ni + 2Ag+ = Ni2+ + 2Ag0.
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающихся только концентрацией (концентрационные гальванические элементы).
Рассчитать э.д.с. гальванического элемента при 250С, пользуясь значениями стандартных электродных потенциалов, приведенных в таблице 3. (Задачи 601-625).
Rb
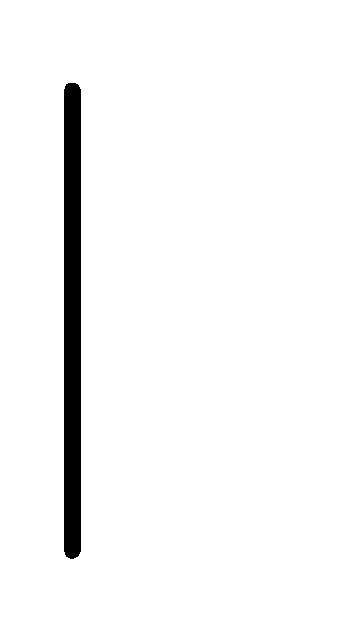 Rb+
(0.1М)
Rb+
(0.1М)
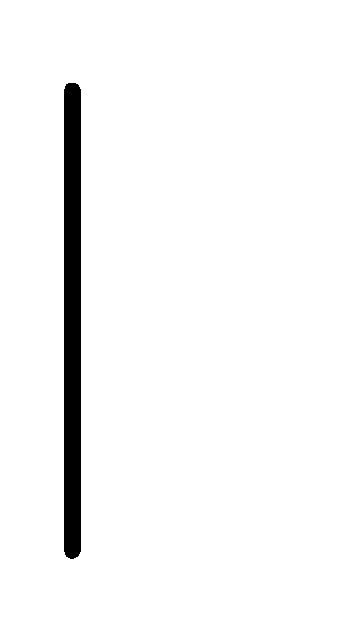
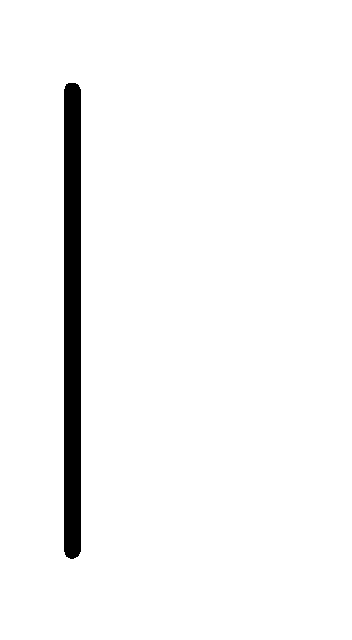 Au+(0.1М)
Au+(0.1М)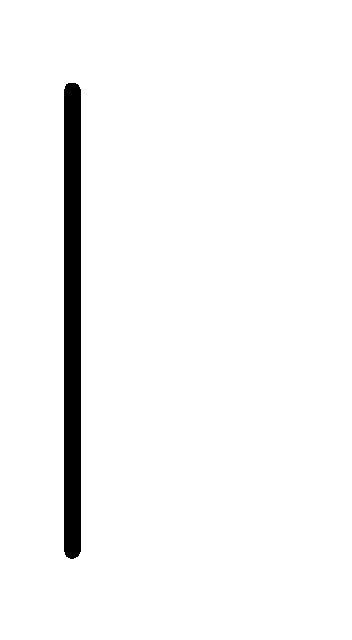 Au.
Au.K-
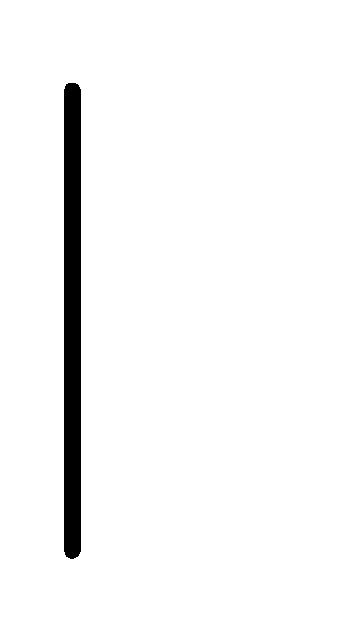 K+
(0.01М)
K+
(0.01М)
 Au+3(0.1М)
Au+3(0.1М)
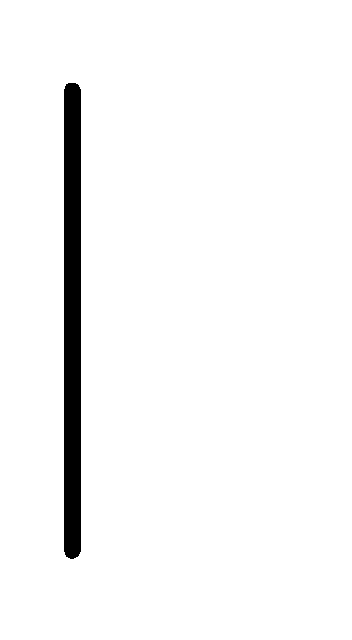 Au.
Au.Li
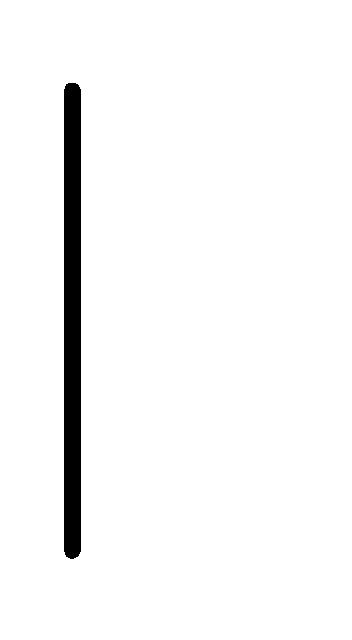 Li+
(0.1М)
Li+
(0.1М)
 Pt+2(0.01М)
Pt+2(0.01М)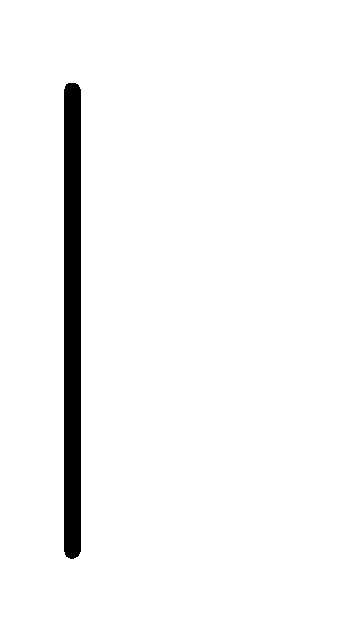 Pt.
Pt.Ba
 Ba+2
(0.01М)
Ba+2
(0.01М)
 Ag+
(0.001М)
Ag+
(0.001М) Ag.
Ag.Sr
 Sr+2
(10М)
Sr+2
(10М)
 Pd+2
(0.01М)
Pd+2
(0.01М) Pd.
Pd.Ca
 Ca+2
(0.01М)
Ca+2
(0.01М)
 Hg+2
(0.001М)
Hg+2
(0.001М)
 Hg.
Hg.Na
 Na+
(0,1М)
Na+
(0,1М)
 Hg+2
(0.01М)
Hg+2
(0.01М) Hg.
Hg.Au
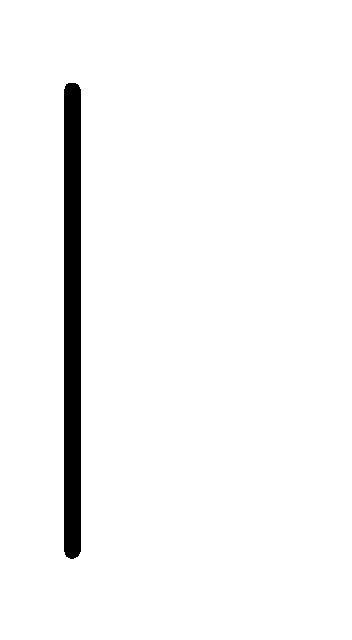 Au+3(0.001М)
Au+3(0.001М)
 Au+3
(0.01М)
Au+3
(0.01М)
 Au.
Au.La
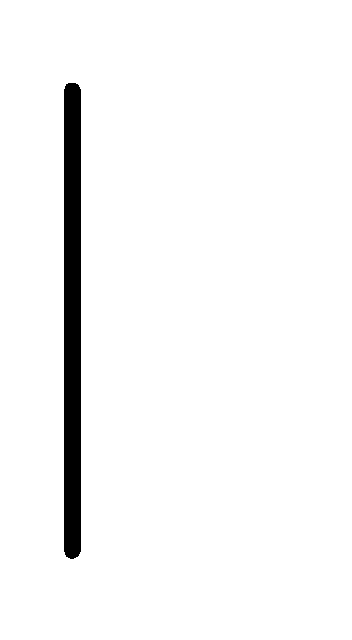 La+3
(0.1М)
La+3
(0.1М) Сu+
(0.01М)
Сu+
(0.01М)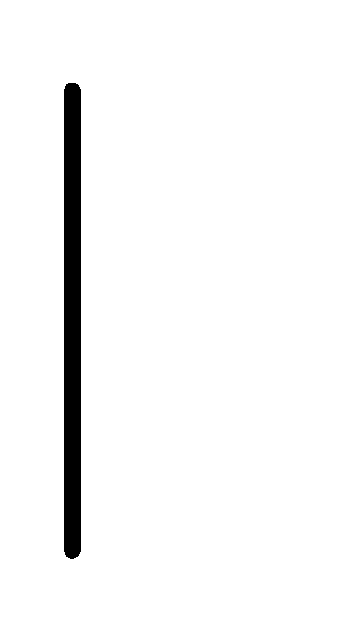 Cu.
Cu.Mg
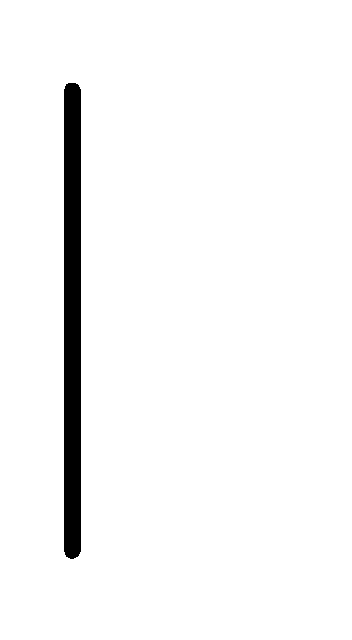 Mg+2
(0.01М)
Mg+2
(0.01М)
 Cu+2
(0.01М)
Cu+2
(0.01М)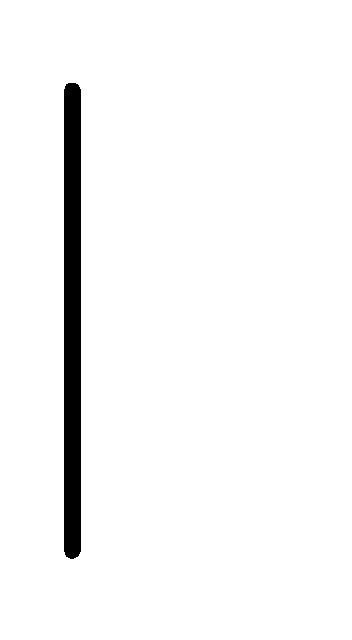 Cu.
Cu.Al
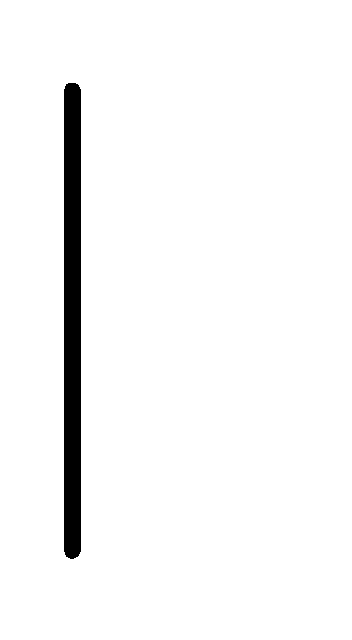 Al+3(0.1М)
Al+3(0.1М) Bi+3
(1М)
Bi+3
(1М)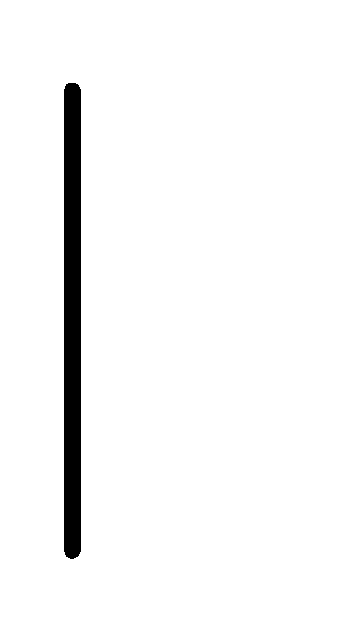 Bi.
Bi.Mn
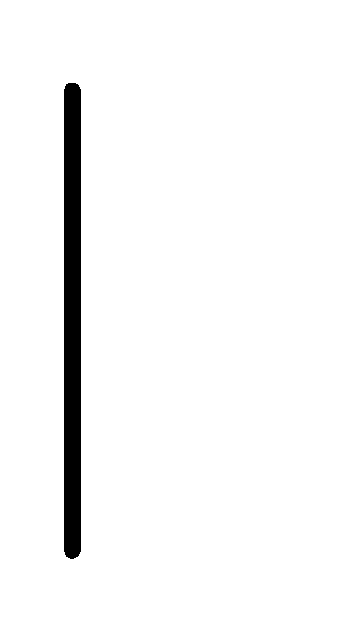 Mn+2(10М)
Mn+2(10М)
 Sb+3
(0.1М)
Sb+3
(0.1М)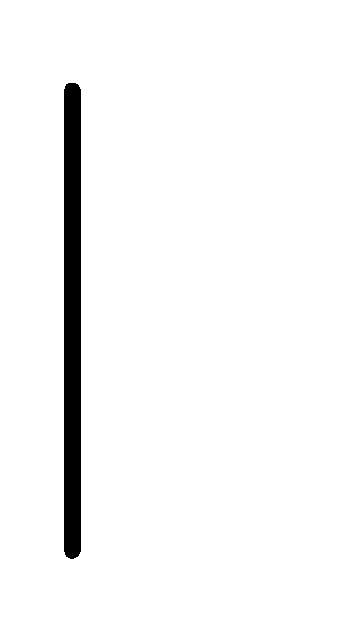 Sb.
Sb.Zn
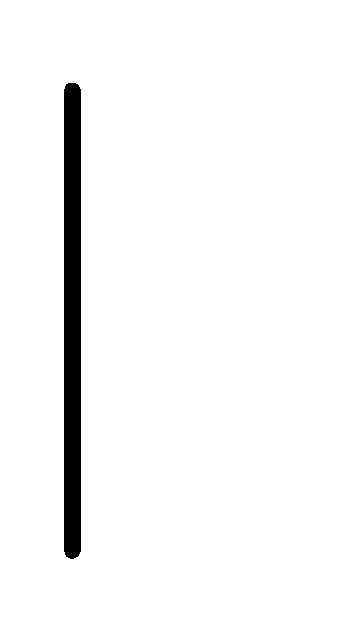 Zn+2
(0.01М)
Zn+2
(0.01М)
 Pb+2
(0.1М)
Pb+2
(0.1М)
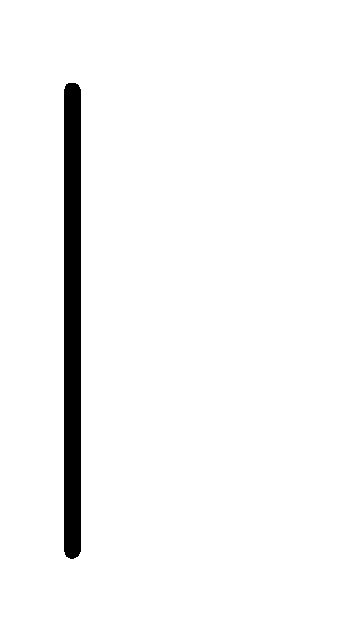 Pb.
Pb.Cr
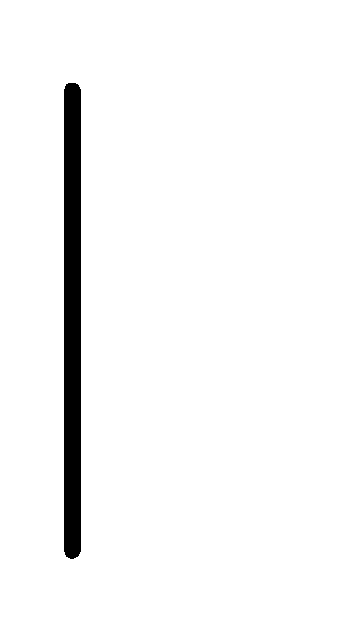 Cr+3(0.01М)
Cr+3(0.01М)
 Cr+3
(10М)
Cr+3
(10М) Cr.
Cr.Fe
 Fe+2
(0.01М)
Fe+2
(0.01М)
 Sn+2
(0.01М)
Sn+2
(0.01М) Sn.
Sn.Cu
 Cu+2
(0.01М)
Cu+2
(0.01М) Cu+2
(0.1М)
Cu+2
(0.1М)
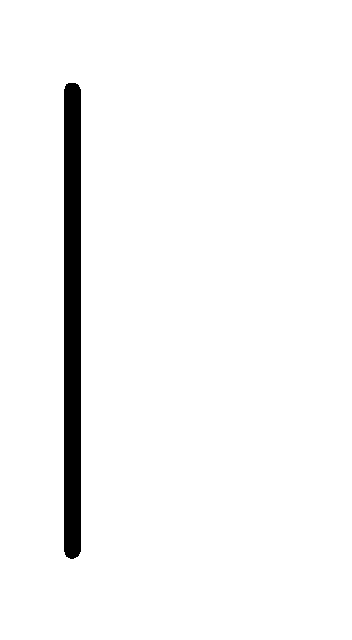 Cu.
Cu.Cd
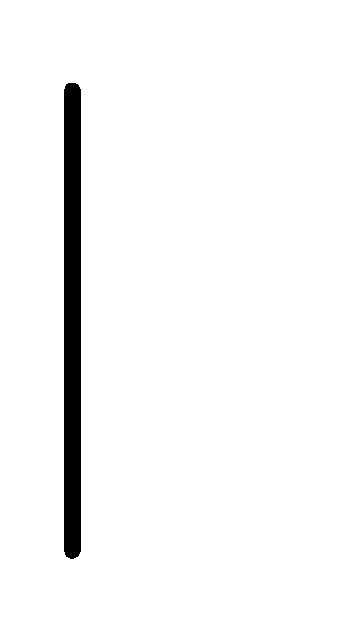 Cd+2
(0.01М)
Cd+2
(0.01М)
 Ag+
(0.001М)
Ag+
(0.001М)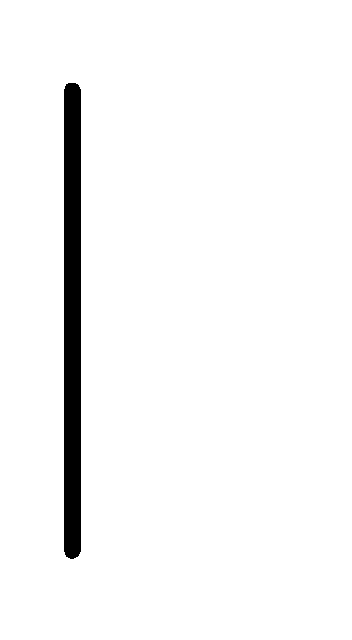 Ag.
Ag.Co
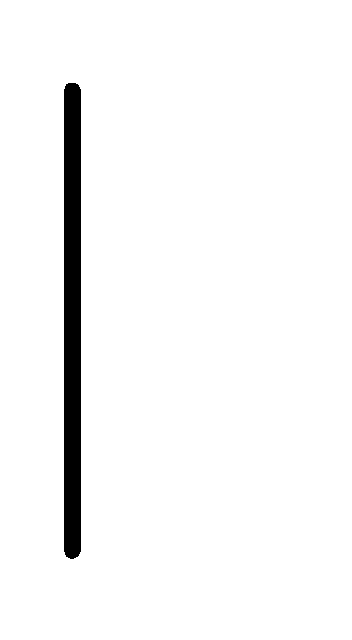 Co+2
(10М)
Co+2
(10М)
 Pd+2(1М)
Pd+2(1М)
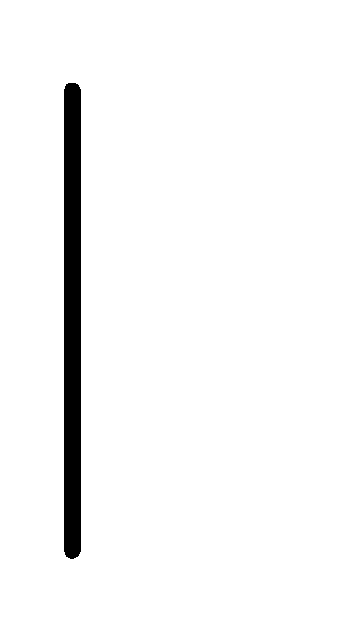 Pd.
Pd.Sn
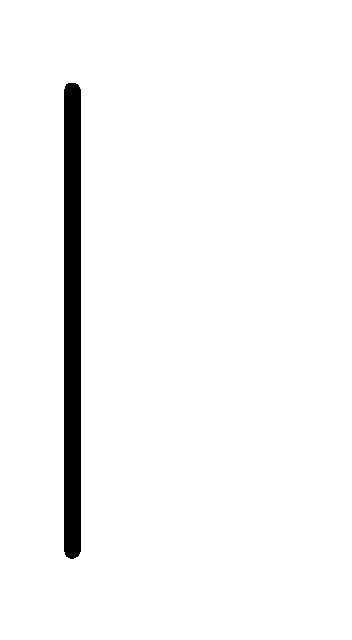 Sn+2
(0.01М)
Sn+2
(0.01М)
 Sn+2(0.1М)
Sn+2(0.1М)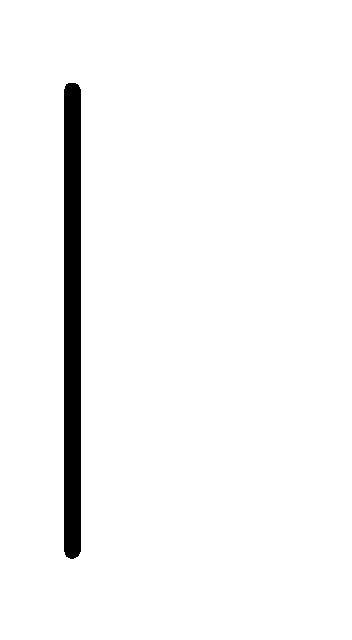 Sn.
Sn.Ca
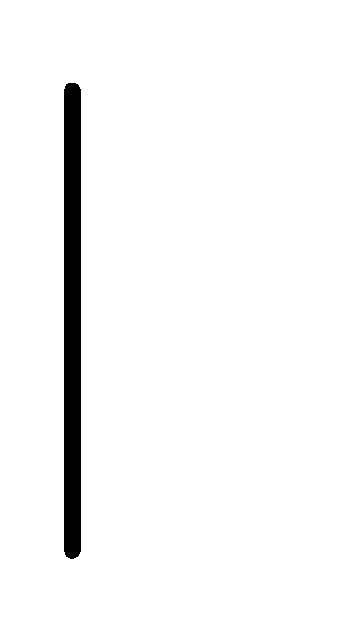 Ca+2
(1М)
Ca+2
(1М)
 Pb+2
(10М)
Pb+2
(10М)
 Pb.
Pb.Al
 Al+3
(0.001М)
Al+3
(0.001М)
 Al+3
(0.01М).
Al+3
(0.01М).Na
 Na+
(0.01М)
Na+
(0.01М)
 Au+3
(0.01М)
Au+3
(0.01М) Au.
Au.Zn
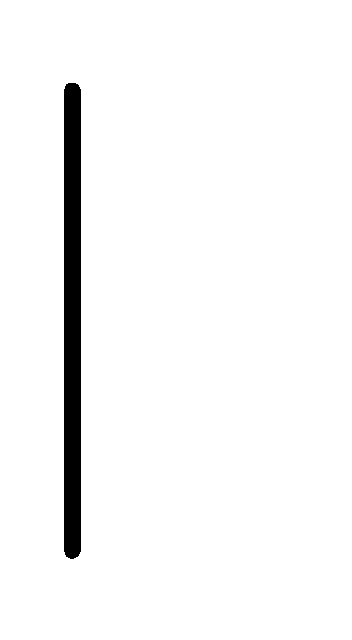 Zn+2
(0.01М)
Zn+2
(0.01М) Cu+2(0.1М)
Cu+2(0.1М)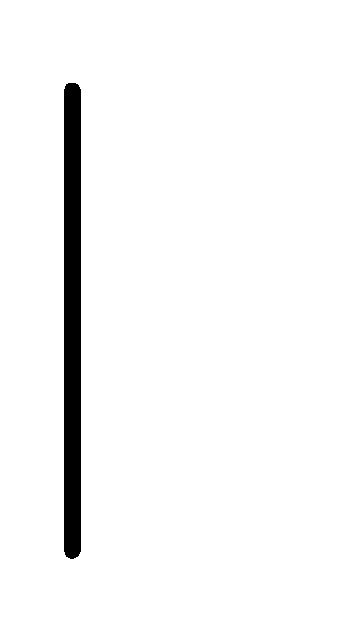 Cu.
Cu.Fe
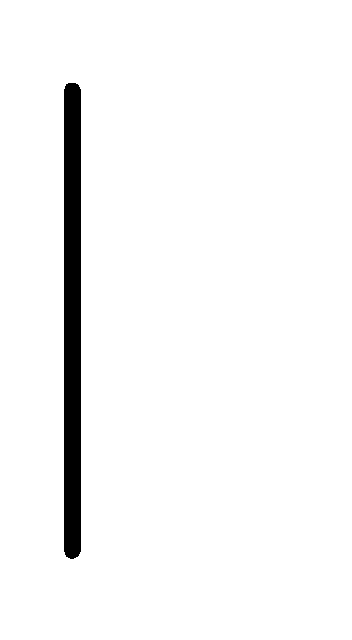 Fe+2
(0.01М)
Fe+2
(0.01М)
 Fe+2
(0.1М)
Fe+2
(0.1М)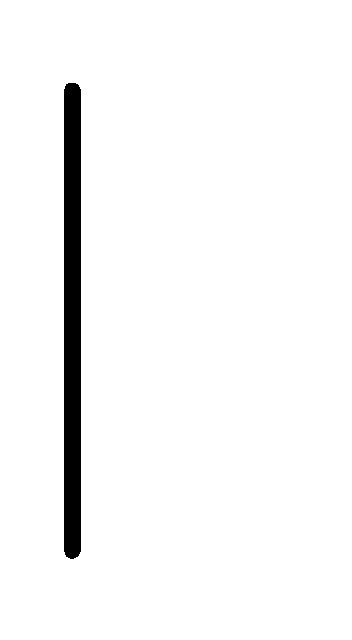 Fe.
Fe.La
 La+3(10М)
La+3(10М) Hg+2(0.1М)
Hg+2(0.1М) Hg.
Hg.
