
- •3.Основные сведения о строении атомов. Квантово-механическая модель атома. Волновые свойства электронов.
- •4.Квантовые числа электронов. Распределение электронов по орбиталям. Принцип Паули. Порядок заполнения атомных орбиталей электронами.
- •5. Электронные и электронно-графические формулы. Привести конкретные примеры указанных формул для элементов 3, 5 ,7 периодов.
- •6. Периодический закон и периодическая система д.И. Менделеева Структура периодической системы (период, группа, подгруппа). Значение периодического закона и периодической системы.
- •7. Периодическое изменение свойств химических элементов. Атомные и ионные радиусы. Энергия ионизации. Сродство к электрону. Электроотрицательность.
- •8. Химическая связь. Основные типы и характеристики химической связи. Условия и механизм ее образования. Метод валентных связей. Валентность. Понятие о методе молекулярных орбиталей.
- •9. Водородная связь. Особые свойства воды и некоторых других соединений, способных образовывать водородную связь.
- •10.Донорно-акдепторная связь. Комплексные соединения. Комплексообразователь и лиганды. Заряд комплексообразователя и координационной сферы. Координационное число константы нестойкости.
- •12.Химическая термодинамика. Энергетика химических процессов. Внутренняя энергия и энтальпия. Термохимические уравнения. Теплота образования и разложения веществ.
- •13.Стандартные тепловые эффекты различных процессов. Основной закон термохимии (закон Гесса). Применение термохимических расчетов,
- •14.Химическое сродство. Энтропия. Ее изменение при химических процессах. Стандартные энтропии веществ. Методы расчета" изменения энтропии в ходе химической реакции.
- •16.Химическая кинетика. Факторы влияющие на скорость реакции, методы ее регулирования. Закон действующих масс. Константа скорости реакции. Кинетические уравнения реакций.
- •17.Энергия активации. Активированный комплекс. Энергетические схемы хода реакции. Температурная зависимость скорости реакций. Правило Вант-Гоффа,
- •18.Катализ и катализаторы. Гомогенный и гетерогенный катализ.
- •19.Химическое равновесие. Константа равновесия. Принцип Ле-Шателье Влияние на равновесие изменения температуры, давления» концентрации. Практическое применение принципа Ле-Шателье.
- •20. Дисперсные системы, их классификация, устойчивость и коагуляция. Колойдные и истинные растворы. Способы выражения состава растворов.
- •21.Растворимость газов, жидкостей и твердых веществ в жидкостях. Закон Генри. Закон распределения. Давление насыщенного пара растворителя над раствором. Первый закон Рауля.
- •22.Температура кристаллизации и температура кипения растворов неэлектролитов. Второй закон Рауля. Осмотическое давление. Закон Вант-Гоффа.
- •23.Электролиты. Электролитическая диссоциация. Степень и константа диссоциации, связь между ними. Активность и сила раствора
- •24 Свойство растворов электролитов. Изотонический коэффициент, его определение. Связь изотонического коэффициента со степенью диссоциации. Применение электрохимических процессов.
- •25.Вода Природные воды, их обработка Замкнутый водооборот. Водород, водородная энергетика.
- •26.Произведение растворимости. Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Методы определения концентрации ионов водорода
- •28.Электродные потенциалы. Механизм их возникновения. Двойной электрический слой. Уравнение Нернста. Ряд напряжений.
- •29.Гальванические элементы. Теория гальванических элементов.
- •30.Электролиз расплавов растворов. Правила электролиза с инертным анодом. Электролиз раствора с растворимым анодом.
- •31.Основные законы электролиза. Применение электролиза. Гальваностегия и гальванопластика. Электрохимическая обработка металлов. Аккумуляторы.
- •33.Методы защиты металлов от коррозии. Металлические защитные покрытия (анодные, катодные). Неметаллические покрытия. Электрохимические методы защиты от коррозии.
- •34.Общие свойства металлов. Металлическая связь. Тепло- и электропроводность. Физико-механические и химические свойства металлов.
- •35. Высокомолекулярные соединения (вмс). Полимеры. Классификация. Методы получения. Полимеризация. Поликонденсация.
- •36. Форма, гибкость и структура макромолекул полимеров. Конформация и конфигурация. Атактические и стереорегулярные полимеры. Сополимеры и блоксополимеры. Надмолекулярная структура полимеров.
- •37. Агрегатные, физические и фазовые состояния полимеров. Физикомеханические и химические свойства полимеров.
- •38. Неорганическая химия р-элементов IV группы. Важнейшие соединения углерода и кремния, использование их в строительстве. Карбонаты, силикаты, стекла, ситаллы, керамика. Их св-ва и применение.
- •40.Цементы. Портландцемент, его химический и минералогический состав. Получение портландцемента.
- •41Химизм процессов, протекающих при получении цемента и его взаимодействии с водой. Основные составляющие цементного камня. Влияние добавок на процессы твердения
- •42. Коррозия бетона и методы борьбы с ней. Основные виды коррозии бетона. Химизм процессов, протекающих при коррозии. Основные методы защиты бетона от коррозии.
Предмет химии в ее связь с другими науками. Основные разделы химии, предмет их изучения. Значение химии в различных отраслях хозяйства.
Химия – наука о веществах и их превращениях, сопровождающихся изменением их хим. и физ. св-в. Такие превращения назыв. хим. реакциями. Хим. реакции следует отличать от физ. процессов и ядерных реакций.
При протекании хим. реакций всегда образовываются новые в-ва со св-вами, отличающимися от св-в исходных в-в, но никогда не образуются атомы новых элементов. Физ. процессы при их протекании вещ-ва сохраняют неизменными свои хим. св-ва, но могут изменять форму и агрегатное состояние. При ядерных реакциях происходит изменение в атомных ядрах и могут образовывать атомы новых элементов.
Исторически в химии принято выделять 4 части: неорган., орган., физ., аналит. химии. орган. химия изучает соединение углерода, неорганическая - соединение всех остальных элементов, а также простые соединения углерода, физ. химия – проблемы протекания хим. реакций, связанную с реакц. энергию, возможность протекания и направление реакций, а также св-ва в-в в различных агрегатных состояниях.
Аналитическая химия развивает точные методы анализа хим. состава веществ. Различают качественный и количественный анализ. Качественный анализ отвечает на вопрос, из чего сост. Вещество, количественный анализ – в каких соотношениях компоненты входят в состав вещ-ва.
Основные направления: -учение о строении вещ-ва; -учение о возможности протекания реакции и их направление.; - учение о скорости хим. реакции; - учение о периодическом изменении свойств элементов и их моединений.
В современной жизни, особенно в производственной деятельности человека, химия играет исключительно важную роль. Нет почти ни одной отрасли производства, не связанной с применением химии. Природа дает нам лишь исходное сырье — дерево, руду, нефть и др. Подвергая природные материалы химической переработке, получают разнообразные вещества, необходимые для сельского хозяйства, для изготовления промышленных изделий и для домашнего обихода — удобрения, металлы, пластические массы, краски, лекарственные вещества, мыло, соду и т. д. Для химической переработки природного сырья необходимо знать общие законы превращения веществ, а эти знания дает химия.
Основные понятия и законы химии. Закон эквивалентов. Понятие об атомной и молекулярной массе. Закон Авогадро. Уравнение состояния газов.
В изолированной системе сумма масс и энергий постоянна E=m*C^2
Применительно к химии закон выражается:
Мааса веществ, участвующих в хим реакциях постоянна.
Лавуазье в 1789 подтвердил этот закон.
Закон постоянства состава. Впервые сформулировал Пруст в 1801.
!!!Всякое химически индивидуальное веш-во имеет 1 и тот же количественный состав независимо от способа его получения.
1)Zn+ 1/2O2=ZnO 2)ZnCO3= ZnO+CO2 3)Zn(OH)2=ZnO+H2O
Закон эквивалентов.
!!! Вещ-ва взаимодействуют между собой в строго определённых массовых соотношениях или эквивалентов.
Эквивалент –реальная или условная частица вещества, которая в кислотно-основных реакциях эквивалентна одному иону водорода, а в окислительно-восстановительных – одному электрону.
Эквивалентная масса – масса эквивалента, выраженная в граммах.
mэ=A/B, где А – атомная масса элемента, В – валентность.
Пример: mэ(Al)=27/3=9 г/моль
Эквивалентная масса в соединениях
mэ(кислоты)=М(кислоты)/nH^+ mэ(основания)=М(основания)/nOH^- mэ(cоли)= M(соли)/nMe*Вме mэ(оксида)=M(оксида)/nэ*Вэ m1/mэ1=m2/mэ2
Эквивалентный объем - объём одного эквивалента газа при нормальных условиях.
Vэ=Vm/n(атома)*В(атома) m1/mэ1=V2/Vэ2
Закон кратных отношений
!!!если 2 элемента образуют друг с другом хим соединение , то масса одного элемента, приходящейся в этих соединениях на одну и ту же массу другого элемена, относятся между собой как простые целые числа.
Относительная атомная масса – показывает, во сколько раз масса данного атома превышает 1/12 часть массы лёгкого изотопа углерода 12 С.
Относительная молекулярная масса-показывает во сколько раз масса одной молекулы превышает 1/12 часть массы лёгкого изотома атома углерода 12 С.
Закон Авогадро:Установлен 1811
!!!
В равных объёмах любых газов при
одинаковых физ условиях содержится
одинаковое число частиц (атомов, молекул,
ионов). Авогадро доказал, что в молях
любых веществ содержится одинаковое
количество частиц NA=6,02*
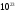
Моль- единица количества вещ-ва, содержащая столько условных частиц, сколько атомов содержится в 12 граммах лёгкого изотома атома углерода 12 С.
Условная частица – это любая реальная частица или часть этой частицы.
Уравнение состояния газа или уравнение Менделеева-Клапейрона:
pV=nRT; R=8,314 Дж/моль*К; n=m/M моль
Валентность элемента – способность его атомов соединяться с другими атомами в определённых соотношениях.
3.Основные сведения о строении атомов. Квантово-механическая модель атома. Волновые свойства электронов.
Квантово-механическая модель атомов. Уравнение Луи де Бройля. В1920-х годах доказано двойственная природасфера, согласно которой свет - двойственный объект, в одних экспериментах как волновой объект, в других – как состоящий из материальных частиц.
Длина волны =h/m
Гейзинберг предложил принцип неопределённости: невозможно одновременно с одинаково большой точностью указать положение электрона в атоме и его импульс.
Шредингер сказал, что характер волнового движения электрона в атоме близок волновому движению типа «стоячая» волна. Квадрат волновой функции характеризует вероятность нахождения электрона в данной области пространства атома.
Область пространства, в которой можно найти электрон – электронное облако.
Атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов. Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, так что атом в целом электронейтрален. Возникающая вследствие вращения электронов центробежная сила уравновешивается силой электростатического притяжения электронов к противоположно заряженному ядру. Размеры ядра очень малы по сравнению с размерами атома в целом: диаметр атома — величина порядка 10~8 см, а диаметр ядра — порядка 1(Н3)
4.Квантовые числа электронов. Распределение электронов по орбиталям. Принцип Паули. Порядок заполнения атомных орбиталей электронами.
Возможные энергетические состояния электрона в атоме определяются
величиной главного квантового числа п, которое может принимать положительные целочисленные значения: 1, 2, 3 ... и т. д. Наименьшей энергией электрон обладает при n = 1; с увеличением п энергия электрона возрастает. Поэтому состояние- электрона, характеризующееся определенным значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме: при п — 1 электрон находится на первом энергетическом уровне
Не только энергия электрона в атоме (n связанный с ней размер электронного облака) может принимать лишь определенные значения. Произвольной не может быть и форма электронного облака. Она определяется орбитальным квантовым числом/ (его называют также побочным, или азимутальным), которое может принимать целочисленные значения от 0 до (п—1), где п — главное квантовое число.
Размеры и формы электронных облаков в атоме могут быть не любыми, а только такими, которые соответствуют возможным значениям квантовых чисел п и I. Из уравнения Шредингера следует, что и ориентация электронного облака в пространстве не может быть произвольной: она определяется значением третьего, так называемого магнитного квантового числа т.
Магнитное квантовое число может принимать любые целочисленные значения — как положительные, так и отрицательные — в пределах от +/ до —/. Таким образом, для разных значений / число возможных значений т раз-лично. Так, для s-электронов (/==0) возможно только одно значение т (т = 0); для р-электронов (/=1) возможны три различных значения т (—1,0, +1); при 1 = 2 (f-электроны) т может принимать пять различных значений (—2,—1,0,+1,4-2). Вообще, некоторому значению I соответствует (2/+ 1) возможных значений магнитного квантового числа, т. е. (2/+I) возможных расположений электронного облака в пространстве.
Исследования атомных спектров привели к выводу, что, помимо квантовых чисел п, I и т, электрон характеризуется еще одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное состояние. Эта величина получила название спинового квантового числа или просто спина (от английского spin — кручение, вращение); спин обычно обозначают буквой s. Спин электрона может иметь только два значения: +1/2 или —1/2; таким образом, как и в случае остальных квантовых чисел, возможные значения спинового квантового числа различаются на единицу.
(Принцип Паули), согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Первое правило Клечковского: заполнение подуровней происходит в направлении увеличения суммы главного и орбитального квантовых чисел.
Второе правило К л е ч к о в с к о г о: если для 2-х подуровней сумма главного и орбитального квантовых чисел одинаковы, то в начале полностью заполняется подуровень с меньшим значением главного квантового числа.
