
posobia2 / Лекции по биоорганической химии (2011 г
.).pdfхарактеристику состава, строения промежуточных соединений и переходных состояний, а также предположения, касающиеся смещения электронов в ходе последовательных превращений частицы.
Чтобы осуществилась реакция между двумя частицами (молекулами, атомами, ионами), они должны столкнуться. Число столкновений зависит от кинетической энергии частиц, и оно увеличивается с ростом температуры. Однако не каждое столкновение вызывает реакцию между частицами. В реакцию вступают только частицы, обладающие достаточной энергией – активированные частицы, способные преодолеть энергетический барьер. В результате столкновений частицы активируются, но не все. С повышением температуры увеличивается число тех столкновений, которые приводят к реакции. При взаимодействии активированных молекул возникает
активированный комплекс (переходное состояние):
Реагирующие Активированные молекулы молекулы
|
Переходное |
|
Продукты |
|
состояние |
|
реакции |
|
|
Энергия, затрачиваемая на образование активированного комплекса, называется энергией активации. Время жизни активированного комплекса (переходного состояния) очень мало – около 10-12 секунды.
Реакционная способность рассматривается только по отношению к реакционному партнеру. Само вещество называют субстратом, а действующее на него соединение – реагентом. В субстрате воздействию реагента подвергается реакционный центр. Химические реакции по характеру изменения связей в субстрате и реагенте классифицируются на радикальные, ионные и согласованные.
21
Типы реакций и реагентов Радикальные реагенты – атом или группировка атомов,
содержащая один или несколько неспаренных электронов. Такие реагенты образуются в результате гомолитического разрыва связей:
A  B
B  A
A

 B
B
Как правило, радикальные реагенты, в отличие от других реагентов, характеризуются высокой реакционной способностью.
Электрофильные реагенты – это катионы и нейтральные молекулы, имеющие электронодефицитный центр (атом). Электрофильные реагенты можно рассматривать как акцепторы электронных пар, которые они принимают в ходе химических реакций от других атомов. Электрофилы атакуют участки молекул, богатые электронами, например -электронное облако в алкенах, алкинах, аренах, или атом, имеющий неподеленную пару электронов и частичный отрицательный заряд. Примеры электрофильных частиц: Н ; NO2 ; SO3; ZnCl2; AlCl3 и другие.
Нуклеофильные реагенты – это частицы, имеющие неподеленные пары электронов на внешнем электронном слое. Нуклеофилами являются анионы и электронейтральные молекулы, имеющие атом, у которого есть одна или несколько неподеленных пар электронов и частичный отрицательный заряд. Нуклеофильные реагенты атакуют в субстрате электронодефицитный центр, т.е. атом с частичным положительным зарядом. Нуклеофилы в реакциях выступают как доноры электронных пар. примеры нуклеофильных частиц: Н ; ОН ; Н2О; NН3; СN ;СН3ОН; СН3О и другие.
22

Взависимости от типа разрыва связей в субстрате и природы реагента реакции можно разделить на радикальные (гомолитические), ионные (гетеролитические), согласованные.
Врадикальных реакциях под действием свободных радикалов происходит гомолитический разрыв связей в субстрате. В ионных реакциях происходит гетеролитический разрыв связей в субстрате под действием электрофильного или нуклеофильного реагентов. В согласованных реакциях разрыв старых и образование новых связей происходит одновременно.
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
Cl |
H C H |
H Cl |
C H |
|
|
|
|
|
|
|
||
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
Пример радикальной реакции |
|
|
||
CH3 |
Cl |
2 NH3 |
|
CH3 NH2 |
NH4Cl |
|
CH3 |
CH2 |
Br |
H2O |
CH3 CH2 |
OH |
HBr |
CH3 |
CH2 |
Br |
OH |
CH3 CH2 OH |
Br- |
|
CH2 |
CH2 |
H+ |
|
CH3 CH2+ |
|
|
|
|
|
|
SO3H |
|
|
|
|
SO3 |
|
|
|
|
Примеры гетеролитических реакций
H |
CHO |
|
|
|
O |
Примеры согласованных реакций
23

По конечному результату различают: реакции замещения (радикальное замещение – SR, электрофильное замещение – SE, нуклеофильное замещение – SN), реакции присоединения ( радикальное присоединение –АR, электрофильное присоединение – АЕ, нуклеофильное присоединение – АN), реакции отщепления (элиминирования –Е), перегруппировки, ОВР.
Реакции радикального замещения (SR)
Эти реакции характерны для алканов и циклоалканов, имеющих средний или большой цикл. В молекулах предельных углеводородов имеются неполярные связи углерод-углерод и практически неполярные связи углерод-водород, реакции этих соединений идут с гомолитическим разрывом связей. Большинство органических радикалов характеризуется высокой реакционной способностью и малым временем жизни. Устойчивость алкильных радикалов уменьшается при переходе от третичных к первичным. Аллильный и бензильный радикалы характеризуются более высокой устойчивостью за счет делокализации неспаренного электрона в системе сопряжения.
CH2 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
CH CH |
2 |
CH3 C |
CH |
3 |
CH |
CH |
3 |
CH |
CH |
2 |
|
|
|
|
|
2 |
3 |
|||
|
|
|
CH3 |
|
|
CH |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
уменьшение стабильности свободных радикалов
Пути образования свободных радикалов:
1. Фотохимическое расщепление (фотолиз):
Сl : Cl Cl + Cl
24

|
O |
|
O |
|
|
CH3 |
C CH3 |
|
CH C |
CH |
3 |
|
|
|
3 |
|
|
|
O |
3000 A |
|
|
|
|
|
|
|
|
|
CH3 |
C |
CO |
CH3 |
|
|
2. Термическое расщепление (термолиз):
Pb(C2H5)4 Pb + 4 C2H5
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
C6H5 |
|
C |
|
O |
|
O |
|
C |
|
C6H5 |
2 C6H5 |
|
C |
|
O |
|||||||
|
|
|
|
|
|
|
|
|||||||||||||||
3. Окислительно-восстановительные реакции:
H-О-О-Н + Fe2+ НО + ОН + Fe3+
С6Н5СНО + Fe3+ Fe2+ + H + C6Н5С(О)
4. Электролитическое окисление анионов карбоновых кислот:
O |
|
|
O |
2 R C |
|
2R C |
2R + 2 CO2 |
|
-2e |
|
|
O |
O |
|
|
|
|
Механизм реакций радикального замещения (SR)
В реакциях радикального замещения выделяют несколько последовательных стадий: инициирования, рост цепи, обрыв цепи. Рассмотрим подробнее на примере реакции хлорирования этана:
СН3 СН3 +Сl2 CH3 CH2 Cl + HCl
Инициирование:
Сl : Cl Cl + Cl
На этой стадии под действием кванта тепловой или световой энергии происходит гомолитический разрыв связи в молекуле хлора. Рост цепи:
Cl + СН3 СН3 CH3 CH2 +HCl
25
CH3 CH2 + Сl : Cl CH3 CH2 Cl + Cl
Cl + СН3 СН3 CH3 CH2 +HCl CH3 CH2 + Сl : Cl CH3 CH2 Cl + Cl
Образовавшиеся атомы хлора (свободные радикалы), стремясь завершить свой внешний электронный слой, отрывают атом водорода от молекулы этана. Отрыв атома водорода от молекулы алкана идет гомолитически, при этом образуются молекула хлороводорода и этильный (алкильный радикал). Образующийся углеводородный радикал отрывает атом хлора от молекулы Cl2, что приводит к образованию хлорэтана и радикала хлора, который далее вступает в реакцию с этаном. Таким образом одна реакция порождает другую и представляет собой цепь последовательных превращений. На этом этапе идет образование основных продуктов реакции.
Обрыв цепи:
Cl + Cl Сl : Cl
CH3 CH2 + Cl CH3 CH2 Cl CH3 CH2 + CH3 CH2 СН3 СН3 + СН2=СН2 CH3 CH2 + CН2 СН3 CH3 CH2 CН2 СН3
По мере превращения исходных веществ в продукты реакции увеличивается вероятность взаимодействия радикалов между собой, что приводит к образованию молекул исходных веществ либо побочных продуктов. Эти процессы приводят к исчезновению из реакционной сферы свободных радикалов, в результате рост цепи прекращается.
Реакционная способность галогенов уменьшается от фтора к брому. Йод с алканами не реагирует вследствие эндотермичности такого процесса. Если в молекуле алкана содержатся первичные, вторичные и
26

третичные атомы углерода, то под действием почти всех радикалов отрываются в первую очередь атомы водорода от третичного атома углерода, затем от вторичного и в последнюю очередь от первичного. Это согласуется энергиями связей: Е(Н-Стр) = 381 кДж/моль, Е(Н-Свт) = 393 кДж/моль, Е(Н-Сп) = 406 кДж/моль. В пользу такого протекания реакции свидетельствует устойчивость радикалов, которая уменьшается от третичного к первичному. Проведение реакций с хлором и фтором приводит к образованию смеси продуктов монозамещения, так как эти атомы обладают высокой реакционной способностью и легко разрывают любые связи Н-С. Однако в смеси продуктов содержание продукта замещения у третичного атома углерода большее, чем следовало ожидать из статистического подхода (ожидаемое количество 2-метил-2-
хлорпропана – 10%, 2-метил-1-хлорпропана – 90%).
|
|
|
|
|
|
|
|
|
|
h |
Cl |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
Cl2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH |
|
CH |
|
CH |
|
|
|
CH |
|
C |
|
CH |
+ |
CH |
|
CH |
|
CH Cl |
+ |
HCl |
||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
3 |
|
3 |
|
|
|
|
3 |
|
3 |
3 |
|
|
|
2 |
|
|||||||||
|
|
CH3 |
|
|
|
|
|
CH3 29% |
|
|
CH3 |
48% |
|
|
||||||||||
В случае реакции алканов с менее реакционноспособным радикалом брома, а потому и более избирательным, замещение протекает главным образом у третичного атома углерода, т.е. региоселективно. Региоселективность – это протекание реакции по одному из нескольких возможных реакционных центров.
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|||
CH3 |
|
|
CH |
|
CH3 |
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
|
|
|
Br2 |
CH3 |
|
C |
|
CH3 + HBr |
||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
CH3 |
|
|
|
CH |
99% |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
||||
27

Реакции электрофильного присоединения (АЕ)
Реакции АЕ характерны для алкенов, алкинов, диеновых углеводородов, а также для циклоалканов, имеющих «напряженный» цикл (циклопропан и циклобутан). В случае непредельных углеводородов присоединение электрофильной частицы происходит за счет разрыва -связи, как менее прочной. -Связь образуется в результате двукратного перекрывания р-орбиталей, область с повышенной электронной плотностью располагается по обе стороны от линии, соединяющей ядра связанных атомов. Пара электронов, образующая -связь, более удалена от ядер атомов, поэтому менее прочно удерживается ими, и легче поляризуется по сравнению с электронами, образующими -связь углерод-углерод.
H H H H
H H H
H H H H
Схема образования -связи и распределение -электронной плотности
Механизм реакции АЕ в общем виде может быть представлен следующим образом:
|
|
|
|
|
|
|
|
|
E |
Nu |
|
|
Nu- |
|
|
|
|
|
C C |
|
C C + E Nu |
C C |
|
|
C C Nu |
||
|
|
-комплекс |
Nu- |
-комплекс |
|
|
|
|
|
|
|||
Реакция электрофильного присоединения представляет собой ступенчатый процесс, инициируемый электрофильной частицей (Е), несущей полный или частичный положительный заряд. На первом этапе реакции происходит образование -комплекса (быстрая стадия). -
28
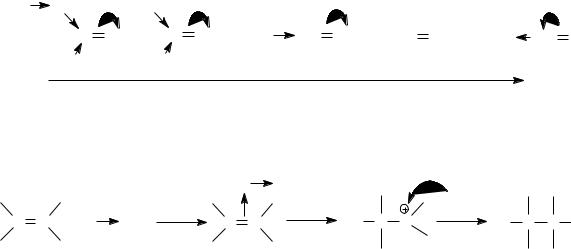
Комплекс формируется в результате электростатического притяжения электрофильной частицы к отрицательно заряженному электронному облаку -связи. На втором этапе происходит превращение -комплекса
в -комплекс (медленная или лимитирующая стадия реакции). Это превращение идет за счет того, что под действием электронного облака-связи происходит дальнейшая поляризация связи Е Nu и её гетеролитический разрыв. Образующийся катион Е образует -связь с одним из атомов углерода за счет пары электронов -связи в результате ее гетеролитического разрыва. Продукт присоединения катиона называют -комплексом (так как возникла -связь), или карбкатионом (так как полный положительный заряд находится на атоме углерода). На третьем этапе образовавшийся -комплекс (карбкатион) легко подвергается нуклеофильной атаке Nu с образованием конечного продукта.
Скорость реакций электрофильного присоединения увеличивается с увеличением числа электронодонорных заместителей при двойной связи субстрата, что увеличивает ее нуклеофильность, облегчает образование -комплекса и его превращение в -комплекс.
CH3 |
CH2 |
- |
CH3 |
- |
|
- |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
||||
|
C CH2 |
|
C CH2 |
CH3 |
CH CH2 |
CH |
2 |
CH |
2 |
CF |
CH CH |
2 |
|
|
|
|
|
|
|
- |
|
|
3 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
уменьшение реакционной способности алкенов в реакциях АЕ
Общая схема механизма реакций гидрогалогенирования:
|
|
|
|
|
|
|
|
|
H |
Hal |
|
|
Hal- |
|
|
|
|
|
|
|
C C + H |
Hal |
C C |
|
|
H C C |
C C Hal |
|
|
-комплекс |
Hal- |
-комплекс |
|
|
|
|
|
|
|||
29

При взаимодействии алкенов с галогеноводородами лимитирующей стадией является присоединение протона через образование -комплекса; реакция оканчивается последующей атакой образовавшегося карбкатиона галогенид-ионом. По мере увеличения кислотности легкость присоединения галогеноводородов возрастает в ряду: HF HCl HBr HI.
В случае алкенов несимметричного строения, например, пропена, бутена-1, 2-метилпропена, присоединение галогеноводородов может приводить к образованию двух продуктов. На практике наблюдается региоселективное протекание реакции согласно правилу Марковникова:
при взаимодействии несимметричных алкенов (алкинов, диенов) с соединениями типа Н-Х, атом Н присоединяется к более гидрогенизированному атому углерода при двойной (тройной) связи, а Х – к менее гидрогенизированному атому углерода. Есть и другие формулировки этого правила: присоединение протона к несимметричным алкенам идет с образованием более стабильного карбкатиона.
|
|
|
|
|
|
|
|
Br |
|||
H3C |
|
C |
|
CH2 + HBr |
|
|
|
|
|
|
|
|
|
H3C |
|
C |
|
CH3 |
|||||
|
|
||||||||||
|
|||||||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
CH3 |
||||||
Механизм реакции:
|
|
|
|
|
|
H3C CH |
|
-комплекс |
|
|
|
|
|
|
H |
Br |
CH |
|
|||
|
|
|
|
|
2 |
|
|
|
||
+ H |
Br |
|
|
|
|
|
|
|
||
H3C C CH2 |
|
|
H C C CH |
2 |
CH3 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
- Br- |
|
|
Br- |
|
Br |
CH3 |
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
H3C C CH3 |
+ |
H C C CH |
||||
|
|
|
|
3 |
|
|
||||
|
|
|
|
-комплекс |
|
|
|
|
3 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
-комплекс |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
30
