
- •Е.В. Рудковская, г.В. Диденко
- •Предисловие
- •Содержание учебного материала Введение
- •Раздел 1. Физико-химические процессы в гидросфере
- •Раздел 2. Физико-химические процессы в атмосфере
- •Раздел 3. Физико-химические процессы в литосфере
- •Заключение
- •Правила поведения в химической лаборатории
- •Первая медицинская помощь Первая медицинская помощь при ожогах и отравлениях
- •Токсичные вещества
- •Классификация токсичных веществ (ядов)
- •Краткие теоретические сведения
- •1. Стеклянная посуда общего назначения
- •3.Работа с мерной посудой
- •4. Мытье посуды
- •Контрольные вопросы:
- •Правила отбора проб воды. Определение органолептических показателей воды
- •Краткие теоретические сведения
- •Техника отбора пробы
- •Определение основных органолептических показателей воды
- •Классификация запахов естественного происхождения
- •Ход работы с предложенных проб воды определите следующие органолептические показатели׃
- •Оценка интенсивность запаха
- •3)Определение цветности воды.
- •Выполнение измерений температуры
- •6)Определение прозрачности
- •Визуальный способ определения мутности Выполнение анализа
- •Лабораторная работа №3 определение общего солесодержания, взвешенных и растворенных веществ
- •Краткие теоретические сведения
- •3) Общее солесодержание
- •Контрольные вопросы׃
- •Краткие теоретические сведения
- •Фотометрический анализ
- •Основной закон светопоглощения (закон Ламберта-Бугера-Бера)
- •Графическое отображение закона Ламберта-Бугера-Бера
- •Ход выполнения работы:
- •2) Количественный фотоколориметрический метод
- •3) Оформление результатов работы
- •Контрольные вопросы:
- •Лабораторная работа №5 определение фосфатов-ионов в природных и сточных водах
- •Краткие теоретические сведения
- •Ход выполнения работы:
- •1)Построение градуировочного графика
- •2)Выполнение определений:
- •Контрольные вопросы:
- •Лабораторная работа №6
- •Краткие теоретические сведения Строение микроскопа
- •Биоиндикация
- •Биотестирование
- •Ход работы:
- •Масляная иммерсия
- •Водная иммерсия
Биоиндикация
Биоиндикация - метод оценки изменений в среде при помощи биологических объектов.
Организмы или сообщества организмов по наличию, состоянию и поведению которых судят об изменениях в среде, называются биоиндикаторами.
С помощью биоиндикаторов можно обнаруживать места скоплений в экологических системах различного рода загрязнений, а также проследить скорость происходящих в окружающей среде изменений.
Основой задачей биоиндикации является разработка методов и критериев, которые могли бы диагностировать ранние нарушения в наиболее чувствительных компонентах природных сообществ.
Биотестирование
Биотестирование - метод оценки токсичности среды с помощью биологических тест-объектов.
Токсичность - свойство химических веществ проявлять повреждающее или летальное действие на живые организмы.
Тест-объекты позволяют констатировать факт токсичности среды независимо от того, какие вещества и в каком сочетании ее обусловливают.
Биологические организмы, используемые в качестве тест-объектов, должны обладать максимальной чувствительностью к токсическим веществам.
Биотестирование как метод оценки токсичности водной среды используется:
при проведении токсикологической оценки промышленных, сточных бытовых, сельскохозяйственных, дренажных, загрязненных природных и пр. вод с целью выявления потенциальных источников загрязнения,
в контроле аварийных сбросов высокотоксичных сточных вод,
при проведении оценки степени токсичности сточных вод на разных стадиях формирования при проектировании локальных очистных сооружений,
в контроле токсичности сточных вод, подаваемых на очистные сооружения биологического типа с целью предупреждения проникновения опасных веществ для биоценозов активного ила,
при определении уровня безопасного разбавления сточных вод для гидробионтов с целью учета результатов биотестирования при корректировке и установлении предельно допустимых сбросов (ПДС) веществ, поступающих в водоемы со сточными водами,
при проведении экологической экспертизы новых материалов, технологий очистки, проектов очистных сооружений и пр.
Тест-объект (test organism) - организм, используемый при оценке токсичности химических веществ, природных и сточных вод, почв, донных отложений, кормов и др.. Тест-объекты, по определению Л.П.Брагинского - "датчики" сигнальной информации о токсичности среды и заменители сложных химических анализов, позволяющие оперативно констатировать факт токсичности (ядовитости, вредности) водной среды ("да" или "нет"), независимо от того, обусловлена ли она наличием одного точно определяемого аналитически вещества или целого комплекса аналитически не определяемых веществ, какой обычно представляют собой сточные воды. Тест-объекты с известной степенью приближения дают количественную оценку уровня токсичности загрязнения водной среды - сточных, сбросных, циркуляционных и природных вод.

Рис.1 Ceriodaphnia affinis
Для биотестирования используются различные гидробионты - водоросли, микроорганизмы, беспозвоночные, рыбы. Наиболее популярные объекты - ювенальные формы планктонных ракообразных-фильтраторов Daphnia magna, Ceriodaphnia affinis. Cемидневный тест на суточной молоди цериодафнии Ceriodaphnia affinis позволяет за более короткий срок (7 сут), чем на Daphnia magna (21 сут) дать заключение о хронической токсичности воды.
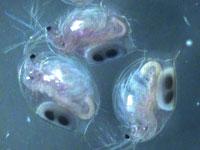
Рис.2 Daphnia magna
Важное условие правильного проведения биотестирования - использование генетически однородных лабораторных культур, так как они проходят поверки чувствительности, содержатся в специальных, оговоренных стандартами лабораторных условиях, обеспечивающих необходимую сходимость и воспроизводимость результатов исследований, а также максимальную чувствительность в токсическим веществам.
Стандартные методики, регламентированные нормативными документами, определяют тест-объекты, которые используются при определении токсичности тех или иных сред. В Украине в качестве стандартных приняты тесты с ветвистоусыми и жаброногими ракообразными, водорослями, инфузориями, светящимися бактериями.
Дафнии – наиболее часто используемый тест-объект для определения токсичности воды. Метод позволяет определить токсичность сточных и природных вод. Критерием острой токсичности является гибель 50% и более дафний в анализируемой воде по сравнению с контролем в течение 24, 48 или 96 ч.
Размеры этих рачков незначительны, обычно меньше 1 мм, редко до 5 мм и в исключительных случаях до 10 мм. Поэтому для изучения их строения приходится пользоваться микроскопом.
Тело дафнии (рис.3), заключено в хитиновую полупрозрачную двустворчатую раковинку, а голова вытянута в направленный вниз клюв, или рострум. На лобной части головы расположен непарный фасеточный глаз, возникший в результате слияния двух боковых глаз, а перед ним — простой науплиальный глазок.
Число фасеток, образующих сложный глаз, различно у разных видов и зависит от способа их питания. Под рострумом прикрепляются палочковидные обыкновенно относительно очень маленькие передние антенны. Зато задние антенны непропорционально велики по сравнению с телом. Они двуветвисты, причем каждая ветвь снабжена длинными перистыми щетинками. Задние антенны служат основным органом передвижения ветвистоусых. Одновременно взмахивая обеими задними антеннами, рачки отталкиваются ими от волы и таким образом плывут короткими скачками. На нижней поверхности головы находится рот, окруженный спереди верхней губой, с боков жвалами и сзади челюстями.

Рис.3 Строение дафнии:
1-передняя антенна; 2-задняя антенна; 3-науплиальный глазок; 4-фасеточный глаз; 5-кишечник; 6-сердце; 7-яичник; 8-эмбрионы в выводковой сумке; 9-брюшко; 10-грудная ножка
Грудной отдел ветвистоусых укорочен и судя по количеству пар ножек, состоит из 4-6 сегментов. Он, как уже указывалось, помещается внутри двустворчатой раковины, но у самок между спинной поверхностью тела и спинным краем раковины имеется обширная полость, выполняющая роль выводковой сумки. В эту сумку откладываются яйца, и при благоприятных условиях там же они развиваются.
У большинства ветвистоусых ракообразных грудные ножки служат для отфильтровывания мелких взвешенных в воде частиц, которыми рачки питаются. В соответствии с этим лопасти грудцых ножек снабжены многочисленными перистыми щетинками, образующими вместе фильтрационный аппарат. Ножки совершают до 300 -500 взмахов в 1 минуту. Из пяти пар грудных ножек Дафнии фильтруют только третья и четвертая. При движении первой пары ножек вперед вода поступает в фильтрующую камеру. В это время третья и четвертая пары изгибаются вперед, обеспечивая дальнейший ток воды. Отфильтрованные пищевые чистицы поступают в брюшной желобок. Пятая пара ног ограничивает сзади фильтрующую камеру. Делая взмах назад, она вместе с четвертой парой вызывает выводящий ток воды. Таким образом, между грудными ножками дафнии функции разделены, что говорит о большей их специализации. Ближайшие к основанию наружные лопасти грудных ног фильтрующих ветвистоусых ракообразных превращены в жабры. По системе полостей кровь поступает в жабры и обогащается в них кислородом.
До тех пор пока условия жизни ветвистоусых рачков благоприятны, в водоемах встречаются только самки, откладывающие и вынашивающие в своих выводковых камерах неоплодотворонные яйца. Число этих яиц различно не только у разных видов, но даже у различных особей одного вида. Разные виды дафний образуют до 50 или даже до 100 яиц на самку. Яйца развиваются в выводковой камере матери, где из них образуются сначала подвижные эмбрионы, а затем вполне сформировавшиеся маленькие рачки, покидающие выводковую камеру и приступающие к самостоятельному существованию. Летом при достаточном количестве пищи, рождение молоди и появление в камере новых яиц происходят каждые 1- 2 дня, благодаря чему численность ветвистоусых может очень быстро увеличиваться.
Вышедшая на свободу молодь часто линяет и быстро растет. Первые три линьки проходят через 1-1,5 суток, а следующие через 2-3 суток. Большинство видов достигает половозрелости после 3-4-ой линьки, т. е. через 2-6 дней после рождения. Так получаются новые поколения самок, продолжающие размножаться партеногенетически.
Но если условия существования ветвистоусых рачков ухудшились вследствие понижения температуры, уменьшения количества пищи или загрязнения водоема. Это ухудшение сейчас же скалывается на судьбе яиц, находящихся в половых путях самки. Ее спинной край становится толще, под раковиной собираются клетки, плотным слоем окружающие яйцо или яйца. У дафний поверх этих клеток выделяется хитиновая оболочка и в выводковой камере возникает так называемое седлышко, или эфиппиум (рис. 4), содержащее обычно два яйца. Формирование эфиппиума продолжается 2-3 дня, и самка носит его в течение 1-2 дней. Затем она линяет, и эфиппиум оказывается на свободе. Благодаря присутствию воздухоносного слоя эфиппиумы дафний плавают на поверхности воды.
Т акие
яйца в эфиппиуме помогают рачкам
переносить всевозможные неблагоприятные
условия; они вмерзают в лед, высыхают,
сохраняя в течение длительного времени
жизнеспособность. В то же время они
служат средством расселения
ветвистоусых, легко переносясь из
водоема в водоем ветром, вместе с
илом, присохшим к лапкам водоплавающих
птиц, т. д. Благодаря своим покоящимся
яйцам ветвистоусые широко распространены
во всех стоячих водоемах нашей планеты.
акие
яйца в эфиппиуме помогают рачкам
переносить всевозможные неблагоприятные
условия; они вмерзают в лед, высыхают,
сохраняя в течение длительного времени
жизнеспособность. В то же время они
служат средством расселения
ветвистоусых, легко переносясь из
водоема в водоем ветром, вместе с
илом, присохшим к лапкам водоплавающих
птиц, т. д. Благодаря своим покоящимся
яйцам ветвистоусые широко распространены
во всех стоячих водоемах нашей планеты.
Рис.4 . Эфиппиум
Культура дафний. Исходный материал желательно приобрести в специальных учреждениях и организациях.
При поддержании культуры в помещении не должно быть вредных газов и токсичных паров. Оптимальная температура 20 ± 2°С, продолжительность светового дня 12-14 ч. (не освещать культуру прямыми солнечными лучами). Посуду для содержания дафний нельзя мыть моющими и органическими растворителями, лучше мыть питьевой содой, при особом загрязнении – хромовой смесью или соляной кислотой. Для культивирования дафний используют водопроводную воду, предварительно отстоянную не менее 7 суток и насыщенную кислородом (pH = 7,0 – 8,2; жесткость общая – 3-4 мг-экв./л; концентрация растворенного кислорода не менее 6,0 мг/л). Раз в 7-10 суток половину объема воды с культурой дафний заменяют на свежую, удаляют скопившийся на дне осадок и при большой плотности (более 25 самок) культуру прореживают. Не следует производить аэрацию воды в сосудах.
Кормом для дафний служат хлебопекарные дрожжи. Для приготовления дрожжевого корма берут 1 г свежих или 0,3 г воздушно-сухих дрожжей, заливают их 100 мл дистиллированной воды. После набухания дрожжи тщательно перемешивают, дают отстояться в течение 30 мин. Надо садочную жидкость добавляют в сосуды с дафниями в количестве 3 мл на 1 л воды. Кормят дафний 1-2 раза в неделю.
Также используют в качестве корма для дафний водоросль Хлореллу. Водоросли для кормления выращивают в стеклянных емкостях при 12-16 часовом освещении лампами дневного света, при температуре от 22 до 25оС, на питательной среде Прата. Питательные растворы готовят на дистиллированной воде. Состав среды Прата, г/дм3 – нитрат калия – 0,1; K2HPO4×3H2O – 0,01; MgSO4×7H2O –0,01; FeCl3×6H2O – 0,001.
В приготовленную питательную среду добавляют 1-5 мл суспензии водорослей Chlorella vulgaris. При выращивании необходимо 2-3 раза в день встряхивать питательный раствор с водорослями. После того, как окраска питательной среды становится интенсивно зеленой (требуемая плотность клеток водорослей 1,5×106 клеток/см3), водоросли отделяют от культивационной среды центрифугированием или отстаиванием в холодильнике (от +2 до +2,5оС) в течение 7-14 дней с последующим отделением осадка. Суспензию водорослей хранят в холодильнике, не допуская замораживания. Для использования в качестве корма суспензия хранится до 30 суток.
Изобильное кормление может привести к потере чувствительности, недостаточное питание – к неадекватному реагированию на воздействие токсичных веществ. Кормят маточную культуру ежедневно или через день водорослевой суспензией и один раз в неделю дрожжевой суспензией. Перед кормлением температуру водорослевой и дрожжевой суспензий доводят до комнатной.
Биотестирование морских вод проводят используя культуру Artemia salina.
Определение общей токсичности основывается на сравнении результатов гибели личинок (науплиусов) артемий в тестируемой воде и воде, отобранной в условно чистом районе, которую использовали в качестве контроля. За критерий токсичности принимают количество погибших личинок в опытных образцах за 72 ч.
Методика проведения экспериментов включает в себя: подготовку тест-объекта к биотестированию, определение пригодности культуры Artemia salina к биотестированию, проведение биотестирования и математическую обработку результатов биотестирования.
Особенностью применения метода биотестирования является то, что он требует отдельной подготовки тест-объекта к проведению экспериментов. Для проведения экспериментов используют личинки артемии на стадии второго ортонауплиуса, которая развивается из сухих яиц на третьи сутки культивирования. Стадия второго ортонауплиуса выбрана как наиболее подвижная и наиболее чувствительная относительно различного рода загрязнений. Для получения второго ортонауплиуса сухие яйца A. salina помещают в отстоянную водопроводную воду из расчета 1 г сухой массы на 100 мл воды. Уже через 30 мин пустые оболочки яиц, всплывшие на поверхность, удаляют декантированием. Отобранные таким образом жизнеспособные яйца еще в течение суток выдерживали в пресной воде при периодическом аэрировании. Через сутки культуру промывают фильтрованной морской водой с соленостью 17 ‰ и pH воды 8,0...8,5 и помещают в чистую фильтрованную морскую воду, где и выдерживают в течение двух суток для развития рачка до стадии второго ортонауплиуса, пригодного для биотестирования. Образование ортонауплиусов из яиц происходит через определенные стадии развития (рисунок 5). Весь цикл преобразования яиц контролируют под микроскопом. Последовательность смены стадий развития изображена на рис. 5.
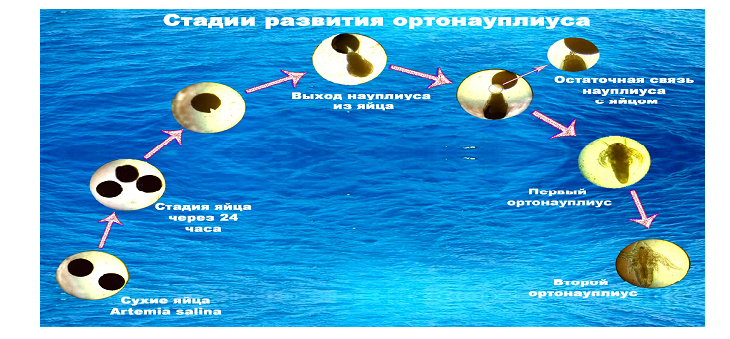
Рис. 5. Стадии развития ортонауплиуса из яйца
Непосредственно перед биотестированием необходимо проверить пригодность личинок артемий для использования их в качестве тест-объекта в экспериментах. Пригодность культуры A. salina к проведению экспериментов определяют по реакции рачков на разные концентрации раствора калия двухромовокислого (K2Cr2O7) в целях выявления средней летальной концентрации (CL50) эталонного вещества, которое вызывает гибель 50 % личинок в течение 24 ч. Для этого готовят серию растворов в диапазоне концентраций 4..10,0 мг/л. Проверку пригодности проводят в трех повторностях для каждой концентрации. По окончании эксперимента подсчитывают количество погибших личинок в каждой концентрации и каждой повторности относительно контроля.
Отбор пробы. Пробу природной (сточной) воды отбирают объемом до 1 л. До биотестирования возможно хранение ее не более 6 часов при температуре 4°С.
Далее пробу фильтруют через фильтровальную бумагу и заливают в емкости для биотестирования.
