
- •Вопрос 1.
- •Дополнительная информация
- •Особенности метаболизма почек.
- •Механизм образования мочи.
- •Моча. Физиологические составные части мочи.
- •Неорганические составные части мочи.
- •Органические составные части мочи.
- •Патологические составные части мочи.
- •Камни в почках.
- •Гомеостатическая функция печени. Клеточный состав, функциональная и метаболическая гетерогенность гепатоцитов (перипортальные и перицентральные клетки).
- •Гомеостаз гормонов. Функциональные пробы печени в связи с ее ролью в обмене.
- •Метаболизм ксенобиотиков основные этапы (поступление, транспорт, детоксикация, конъюгация, выведение).
- •Особенности структуры и функции основных элементов нс – нейрона и нейроглии
- •Понятие о гемато-энцефалическом барьере
- •Особенности обмена углеводов
- •Особенности обмена липидов
- •Метаболические основы электрогенеза. Метаболизм медиаторов в норме и при патологии. Роль антиоксидантов, антигипоксантов, протекторов мембран.
- •Биохимические основы некоторых нервно-психических заболеваний
- •Биохимические механизмы повреждения мозга в результате инсульта
- •Депонирование амилоидного -протеина имеет отношение к патогенезу болезни Альцгеймера
- •Основные функции мышечной ткани (локомоторная, регуляторная и метаболическая). Особенности метаболизма мышечной ткани.
- •Гипокинетический синдром, основы патогенеза
- •Автономность мышечной ткани (запас субстратов, кислорода, макроэргов, набор ферментов, стабилизирующих атф. Субстраты метаболизма
- •Цикл пуриновых нуклеотидов
- •Пути утилизации атф в мышце
- •Характеристика и роль специфических белков мышечной ткани TnC, TnI, TnT, тропомиозина, актомиозина.
- •Механизм электромеханического сопряжения (теория мышечного сокращения).
- •Мышечное расслаблениеМеханизм расслабления. Роль атф-аз, атф.
- •Тетания и трупное окоченение. Ригорный комплекс
- •Гладкие мышцы
- •Метаболизм белков и аминокислот в мышцах
- •Биохимические основы развития сердечной недостаточности (сн)
- •Вопрос 1. Излагается содержание.
- •Вопрос 2. И т.Д.
Биохимические основы развития сердечной недостаточности (сн)
Нарушение энергетического метаболизма.
Дефицит O2 (ишемия, гипоксия, аноксия)
Несоответствие нагрузки функциональной воможности миокарда
Дефицит субстратов (Гл, ЖК, КТ, лактат, ПВК и др.)
В саркоплазме накапливается Ca2+
Митохондрии аккумулируют значительную часть Ca2+
Разобщение дыхания и фосфорилирования.
Разобщение дыхания и фосфорилирования
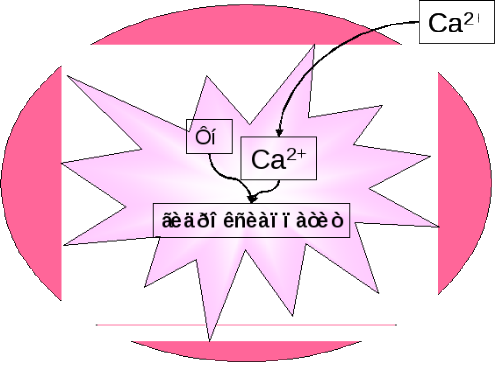
Поступление Ca2+ в МХ снижает мембранный потенциал (Δψ) энергодефицит.
Гидроксиаппатит плохо растворим уменьшается резерв фосфата.
Формирование кислородного голода в миокарде
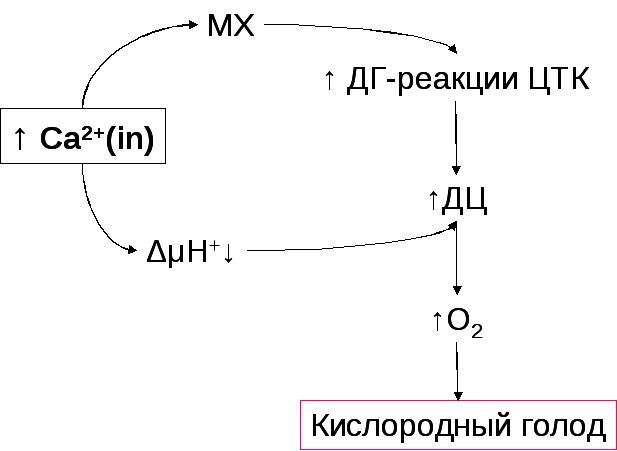
Роль Ca2+ в снижении функциональности миокарда

Последовательность событий в формировании СН
При сердечной недостаточности (СН):
Слабая мышечная стенка растягивается (дилатация).
Повышается синтез коллагена рубцевание миокарда препятствует дилатации снижается эластичность.
Ca2+ ↑ анаэробный гликолиз ↑образование волокон белого типа гипертрофия миокарда усиление биосинтеза мышечных белков.
Ca2+ активирует процессы перекисного окисления (↑ NADH).
Биохимическое обоснование коррекции СН (1)
Аэрация миокарда
Нормализация кровообращения
Нормализация ионного и энергетического баланса
Препараты K+ (печеный картофель, изюм, урюк и т.п.)
Инъекции препаратов глюкозы, инсулина и K+
Сердечные гликозиды (из наперстянки, ландыша, строфанта Комбе) – дигитоксин, дигоксин, дигонин, конваллятоксин, строфантин K.
Высокоспецифичные ингибиторы Na+/K+-АТФазы.
Применение ингибиторов кальциевых каналов и антагонистов Ca2+.
Препараты, увеличивающие уровень АТФ в миокарде
Рибоксин (инозин)
Аспаркам, панангин (глу, асп, K+, Mg2+)
Инозин → ИМФ (+асп) → Аденилосукцинат → АМФ → АДФ → АТФ
L-Карнитин (Элькар)
Осуществляет транспорт ЖК в МХ.
Антиоксиданты (компл. вит. C, A, E)
Бетаин – аналог SAM.
Доцент кафедры биологической химии, Коваль А. Н. ___________
19.10.2006
Министерство здравоохранения Республики Беларусь
УО «Гомельский государственный медицинский университет»
Кафедра биологической химии
Обсуждено на заседании кафедры (МК или ЦУНМС)
Протокол № _________________200__года
ЛЕКЦИЯ по биологической химии
наименование дисциплины
для студентов _2__ курсалечебногофакультета
Тема Биохимия соединительной ткани
Время 90 мин.
Учебные и воспитательные цели:
Характеристика соединительной ткани (СТ). Особенности строения, функции СТ. Особенности метаболизма клеточных элементов СТ (фибробласты, тучные, плазматические клетки и др.).Особенности строения и функциональное значение волокнистых структур СТ.
Коллагеновые волокна. Особенности аминокислотного состава, первичной, вторичной, третичной и четвертичной структуры. Тропоколлаген. Биосинтез и процессинг коллагена (гидроксилирование, ограниченный протеолиз, гликозилирование). Роль аскорбиновой кислоты в процессинге коллагена. Катаболизм коллагена.
Эластиновые волокна. Особенности аминокислотного состава, первичной, вторичной, третичной и четвертичной структуры. Строение десмозина, и изодесмозина, их роль в образовании эластиновых волокон. Метаболизм (синтез и распад) эластиновых волокон.
Строение ретикулиновых волокон. Гликозаминогликаны (ГАГ). Метаболизм ГАГ и факторы, влияющие на метаболизм ГАГ (инсулин, витамин А, соматотропин). Протеогликаны, строение, свойства, роль в поддержании тургора тканей, балансе катионов, воды, обмене биологически активных веществ и др.
Структурная организация межклеточного матрикса. Неколлагеновые структурные гликопротеиды: фибронектин, строение, свойства и функциональная роль. Базальная мембрана, ее строение, свойства и функциональная роль.
Хрящевая ткань, химический состав и особенности метаболизма. Костная ткань, химический состав, структура и формирование кости. Метаболизм костной ткани , факторы, влияющие на ее метаболизм (витамин D, кальцитонин, паратгормон, витамин А, инсулин, соматотропин). Механизм минерализации кости.
Зубы, химический состав и особенности метаболизма. Механизм развития кариеса.
Изменение СТ в онтогенезе, при старении, заживлении ран, гиповитаминозе С, коллагенозах, синдроме Эллерса-Данлоса-Черногубова.
ЛИТЕРАТУРА
1.
2.
3. и т.д.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1. Мультимедийная презентация
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
|
№ п/п |
Перечень учебных вопросов |
Количество выделяемого времени в минутах |
|
|
Характеристика соединительной ткани (СТ). Особенности строения, функции СТ. Особенности метаболизма клеточных элементов СТ (фибробласты, тучные, плазматические клетки и др.).Особенности строения и функциональное значение волокнистых структур СТ. |
10 |
|
|
Коллагеновые волокна. Особенности аминокислотного состава, первичной, вторичной, третичной и четвертичной структуры. Тропоколлаген. Биосинтез и процессинг коллагена (гидроксилирование, ограниченный протеолиз, гликозилирование). Роль аскорбиновой кислоты в процессинге коллагена. Катаболизм коллагена. |
15 |
|
|
Эластиновые волокна. Особенности аминокислотного состава, первичной, вторичной, третичной и четвертичной структуры. Строение десмозина, и изодесмозина, их роль в образовании эластиновых волокон. Метаболизм (синтез и распад) эластиновых волокон. |
10 |
|
|
Строение ретикулиновых волокон. Гликозаминогликаны (ГАГ). Метаболизм ГАГ и факторы, влияющие на метаболизм ГАГ (инсулин, витамин А, соматотропин). Протеогликаны, строение, свойства, роль в поддержании тургора тканей, балансе катионов, воды, обмене биологически активных веществ и др. |
10 |
|
|
Структурная организация межклеточного матрикса. Неколлагеновые структурные гликопротеиды: фибронектин, строение, свойства и функциональная роль. Базальная мембрана, ее строение, свойства и функциональная роль. |
15 |
|
|
Хрящевая ткань, химический состав и особенности метаболизма. Костная ткань, химический состав, структура и формирование кости. Метаболизм костной ткани , факторы, влияющие на ее метаболизм (витамин D, кальцитонин, паратгормон, витамин А, инсулин, соматотропин). Механизм минерализации кости. |
10 |
|
|
Зубы, химический состав и особенности метаболизма. Механизм развития кариеса. |
10 |
|
|
Изменение СТ в онтогенезе, при старении, заживлении ран, гиповитаминозе С, коллагенозах, синдроме Эллерса-Данлоса-Черногубова. |
10 |
Всего 90 мин
Введение
Главными тканями позвоночных являются нервная, мышечная, эпителиальная и соединительная. Клетки в тканях находятся в контакте с большим количеством внеклеточных макромолекул, объединенных в понятие внеклеточный матрикс. В некоторых тканях клетки взаимодействуют при помощи прямых контактов между собой.
Эпителиальная и соединительная ткани являются полярными, если судить по типу взаимоотношений клеток и матрикса. В соединительных тканях значительную часть объема занимает внеклеточное пространство, заполненное молекулами внеклеточного матрикса. Межклеточное вещество соединительной ткани определяет основные её свойства.
В эпителии клетки занимают большую часть объема ткани, образуя плотные слои. Их внеклеточный матрикс беден и представляет собой тонкую основу, называемую базальной мембраной. Она располагается на границе между эпителием и соединительной тканью и играет большую роль в контроле жизнедеятельности клеток. Через цитоплазму каждой эпителиальной клетки проходят тонкие внутриклеточные филаменты. Эти филаменты прямо или опосредованно соединяются с трансмембранными белками в плазматической мембране и, таким образом, образуют специфические соединения между клетками и подлежащей мембраной.
Биомедицинское значение внеклеточного матрикса
Продвижение клеток во время эмбриогенеза зависит от молекул матрикса
Острые и хронические воспаления разворачиваются в тканях при активном посредничестве молекул матрикса
Проблема метастазирования опухолевых клеток тесно связана с внеклеточным матриксом.
Наиболее распространенные заболевания - ревматоидный артрит, остеоартрит, атеросклероз - протекают с участием молекул внеклеточного матрикса.
Широкий спектр коллагеновых заболеваний связан с генетическими нарушениями обмена молекул матрикса
Дефекты лизосомных гидролаз приводят к тяжелым последствиям (мукополисахаридозы).
Старение и проблемы косметики тесно связаны с возможностями влияния на обмен молекул матрикса.
Внеклеточный матрикс образуется и формируется клетками, живущими в матриксе
В большинстве органов молекулы матрикса образуются клетками, называемыми фибробластами или клетками этого семейства (хондробласты в хряще и остеобласты в костной ткани). Их называют постояннымиклетками. К этому типу клеток относят также макрофаги (гистиоциты), тканевые базофилы (тучные клетки, лаброциты, гепариноциты), адипоциты (липоциты), мезенхимные клетки, перициты.
На молекулярный состав межклеточного вещества оказывают влияние и транзиторные клетки.Эти клетки мигрируют в соединительную ткань из крови в ответ на специфический стимул. К ним относятся лимфоциты, плазматические клетки, эозинофилы, нейтрофилы, базофилы и др.
В состав межклеточного матрикса входят 3 основных класса белковых молекул:
протеогликаны (ПГ) - представлены белками, соединенными с полисахаридами - гликозаминогликанами (ГАГ)
фибриллярные белки двух функциональных типов: преимущественноструктурные(семейства коллагена и эластина) и преимущественноадгезивные(семейства фибронектина или ламинина).
Все названные белки относятся к группе белково-углеводных комплексов.
Белково-углеводные комплексы (БУК) внеклеточного матрикса
БУК - особый вид соединений
БУК классифицируются по 2 критериям: (1) количеству (доле) углеводов в комплексе и (2) качественному моносахаридному составу. Различают протеогликаны(свыше 95% углеводов),мукопротеины (10-50% углеводов) игликопротеины (менее 10% углеводов).
Протеогликаны (ПГ)- это белковые комплексы, в которых с молекулами белка ковалентно связаны гликозаминогликаны. Для большинства ГАГ характерны следующие признаки:
содержат сульфатированные сахара
имеют тенденцию состоять из разных дисахаридных единиц, образующих более сложные структуры
один из двух повторяющихся остатков в составе дисахарида - это аминосахар: N- ацетил глюкозамин или галактозамин, который у большинства ГАГ сульфатирован
второй сахар, как правило, уроновая кислота (глюкуроновая или идуроновая)
имеют короткие олигосахаридные цепи
сахара ковалентно связаны с белками в форме протеогликанов
синтезируются внутриклеточно и покидают клетку путем экзоцитоза
ГАГ классифицируют по строению остатков моносахаридов, типу связи между ними, числу и локализации сульфатных групп. Различают несколько семейств ГАГ: 1) гиалуронаты; 2) хондроитин и дерматан сульфаты; 3) кератан сульфаты; 4) гепарин и гепаран сульфаты.
|
|
Гиалуронат:состоит изD-глюкуроната + ГлюNAц связь (1, 3) |
|
|
Дерматан сульфат:состоит изL-идуроната (частично сульфирован) + ГалNAц-4-сульфат Связь (1, 3) |
|
|
Хондроитин 4- и 6-сульфаты:состоят изD-глюкуроната + ГалNAц-4- или 6-сульфата Связь (1, 3) (на рисунке ГалNАц 4-сульфат) |
|
|
Гепарин и гепаран сульфаты:состоят изD-глюкуронат -2-сульфата (или идуронат-2-сульфата) +N-сульфо-D-глюкозамин-6-сульфата Связь (1, 4) (гепараны менее сульфированы чем гепарины) |
|
|
Кератан сульфаты:состоят из галактозы + ГлюNАц-6-сульфата связь (1, 4) |
Рис. 20.1. Структура гликозаминогликанов
Полисахаридные цепи ГАГ - весьма подвижные структуры. В отличие от белков они не могут образовывать компактные глобулы. Благодаря высокой гидрофильности и свободе выбора конформации, ГАГ занимают большие объемы, образуя гели при довольно низких концентрациях самого полисахарида. Это свойство ГАГ создает тургор тканей, позволяющий противостоять компрессионным силам. Например, суставной хрящ может противостоять давлениям в сотни атмосфер.
Гиалуронат обеспечивает клеточную миграцию во время морфогенеза и заживления
Гиалуронан (гиалуроновая кислота или гиалуронат) наиболее простой из ГАГ. Он состоит из повторяющихся (до 250000) несульфированных дисахаридных единиц и обнаружен во всех тканях и жидкостях во все стадии развития животных. Это наиболее ранняя эволюционная форма ГАГ и, возможно, поэтому не может служить типичным примером их строения. Гиалуроновая кислота не содержит в своем составе сульфата, может образовываться прямо на поверхности клеток комплексами ферментов, погруженных в плазматическую мембрану клеток. Она не всегда соединена с белками, а если и соединяется, то эта связь нековалентная. Гиалуронан синтезируется на базальной стороне эпителиального слоя и часто служит для создания свободного от клеток пространства, по которому потом мигрируют клетки во время морфогенеза и заживления ран.
ГАГ, содержащие сульфат - относительно небольшие молекулы
Хондроитинсульфаты (ХД-4-S, ХД-6-S). ПГ, содержащие ХДС с О-гликозидной связью, обнаружены в хряще. Каждая цепь содержит до 40 дисахаридных единиц с ММ около 20000-50000. Хондроитинсульфаты локализуются в местах кальцификации в эндохондральной кости. Протеогликан, содержащий хондроитин сульфаты, обнаружен в некоторых нейронах и может исполнять роль эндоскелетной структуры, поддерживая форму нейрона.
Дерматансульфат. Широко распространен в животных тканях. Структурно подобен ХДС и гепарансульфату. В отличие от ХДС вместо глюкуроновой кислоты в 1-3 связи с N-ацетилгалактозамином содержит идуроновую кислоту. Дерматансульфат в склере придает ей прочность, участвуя в поддержке формы глаза.
Кератансульфаты I и II. Они построены из повторяющихся дисахаридов, включающих галактозу и N-ацетилглюкозамин. Галактоза и глюкозамин в составе этих дисахаридов сульфатированы. Они отличаются также типом соединения с белком. Кератансульфат 1 и дерматансульфат присутствуют в роговице. Они располагаются между коллагеновыми волокнами и играют важную роль в прозрачности роговицы.
Гепарин. Состоит из глюкозамина и двух типов уроновых кислот: глюкуроновой и идуроновой. Большая часть аминогрупп глюкозамина сульфатирована и меньшая - ацетилирована. Идуроновая кислота образуется из глюкуроновой уже после сборки молекулы гепарина при участии специальных ферментов эпимераз. В тканях входит в состав протеогликана. Уникально строение белковой части этих ПГ. Она богата такими аминокислотами как СЕР и ГЛИ. Гепарин выделен из гранул тучных клеток, а также из печени, легких и кожи.
Гепарин является важным антикоагулянтом. Он связывается с факторами IX и XI, но наиболее важным является его взаимодействие с антитромбиномIII. Связываясь с ним в соотношении 1:1, гепарин резко усиливает ингибирующее действие антитромбина. Это связано с тем, что гепарин изменяет конформацию белка, усиливая взаимодействие с сериновыми пептидазами. Гепарин известен также как соединение, способное специфически связываться с липопротеинлипазой на стенках капилляров, вызывая выход фермента в кровоток и усиливая катаболизм хиломикронов.
Гепарансульфат. Встречается преимущественно на клеточной поверхности. В отличие от гепарина в нем преобладает мало сульфатированный глюкозамин и глюкуроновая кислота.
Протеогликаны построены из цепей ГАГ, связанных ковалентно с "коровыми" белками
Обычно все ГАГ находятся в тканях в составе протеогликанов, где они соединены ковалентно с белками (их также называют "коровые белки ", core- англ., основа, ядро), синтезируемыми большинством клеток. Выделяют 3 типа связи между ГАГ и "коровыми" белками:
О-гликозидная связь между ксилулозой и СЕР. Это уникальная для ПГ связь. Она характерна для большинства ПГ и образуется в пострибосомальном процессинге ПГ путем переноса ксилулозы на СЕР корового белка. Субстратом для такого переноса служит УДФ-ксилулоза. Затем к ксилулозе добавляются 2 остатка галактозы, образуя связующий трисахарид. Цепь ГАГ растет путем постепенного наращивания указанного трисахарида.
О-гликозидная связь между N-ацетилгалактозамином и СЕР (ТРЕ), характерна для присоединения кератансульфата. Донором галактозамина является УДФ-N-ацетилгалактозамин.

Рис. 20.2. Схематическое строение протеогликанов
N-гликозиламинная связь между N-ацетиллюкозамином и амидным азотом АСН. В образовании этого типа связи, возможно, участвует долихолпроизводные олигосахариды (см. ниже).
Таблица 20.1. Представители протеогликанов
|
Название |
ММ корового белка |
Тип ГАГ цепей |
Число ГАГ цепей |
Локализация |
Функция |
|
Агрекан |
210 кД |
ХДС, КС |
130 |
хрящ |
опорная |
|
Бетагликан |
36 кД |
ХДС, ДС |
1 |
клеточная поверхность, матрикс |
связывает TGF- |
|
Декорин |
40 кД |
ХДС, ДС |
1 |
широко распространен |
связывает фибриллы коллагена типа 1 и TGF- |
|
Перлекан |
600 кД |
ГС |
2-15 |
базальная мембрана |
структурная и фильтрующая функции в базальной мембране |
|
Серглицин |
20 кД |
ХДС, ДС |
10-15 |
секреторные пузырьки лейкоцитов |
помогает упаковывать и хранить секретируемые молекулы |
|
Синдекан-1 |
32 кД |
ХДС, ГС |
1-3 |
фибробласт, поверхность эпителия |
клеточная адгезия, связывает ФРФ |
Примечание: ХДС - хондроитинсульфат, ГС - гепарансульфат, ДС - дерматан сульфат, ФРФ - фактор роста фибробластов, TGF-- трансформирующий фактор роста.
Протеогликаны могут образовывать огромные полимерные комплексы с размерами, соизмеримыми с размерами бактерий, а соединяясь с другими белками, они образуют сложные структуры. Примером может служить базальная мембрана. Не все протеогликаны секретируются во внеклеточный матрикс. Находясь на поверхности клеток, они являются частью рецепторных комплексов. Другие ПГ являются интегральной частью плазматических мембран и имеют коровый белок, который пронизывает мембрану или соединен с липидами мембраны.
ПГ могут быть компонентами внутриклеточных секреторных пузырьков, где способствуют упаковке и секреции молекул. Вдобавок они участвуют в регуляции активности секретируемых сигнальных молекул. Обусловлено это тем, что связывание с ПГ может ограничивать пространство действия таких молекул (локализация действия) или стерически блокировать их активность, создавать резервуар сигнальных молекул, пролонгируя их действие, защищать их от расщепления. Изменяя конформацию или концентрируя такие молекулы, ПГ способствуют их более эффективному действию (например, рецепторы на плазматической мембране клетки).
На этих свойствах и механизмах основаны многообразные функции ПГ в организме. Являясь структурными компонентами внеклеточного матрикса, (1) они специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином, и другими белками. (2) Как полианионы они связывают поликатионы и катионы. (3) ПГ обеспечивают тургор различных тканей, (4) влияют на клеточную миграцию, (5) противостоят компрессионным силам в хрящевой ткани, (6) поддерживают прозрачность роговицы, (7) выполняют структурную роль в склере, (8) действуют как антикоагулянты. (9) Участвуя в формировании рецепторов на поверхности клеток, они обеспечивают взаимодействие между клетками. (10) ПГ регулируют фильтрацию в клубочках почек, (11) входят в состав синаптических и других везикул клеток.
Гликопротеины и мукопротеины - 2 класса белково-углеводных комплексов, которые можно объединить в один
Гликопротеины и мукопротеины - это белково-углеводные комплексы с ковалентно присоединенными углеводными цепями. Различия между ними касаются лишь количества углеводов в комплексе. Если у гликопротеинов углеводы составляют до 10% , то у мукопротеинов - до 50% от массы молекулы. Из состава глико- и мукопротеинов выделено 7 моносахаридов (табл.19.2).
Таблица 20.2. Моносахариды глико- и мукопротеинов
|
Тип |
Название |
Активная форма |
Примечание |
|
Гексоза |
Галактоза |
УДФ-Гал |
часто расположена субтерминально к N-ацетилнейрминовой кислоте, выделена из корового олигосахарида протеогликанов. |
|
Гексоза |
Глюкоза |
УДФ-Глю |
обычно обнаруживается во время синтеза N-связанных гликопротеинов, но отсутствует в зрелых гликопротеинах |
|
Гексоза |
Манноза |
ГДФ-М*ан |
сахар N-связанных гликопротеинов |
|
|
N-ацетилнейраминовая кислота |
ГМФ-Нейрам |
наиболее частый терминальный сахар в гликопротеинах |
|
Дезоксигексоза |
Фукоза |
ГДФ-Фук |
встречается на концевых отделах гликопротеинов |
|
Аминогексоза |
N-ацетилгалак-тозамин |
УДФ-Галамин |
выделен из всех гликопротеинов |
|
Аминогексоза |
N-ацетилглюкозамин |
УДФ-Гламин |
выделен из всех гликопротеинов |
Функции глико- и мукопротеинов:
Являются структурными компонентами мембраны клетки, коллагеновых, эластиновых и фибриновых волокон, костного матрикса
Защитные свойства: муцины выполняют роль смазочного материала, обусловливая уменьшение трения соприкасающихся поверхностей
Транспортные молекулы для витаминов, липидов, микроэлементов
Иммунная защита: иммуноглобулины, антигены гистосовместимости, комплемент, интерферон - вещества гликопротеиновой природы
Гормоны - гликопротеины: тиротропин, хорионический гонадотропин
Ферменты глико- и мукопротеиновой природы: гидролазы, нуклеазы, гликозидазы, факторы свертывания
Выполняют роль соединительного элемента в межклеточном взаимодействии
Лектины 3
Тип связи между белком и углеводом в БУК - результат разных механизмов синтеза
В зависимости от типа связи между углеводной и белковой частями БУК различают 2 типа БУК: (1) БУК с О-гликозидной связью между СЕР (ТРЕ) и N-ацетилгалактозамином, СЕР и ксилулозой или между гидроксилизином и галактозой (О-связанные БУК); (2) БУК с N- гликозидной связью между АСН и N-ацетилгалактозамином (N-связанные БУК).
Полипептидные цепи (коровые белки) обоих типов БУК синтезируются на мембраносвязанных полирибосомах. Углеводная часть БУК образуется по двум механизмам. (1) Олигосахаридные цепи О-связанных БУКсинтезируются путем постепенного добавления моносахаридов к образованной полипептидной цепи. Этот процесс катализируют мембраносвязанные гликозилтрансферазы. Образование одного типа связи требует отдельного специфического фермента (гипотеза одна связь - одна гликозилтрансфераза). Присоединение первого сахара происходит во время трансляции, а остальные добавляются ферментами, локализованными на эндоплазматической сети. Ферменты, присоединяющие последний сахар, локализованы в аппарате Гольджи.
|
|
Рис. 20.3. Структура долихола |
Образование олигосахаридной части N-связанных БУК происходит отдельно от белковой части. Ведущую роль в синтезе олигосахаридов занимает полиизопреновое соединение долихол (состоит 17-20 изопреновых единиц).

Рис. 20.4. Роль долихол фосфата в синтезе углеводной части БУК
Долихолкиназа превращает долихол в долихолфосфат, который, в свою очередь, вступает в реакцию с УДФ-N-ацетил-глюкозамином с образованием долихол-пирофосфат-N-ацетил-глюкозамина. Затем к этому соединению присоединяется еще одна молекула N-ацетил-глюкозамина, 5 молекул маннозы (ГДФ-манноза как субстрат), затем еще 4 маннозы (донор маннозы долихол -манноза) и, наконец, добавляются 3 периферические остатка глюкозы (донор - долихол-глюкоза).
Образованный олигосахарид переносится на АСН белка, расположенного на люминальной поверхности эдоплазматической сети. Катализируется этот процесс мембраносвязанным ферментом - олигосахарид трансферазой. АСН, с которым соединяется олигосахарид, входит в состав трипептида корового белка АСН-Y-СЕР (ТРЕ), где Y любая аминокислота кроме пролина или АСП. Гликозилируются, в основном, секретируемые белки. Белки цитозоля обычно не гликозилируются. Продукт трансферазной реакции, долихолдифосфат, превращается в долихолфосфат при помощи фосфатазы. Долихолфосфат вновь используется в реакциях переноса.
Ряд соединений способны ингибировать различные этапы синтеза гликопротеинов. В экспериментах часто используют туникамицин, дезоксиноджиримицин и сваинсонин, которые оказывают влияние на гликозилирование. Например, если клетки растут в присутствии туникамицина, нарушается процесс гликозилирования. При этом увеличивается чувствительность таких белков к протеолизу, хотя механизмы секреции значительно не нарушаются.
Нарушение распада белково-углеводных комплексов проявляется тяжелыми заболеваниями
Распад белково-углеводных комплексов катализируется с участием большого набора лизосомальных гидролаз, включающих -нейраминидазу, -галактозидазу, -гексозаминидазу, - и -маннозидазы, -фукозидазу, эндо- -N-ацетилглюкозаминидазу и аспартилглюкозаминидазу. Генетически детерминированный дефект указанных ферментов приводит к нарушению распада БУК. Накопление БУК в лизосомах приводит к различным заболеваниям.
Основными признаками болезней, связанными с недостаточностью гликозидаз, являются: (1) аутосомно-рецессивное наследование; (2) различные проявления и нарушения психики; (3) вакуолизация некоторых клеток, видимая под микроскопом; (4) присутствие ненормальных продуктов распада в моче. Диагностика основана на исследовании активности соответствующих ферментов (чаще всего в лейкоцитах). В ряде случаев возможна пренатальная диагностика путем анализа соответствующих ферментов в амниотической жидкости и крови матери.
Из наиболее известных заболеваний этого типа можно выделить маннозидозы, фукозидозы, сиалидозы и аспартилглюкозаминурию. Их причиной является недостаточность соответственно -маннозидазы, -фукозидазы, нейраминидазы и аспартилглюкозаминидазы. Эти заболевания имеют самые разные проявления, иногда их относят к муколипидозам.
Специфические белки соединительной ткани
Коллаген - главный белок внеклеточного матрикса
Коллагены - хорошо охарактеризованные фибриллярные белки, найденные у всех многоклеточных живых организмов. Они составляет 25% всех белков организма человека Коллагены секретируются как соединительнотканными клетками, так и различными другими типами клеток. Известно свыше 25 разных коллагеновых -цепей, каждая из которых кодируется своими генами. Разные комбинации этих генов подвергаются экспрессии в разных тканях. Теоретически такое разнообразие может дать 10000 типов тройных спиралей в составе коллагена. Однако на сегодняшний день выделено всего лишь 15 типов коллагеновых молекул (изоколлагены). Сведения о некоторых из них упоминаются ниже в таблице 19.3.
Таблица 20.3. Характеристика коллагенов
|
Тип коллагена |
Длина волокна |
Состав |
Выделен из: |
|
Тип I |
300 нм |
[ (I)]2 2(I) |
кости, роговицы, дентина, клапанов сердца, стенки матки |
|
Тип II |
300 нм |
[(II)]3 |
гиалинового хряща, стекловидного тела |
|
Тип III |
300 нм |
[(III)]3 |
дермы, клапанов сердца, десны |
|
Тип IV |
390 нм |
[(IV)]3 |
базальных мембран |
|
Тип V |
300 нм |
[(V)]22(V) |
кости, роговицы, больших сосудов, клапанов сердца |
|
Тип VI |
105 нм |
1(VI),2(VI) |
кровеносных сосудов |
|
Тип VII |
450 нм |
1(VII) |
эндотелия сосудов |
|
Тип VIII |
150 нм |
1(VIII) |
эндотелия сосудов |
|
Тип IX |
200 нм |
1(IX)2(IX) |
хрящевой ткани |
|
Тип X |
150 нм |
1(X) |
хрящевой ткани |
Изоколлагены типа I-III получили название фибрилл формирующих коллагенов, а изоколлагены типа IX и XII - фибрилл ассоциируемых коллагенами. Последние получили такое название, потому что они обычно связаны с коллагеновыми волокнами, которые образовали фибрилл формирующие коллагены. Они обеспечивают соединение волокон с другими молекулами матрикса. Тип IV и VII называют сеть формирующими коллагенами. Они образуют сетевидные структуры и, чаще всего, находятся в базальных мембранах, обеспечивая связь клеточных слоев эпителия с подлежащей соединительной тканью. Это особенно важно для кожи.
У коллагенов особый тип пространственной организации
Общие принципы организации молекул коллагенов хорошо прослеживаются в наиболее хорошо изученном коллагене кожи. На уровне первичной структуры каждую третью позицию в его полипептидной цепи занимает глицин. Наиболее популярной последовательностью аминокислотных остатков является трипептид ГЛИ-X-Y, где положение X и Y могут занимать любые аминокислоты. Чаще всего встречаются ПРО и гидроксиПРО. Кроме того, в этих местах может находиться ЛИЗ или гидроксиЛИЗ. Водородные связи, характерные для спиралей, в коллагене не образуются.

Рис 20.5.G-X-Y- полипептид свернут в левозакрученную спираль. В отличие от-спирали, найденной у многих глобулярных белков, для стабилизации этой структуры. водородные связи не используются.

Рис. 20.6. Триплетные повторы аминокислот в каждой из трех-цепей коллагена. Атомы остатков ГЛИ показаны как маленькие шарики разных оттенков: черный - кислород; темно-серый - азот; белый - амидный водород. Необходимость в глицине в каждой третьей позиции в-цепи основана на снижении стерического напряжения. Другие аминокислоты имеют большие боковые цепи и могут разрушить суперспиральную структуру.

Рис. 20.7.Каждая полоса в этой тройной спирали - это отдельная-цепь коллагена.
Полипептидная цепь молекулы представляет собой левозакрученную спираль с 3 аминокислотными остатками на каждый шаг спирали. Три полипептидные цепи сворачиваются в правозавернутую тройную суперспираль, образуя палочковидные молекулы диаметром 1,4 нм и длиной 300 нм. Размеры радикала глицина, самой популярной аминокислоты коллагена, способствуют образованию тройной спирали. Зрелый коллаген характеризуется низким содержанием серусодержащих и ароматических аминокислот.
Образование коллагеновых волокон - особый тип пострибосомального процессинга белковой молекулы
Индивидуальные цепи коллагена синтезируются на рибосомах и переходят в пространство эндоплазматической сети в форме предшественников про--цепей, содержащих дополнительные пептиды на N и C концах.
Таблица 20.4.Порядок и локализация процессинга проколлагена
|
Внутриклеточно |
Внеклеточно |
|
1. Удаление сигнального пептида 2. Гидроксилирование ПРО и ЛИЗ 3. Гликозилирование гидроксиЛИЗ 4. Образование внутри и межцепочечных S-S связей в дополнительных пептидах. 5. Образование тройной спирали |
|
Гидроксилирование катализируется специфическими пролин и лизил- гидроксилазами, кофакторами которых являются аскорбиновая кислота, ионы Fe 2+, О2и-кетоглутаровая кислота. Гликозилирование гидроксилизина обеспечивается трансгликозидазами, субстратами которых являются УДФ-глюкоза и УДФ-галактоза.
Дополнительные пептиды богаты цистеином. Они участвуют во внутриклеточном формировании тройных спиралей, тормозят образование фибрилл. Дело в том, что образование фибрилл внутри клетки могло бы быть катастрофой для неё. После секреции фибриллярные проколлагеновые молекулы теряют дополнительные пептиды, образуя молекулы коллагена, которые объединяются в волокна. Удаление дополнительных пептидов катализируют внеклеточные ферменты: проколлаген аминопептидаза и проколлаген карбоксипептидаза.

Рис. 20.8.После образования молекулы тропоколлагена, между модифицированными остатками лизина и 5-гидроксилизина замыкаются поперечные ковалентные связи. Такие поперечные связи стабилизируют фибриллы коллагена.

Рис. 20.9.Образование коллагеновых фибрилл

Рис. 20.10.Образование коллагеновых волокон
Процесс образования волокон основан на том, что растворимость коллагеновых молекул почти в 1000 раз меньше, чем молекул проколлагена. Это свойство обеспечивает их тенденцию к самоаггрегации. Фибриллы образуются вблизи клетки, на ее поверхности или, часто, в секретируемых пузырьках, сливающихся с мембраной клетки. Под электронным микроскопом коллагеновые волокна имеют поперечную исчерченность с периодом 67 нм. Причиной такой исчерченности является способ укладки молекул коллагена во время фибриллогенеза. Каждая соседняя молекула в фибрилле смещена на 1/4 своей длины относительно соседней.
Образование поперечных ковалентных связей обеспечивает одно из важных свойств коллагеновых волокон - их механическую прочность. В качестве примера ферментативного обеспечения образования поперечных связей можно привести работу лизилоксидазы. Она катализирует окислительное дезаминирование -аминогруппы лизина в составе молекул коллагена. Коферментом этого фермента является пиридоксальфосфат. В проявлении активности его важное место занимают ионы меди. Образующиеся в результате реакции альдегидные группы соседних молекул коллагена соединяются между собой, обеспечивая образование ковалентных связей между молекулами, фибриллами, волокнами.
О “возрасте” коллагена можно судить по его растворимости в солевых или кислых растворах
На электрофореграмме солевого экстракта (0,14 М раствора NaCl) кусочка грануляционной ткани (ткань, образующаяся на месте повреждения) обнаруживаются две фракции с молекулярной массой, равной молекулярной массе одной цепи и - димеру -цепей коллагена. Их обозначают- и-компоненты коллагена. Выход этих фракций повышается, если коллагены экстрагировать 0,45 М раствором NaCl. Если остаток после солевой экстракции обработать слабым раствором уксусной кислоты или цитратным буфером (рН 3.5-4.0), то в экстракте, где обнаруживаются в основном-компоненты, появляется-компонент, который соответствует тримеру полипептидных цепей.
Остаток после кислотной обработки (нерастворимый коллаген) также можно попытаться растворить, используя более жесткие условия - нагревание в присутствии щелочи. Такое воздействие сопровождается переходом в раствор большого количества -компонентов. По мере развития и “старения” грануляций соотношение икомпонентов в разных экстрактах изменяется. При этом в солевых экстрактах кислоторастворимого и "нерастворимого" коллагена уменьшается доля-компонентов и увеличивается доля и компонентов.
Использование метки подтвердило представление о том, что -компонент - это-цепи “молодого” синтезированного коллагена, который еще не подвергался действию окидазы лизина.-компоненты - это димеры-цепей, сшитых ковалентно, а-компонент - это тример цепей. Цепи, входящие в состав димеров (-компонент) и тримеров (-компонент) необязательно принадлежат одной молекуле коллагена и могут происходить из разных молекул, расположенных по соседству в фибриллах. Такие же изменения претерпевает и коллаген при нормальном “физиологическом” старении. “Молодой” коллаген содержит мало поперечных ковалентных связей и хорошо растворяется в солевых растворах, а “старение” - это процесс образования поперечных связей и уменьшение растворимости в солевых растворах.
Описаны многочисленные нарушения (врожденные и связанные с влиянием внешних условий) процессинга коллагена. Некоторые из них приводятся в табл. 19.5.
Таблица 20.5. Заболевания, вызванные нарушением процессинга коллагена
|
Болезнь |
Дефект обмена |
Клинические проявления |
|
Несовершенный остеогенез |
Голубые склеры, повышенная ломкость и деформации костей |
Дефекты генов, кодирующих 1(I)- цепи. Снижение количества коллагена типа 1. |
|
Синдром Элерс-Данлоса (тип IV) |
Самопроизвольные разрывы артерий, кишечника, матки, легко повреждаемая кожа |
Дефекты генов, кодирующих 1(III)- цепи Нарушение структуры конца цепи коллагена. |
|
Синдром Элерс-Данлоса (тип V) |
Гиперподвижность суставов |
Уменьшение поперечных сшивок |
|
Синдром Элерс-Данлоса (тип VI) |
Нарушение роста, ломкость капилляров |
Недостаточность лизилгидроксилазы. Уменьшение количества гидроксилизина |
|
Синдром Элерс-Данлоса (тип VII) |
Гиперподвижность (разболтанность) суставов, плохое заживление ран |
недостаточность аминопроколлаген пептидазы |
|
Болезнь Менке |
Вьющиеся волосы, задержка роста |
Недостаточность лизилоксидазы и меди. |
|
Синдром Марфана |
Аневризмы аорты, деформации скелета |
Уменьшение поперечных сшивок |
|
Цинга |
Повышена ломкость капилляров, плохое заживление ран |
Снижение количества гидроксипролина |
Семейство эластина придает тканям эластичность
Способность соединительнотканных структур восстанавливать форму после механического воздействия связано с сетью эластических волокон, основой которых являются белки семейства эластина.
Эластин - гидрофильный белок, содержащий в своем составе около 750 аминокислот. Подобно коллагену, в его молекулу входит необычно много пролина и глицина. Однако эластин не гликозилирован и содержит мало гидроксипролина и гидроксилизина. Основные различия между коллагеном и эластином приводятся в табл. 19.6.
Таблица 20.6. Отличительные признаки коллагена и эластина
|
Коллаген |
Эластин |
|
Несколько разных генетических типов |
Один генетический тип |
|
Тройная спираль |
Не образует тройной спирали |
|
(Гли-X-Y)n повторы в структуре |
Нет повторов (Гли-X-Y) |
|
Имеется гидроксипролин |
Нет гидроксипролина |
|
Содержит углеводы |
Нет углеводов |
|
Внутримолекулярные альдольные поперечные связи |
Поперечные связи в форме десмозина |
|
Во время синтеза образуются дополнительные пептиды |
Дополнительных пептидов не образуется |
|
Переваривается коллагеназой |
Переваривается эластазой |

Рис. 20.11. Структура десмозина
Молекула эластина состоит из двух типов фрагментов чередующихся вдоль цепи: (1) гидрофобные сегменты, которые ответственны за эластические свойства молекулы и (2) сегменты, богатые аланином и лизином. Последние сегменты образуют спираль и участвуют в формировании поперечных связей между молекулами. По сути дела, в образовании поперечных связей участвуют десмозин или изодесмозин – продукты межмолекулярной конденсации лизинов.
В образовании эластических волокон принимают участие большое число белков, объединенных в семейство эластина. Эластиновый остов волокна покрыт слоем микрофибрилл, имеющих диаметр 10 нм. Такие микрофибриллы встречаются в матриксе и без эластина. Они состоят из разных гликопротеинов, выполняющих важную роль в интеграции эластиновых волокон.
Фибронектин - внеклеточный адгезивный белок, помогающий клеткам соединяться с матриксом

Рисунок 20.12.Схематическое изображение молекулы димера фибронектина. 2 полипептидные цепи сходны, но не идентичны. В области С-концевых отделов они соединены дисульфидными связями. В каждой цепи имеется по несколько глобулярных доменов, соединенных гибкими полипептидными сегментами. Эти домены могут специфически связываться с другими молекулами или клетками
Внеклеточный матрикс содержит большое число адгезивных неколлагеновых белков, структурной особенностью которых является наличие доменов, способных специфически связываться с другими макромолекулами и рецепторами на поверхности клетки. Непременным компонентом доменов, обеспечивающих взаимодействие с клетками, является последовательность аминокислот арг-гли-асп (RGD).
Фибронектин является высокомолекулярным гликопротеином. Он представляет собой димер двух больших субъединиц, соединенных парой дисульфидных связей на С-концах. Домены содержат небольшие модули, каждый из которых многократно повторяется и обычно кодируется отдельными экзонами. Главный модуль фибронектина, включающий 90 аминокислот, повторяется 15 раз в каждой субединице.
В семейство фибронектина входит фибриллин
Относительно частым врожденным заболеванием, сопровождающимся поражением соединительной ткани, является синдром Марфана. При нем поражаются глаза (эктопия хрусталика), скелет (у многих больных развиваются длинные пальцы, арахнодактилия, разболтаны суставы) и сердечно-сосудистая система (слабость средней оболочки аорты, ведущая к расширению нисходящей аорты). Подобный синдром описан у президента США, А.Линкольна. В большинстве случаев заболевание развивается вследствие мутации гена (хромосома 15), кодирующего белок фибриллин.
Фибриллин - это большой гликопротеин (ММ ~350000), который является структурным компонентом микрофибрилл, толщиной 10-20 нм, найденных в ряде тканей. Они обеспечивают образование эластиновых волокон. Фибриллин найден в хрусталике, периосте, он связан с эластиновыми волокнами в аорте. Такое расположение позволяет объяснить те нарушения, которые обнаруживаются при синдроме Марфана. Другой ген фибриллина обнаружен на хромосоме 5. Правда, дефекты в этом участке обнаружены у лиц с врожденной контрактурной арахнодактилией, но не с синдромом Марфана.
Гликопротеины матрикса помогают клеткам выбирать пути миграции
Фибронектин ускоряет клеточную миграцию, обеспечивая взаимодействие клеток с матриксом. Об этом свидетельствуют опыты, в ходе которых антитела против фибронектина, пептидов с RGD аминокислотными последовательностями и антитела против интегринов, рецепторов фибронектина, вызывали торможение миграции мезодермальных клеток в процессе гаструляции амфибий.
|
|
Рис. 20.13.Пространственное строение тенасцина |
Более распространенным, чем фибронектин (особенно в матриксе эмбриональной ткани) является тенасцин. Тенасцин представляет собой высокомолекулярный гликопротеиновый комплекс, состоящий из 6 идентичных пептидных цепей, связанных между собой дисульфидными связями в форме морской звезды (рис. 19.13). Как и у фибронектина, каждая полипептидная цепь его состоит из нескольких коротких аминокислотных последовательностей, повторяющихся несколько раз, и имеет несколько разных функционально доменов. Одни из этих доменов связываются с трансмембранным протеогликаном - синдеканом, а другие связывают фибронектин
В отличие от фибронектина тенасцин может и ускорять, и ингибировать клеточную адгезию в зависимости от типа клеток Адгезивная и антиадгезивные функции опосредуются разными доменами. Получены доказательства, что антиадгезивное взаимодействие играет важную роль в обеспечении перемещения клеток.
В основе базальной мембраны лежит слоистая сеть, образованная коллагеном IVтипа
Внеклеточный матрикс может образовывать слоистые структуры - базальные мембраны. В ее создании принимают участие несколько типов специализированных молекул внеклеточного матрикса: коллаген IV типа, гепаран сульфат, ламинин и энтактин. Структура коллагена IV типа отличается большой гибкостью. Его тройная спираль прерывается в 26 местах участками аминокислотной последовательности неколлагенового типа.
Из-за дополнительных неколлагеновых доменов на N- и C-концах полипептидов, образующих коллаген типа IV, его молекула длиннее (400 нм), чем у других коллагенов, формирующих фибриллы (300 нм). Двумерная сеточка этого коллагена - компонент внеклеточного матрикса или базальной мембраны, которая служит поверхностью для прикрепления большинства эндотелиальных и эпителиальных клеток или окружает мышечные и жировые клетки.

Рис. 20.14. Структурные особенности коллагена IV типа
Коллаген IV типа (подобно фибриллассоциированным коллагенам) не теряет дополнительные пептиды после секреции. Эти пептиды способствуют образованию длинных фибрилл путем конденсации "бок в бок".
Вначале идет соединение 2-х цепей С-концевыми отделами с образованием димеров, которые N-концами ассоциируются с 3-мя другими молекулами и такой способ распространяется в ширину. Результат такой ассоциации - подвижная многослойная структура, стабилизированная дисульфидными и другими ковалентными связями. При этом образуется нерастворимая сеть, к которой присоединяются другие молекулы.

Рис. 20.15. Механизм образования компонента внеклеточного матрикса - сеточки при участии коллагена IV типа
В состав базальной мембраны, помимо коллагена IV типа, входят гепаран сульфат, ламинин и энтактин
Базальная мембрана - это тонкая пластинка, толщиной 40-120 нм. Она расположена под слоем эпителиальных клеток и отделяет слой этих клеток от подлежащей соединительной ткани, или окружает отдельные мышечные, жировые и швановские клетки, или разделяет два слоя клеток (почки, легкие).
В базальной мембране различают (электронная микроскопия) 2 слоя: электронопропускающий слой (lamina lucida), прилежащий к базальным участкам мембран эпителиальных клеток и электронноплотный слой (lamina densa), расположенный ниже предыдущего. В отдельных случаях можно выделить и третий слой, содержащий коллагеновые волокна подлежащей соединительной ткани.
В базальной мембране кожи коллаген IV типа образует специальные адгезивные волокна. При тяжелом кожном заболевании, получившем название "пузырчатка", эти волокна отсутствуют, и эпидермис легко отделяется от соединительной ткани.
Помимо коллагена IV типа из всех типов базальных мембран выделены гепарансульфатный протеогликан - перлекан и гликопротеины - ламинин и энтактин.

Рис. 20.16. Схема строения ламинина
1 - места соединения с клетками; 2 - места соединения с коллагеном IVтипа; 3 - место связывания с гепарансульфатом; 4 - место связывания с гепарином.
Ламинин - один из первых белков внеклеточного матрикса у развивающегося эмбриона. Молекулярная масса ламинина около 8500000 Да. Он состоит из трех полипептидных цепей, организованных в форме крестообразной структуры, содержит несколько функциональных доменов. Один из них связывает коллаген IV типа, другой - гепарансульфат, два или более доменов связываются с поверхностью клеток.
Молекула энтактина напоминает по форме гирю, связывается с одной молекулой ламинина в местах соединения длинной и коротких цепей ламинина. Энтактин соединяется также с молекулой коллагена, образуя дополнительную связь между ламинином и коллагеном.
Базальная мембрана выполняет разные функции
Базальная мембрана (почки) действует как молекулярный фильтр при образовании мочи. Для выполнения этой функции важным является гепарансульфат. Его удаление резко нарушает фильтрующие функции базальной мембраны. Кроме того, базальная мембрана выполняет роль селективного барьера для движущихся клеток. Она отделяет эпителий от прямого контакта с фибробластами, но не может остановить макрофаги и лимфоциты, проходящие через нее.
Базальная мембрана играет важную роль в регенерации при заживлении ран. При повреждении мышцы, нервов или эпителия базальная мембрана создает “подмостки” для мигрирующих клеток, изменяя архитектонику поврежденной ткани. В некоторых случаях (кожа, роговица) изменяется химический состав базальной мембраны, например, добавлением фибронектина, который ускоряет миграцию клеток для заживления.
Молекулы межклеточного матрикса быстро распадаются
Образование матрикса, его распад или ремоделирование - все это важные и необходимые процессы, участвующие при перестройке тканей. Они сопутствуют развитию организма, заживлению ран, некрозу опухолей или воспалению.
Ключевыми компонентами обмена молекул внеклеточного матрикса и его регуляции являются металлопротеазы матрикса (МПМ) и их ингибиторы (тканевые ингибиторы металлопротеаз матрикса ТИМПМ). Семейство МПМ состоит из металлопротеаз матрикса мембранного типа (МПМ-МТ), которые активируют прожелатиназу А, и каскада металлопротеаз матрикса, которые полностью разрушают молекулы матрикса.
МПМ - это группа ферментов, активность которых зависит от цинка. Они катализируют распад молекул внеклеточного матрикса (протеогликаны, гликопротеины и различные типы коллагена). Клетки секретируют МПМ в форме прометаллопротеаз. Механизм их активирования in vivoпока не известен.
Таблица 20.7.Семейство протеаз внеклеточного матрикса и их субстратная специфичность
|
Фермент |
Молекулярная масса |
Субстрат |
|
МПМ | ||
|
Желатиназы 72 кД желатиназа (МПМ-2; тип IV, коллагеназа А) |
72 |
Денатурированный коллаген, Коллаген IV, V, VII, X, эластин, фибронектин |
|
92-кД желатиназа (МПМ-9; тип IV коллагеназа B) |
92 |
Желатин, коллаген IV, V, фибронектин |
|
Коллагеназы Интерстициальная коллагеназа ( фибробластный тип коллагеназы, МПМ-1) |
52 |
Колаген типов I-III, VII, VIII, X |
|
Нейтрофильная коллагеназа (ПМЯ тип коллагеназы, МПМ-8) |
75-85 |
Коллаген типов I-III |
|
Коллагеназа-3 (МПМ-13) |
52 |
Коллаген типов I-III, VII VIII, X |
|
Стромализины Стромализин-1 (МПМ-3; Транзин) |
57-60 |
Протеогликаны, фибронектин, ламинин, денатурированный коллаген |
|
Стромализин-2 (МПМ-10, Транзин-2) |
55 |
Коллаген III-IV, фибронектин, желатин, предшественники МПМ |
|
Стромализин-3 (МПМ-11) |
61 |
альфа-1-антитрипсин |
|
Матрилизин (МПМ-7, pump-1) |
28 |
Фибронектин, ламинин, протеогликаны, желатин, эластин, энтактин |
|
Металлоэластаза (МПМ-12) |
54 |
Эластин, фибронектин |
|
Мембранные МПМ MT-МПМ (МПМ-14) MT-МПМ-2 MT-МПМ-3 |
66 |
Прожелатиназа-А |
|
Сериновые протеиназы | ||
|
Урокиназный тип активатора плазминогена |
55 |
Гликопротеины, аморфный коллаген |
|
Тканевой активатор плазминогена |
70 |
Гликопротеины, аморфный коллаген |
Примечание: pump-1 - путативная металлопротеиназа
Полагают, что активирование ферментов часто осуществляется путем аутокатализа, результатом которого является удаление N-концевого пептида протеазы. In vitro МПМ могут быть активированы детергентами или органическими производными ртути и такими протеолитическими ферментами как плазмин, трипсин, калликреин, стромализин. Все эти агенты индуцируют конформационные изменения, направленные на образование промежуточной формы частично активированного фермента, который аутокаталитически удаляет часть молекулы с образованием полностью активного фермента.
Биологическое время полураспада БУК колеблется от нескольких дней (протеогликаны кожи) до нескольких месяцев (зрелый коллаген кожи).
Каждый тип соединительной ткани имеет свои специфические наборы молекул
Химические компоненты хряща
Одним из главных химических компонентов хряща является тип IIколлагена. Другим важным компонентом является специфический для хряща протеогликан. Конечная функция хряща определяется функцией этих 2 основных типов молекул. Коллагеновые волокна, прочные на разрыв, усиливают механические свойства довольно непрочного протеогликана. Ориентация коллагеновых волокон определяется направлением воздействий, которым эта ткань противостоит. Протеогликан образует гель, который в 5 раз больше по объему в воде, чем в окружении коллагена. Причем, возможности связывания воды гелем зависят от взаимодействия между этими двумя основными белками хряща. Не исключено, что на это свойство влияют и другие белки хряща.
Главный коллагеновый белок хряща - коллаген II типа [.Он состоит из 3 одинаковых-цепей, гомологичных по аминокислотному составу-цепям коллагена кожи. Коллаген II типа относится к классу главных структурных коллагенов, для которых характерно образование поперечно исчерченных прочных фибрилл. Его волокна разнообразны по диаметру, но, как правило, они тоньше волокон коллагенаIтипа и имеют больше поперечных ковалентных связей. Из хряща выделены и другие типы коллагена, которые составляют около 10 % от общего количества коллагена в хряще. Эти минорные коллагены отличаются по аминокислотному составу, молекулярной массе и свойствам. Их роль пока еще недостаточно хорошо выяснена.
Главный протеогликан хрящазанимает 5-10% от влажного веса хряща. К белковому компоненту протеогликана с ММ 210000 Да присоединяется ковалентными связями несколько типов боковых цепей. В белке ПГ выделяют несколько доменов. На N-конце имеется глобулярный домен (G1), имеющий одну одиночную и одну двойную петли. При помощи этого домена белковая цепь ПГ взаимодействует с гиалуроновой кислотой. Место контакта образовано из 5 дисахаридных структур гиалуроновой кислоты. Несколько таких белковых цепей ПГ могут взаимодействовать с одной молекулой гиалуроновой кислоты. Связь между белком и гиалуроновой кислотой усиливается при помощи специального связывающего белка. По своей структурной организации этот белок гомологичен домену белковой части ПГ, связывющемуся с гиалуроновой кислотой.

Рис. 20.17. Схематическое строение главного протеогликана хряща
Подобного рода связывающие белки обнаружены и в других тканях. Они обеспечивают соединение гиалуроновой кислоты с белковыми цепями. Короткий линейный участок полипептидной цепи отделяет домен G1 от другого глобулярного домена (G2), который гомологичен домену G1, но не имеет третьей петли. Поэтому, несмотря на гомологичность, этот домен не может связываться с молекулой гиалуроновой кислоты. После домена G2 идет участок, богатый кератансульфатом. Он состоит из 23 повторяющихся шести аминокислотных участков, богатых ГЛУ и ПРО. СЕР этих повторов связан О-гликозидными связями с кератансульфатами.
Вслед за богатой кератансульфатом областью расположена главная часть белка ПГ, состоящая из двух участков с разной аминокислотной последовательностью. Первый участок содержит 11 повторов по 40 аминокислот, в которых СЕР-ГЛУ последовательности, соединенные с хондроитин сульфатом, расположены без особой упорядоченности. Второй отрезок содержит 7 повторов по 100 аминокислот. Каждый повтор состоит из отрезка в 30 аминокислот и 7 участков по 10 аминокислот, в каждом из которых есть последовательность СЕР-ГЛУ. К ней обычно присоединена молекула ХДС. С-концевой отдел ПГ содержит третий глобулярный домен. Считают, что он гомологичен лектину, выделенному из печени, и может избирательно связываться с галактозой или фукозой. Характерной особенностью главного ПГ хряща является большое число отрицательно заряженных молекул.
Неколлагеновые белки матрикса и низкомолекулярные протеогликаны
В хряще можно найти специфические и общие для всех видов соединительной ткани белки. Из хрящевой ткани выделены два типа ПГ, содержащих хондроитин сульфат или дерматан сульфат небольшого размера. Белковые цепи этих ПГ гомологичны и содержат последовательности, богатые ЛЕЙ. В частности, такие последовательности содержит белок - фибромодулин. Он обнаружен во многих тканях, что указывает на схожесть их функций. Фибромодулин влияет на фибриллогенез. Он найден в коллагеновых волокнах костной ткани, где его рассматривают как основной регулятор фибриллогенеза.
Еще два белка, бигликан и декорин, выделены из разных тканей и отличаются наличием последовательности СЕР-ГЛИ. Если назначение бигликана неизвестно, то декорин участвует в связывании с коллагенамиIиIIтипов, а также ингибирует фибринолиз. Малые ПГ составляют лишь 1-2% от общей массы всех ПГ хряща.
Белок с ММ 58 кДа. Этот основной белок был впервые изолирован из бычьего суставного хряща. Подобно другим белкам матрикса, он богат АСП, АСН, и ЛЕЙ. Предполагают, что он связывается с поверхностью клеток.
Другие белки, специфичные для хрящевой ткани
Белок хрящевого матрикса с ММ 148 кДа. Этот белок выделяется совместно с главным ПГ хряща. Он состоит из 3-х субъединиц по 54000 Да, связанных S-S связями. Он обладает основными свойствами. В нем обнаружены домены, гомологичные эпидермальному фактору роста. Возможно, он ковалентно связан с белком большого ПГ, поскольку его трудно отделить от ПГ. Функция белка пока неизвестна.
Хрящевой олигомерный высоко молекулярный белок матрикса. Выделен из суставного хряща. Содержит несколько субъединиц с ММ 100 кДа. Значительная часть этого белка может быть выделена из растворов с высокой ионной силой, что говорит о его слабой связи с белками матрикса. В основном, встречается в суставном хряще:
Белок с ММ 36 кДа.Он найден также в костях, но не открыт в других типах соединительной ткани. До 25% всех аминокислот приходится на АСП, АСН и ЛЕЙ. В своем составе не содержит углеводов. Место расположения в хряще неизвестно, выделяется при экстракции гуанидином (4 М). Может связываться с хондроцитами.
Анхорин. Этот белок (ММ 34000) специфически соединяется с коллагеном второго типа, содержит в своем составе 329 аминокислот. Он обнаружен на поверхности хондроцитов и гомологичен внутриклеточным белкам, связывающим кальций. Анхорин содержит 4 внутренних повтора по 70-80 аминокислот, не содержит сигнального пептида. Подобные белки синтезируются фибробластами. Главная функция анхорина заключается в прикреплении коллагена второго типа к поверхности хондроцитов. Это своеобразный механорецептор клетки. Через него на клетки может передаваться напряжение, прилагаемое к ткани.
Хондрокальцин или С-концевой пропептид коллагена второго типа (ММ 35000 Да). Хрящ содержит небольшое количество этого белка, связанного с кристаллами гидроксиапатита. Экстрагируется солевыми растворами. В хряще участвует в процессах минерализации.
Белок с ММ 21 кДа. Маленький белок, богатый АСН, АСП, ГЛУ, ГЛН, ЛЕЙ. Синтезируется гипертрофными хондроцитами и, возможно, связан с коллагеном Х, специфичным для таких хондроцитов.
Белки матрикса, специфичные для костной ткани
Остеокальцин.Изучен наиболее хорошо. ММ 5800 Да. Найден только в костях и зубах, где является преобладающим белком. В его молекуле обнаружены три остатка гамма-карбоксиГЛУ, что говорит о его способности связывать кальций. Прочно связан с апатитом. Участвует в регуляции роста кристаллов. Синтез управляется витамином Д3, что указывает на связь белка и с мобилизацией кальция. Поэтому нарушения обмена этого белка вызывают нарушение функции костной ткани. Аналогичные белки выделены из костной ткани и названы "белками, подобными остеокальцину".
Костный сиалопротеин. Фрагмент этого белка был выделен четверть века назад. Отличается высоким содержанием сиаловых кислот, ММ 59000 Да. Он содержит трипептид АРГ-ГЛУ-АСП, типичный для белков, получивших название интегрины и обладающих способностью связываться с клетками. В последующем было установлено, что связывание с клетками осуществляется через специальный рецептор, который содержит последовательность из 10 ГЛУ, что придает ему кальций-связывающие свойства.
Около половины остатков СЕР этого белка соединены с фосфатом, поэтому его можно считать фосфопротеином. Функция белка неясна, но он тесно связан с клетками и апатитом. Синтез белка тормозится активной формой витамина Д и стимулируется дексаметазоном. Полагают, что белок включается в анаболическую фазу образования костной ткани. Найден только в костях, обладает свойством избирательно связывать стафилококк.
Остеопонтин. Минерализованный матрикс кости содержит еще один анионный белок со свойствами, подобными предыдущему, но с более низким содержанием углеводов. ММ его составляет 32600 Да. Он содержит отрезки отрицательно заряженных кислот (АСП), фосфорилирован по СЕР, содержит трипептид АРГ-ГЛУ-АСП (R-G-D), локализованный в участке для специфического связывания с интегринами4. Синтез остеопонтина стимулирует витамин Д, что отличает его от костного сиалопротеина. Этот белок найден в светлой зоне остеокластов, связанной с минеральным компонентом. Указанные факты наводят на мысль о том, что остеопонтин участвует в привлечении предшественников остеокластов и связывании их с минеральным матриксом. В пользу этой гипотезы свидетельствует и то обстоятельство, что остеокласты имеют большое количество интегриновых рецепторов, которые могут связываться с остеопонтином.
Кроме костной ткани остеопонтин обнаружен в дистальных канальцах почек, в плаценте, ЦНС, эпидермисе мышей. У последних вещества, способствующий образованию опухолей, ускоряли и образование остеопонтина.
Костный кислый гликопротеин. Изолирован из костной ткани, ММ 75000 Да, содержит много сиаловых кислот и фосфата. Кость содержит много других кислых белков, богатых фосфатом. В костях они участвует в минерализации костной ткани.
Остеонектин. Этот белок (ММ 43000 Да) имеет кальций связывающий домен и несколько участков, богатых ГЛУ. Домен не содержит-карбокси-ГЛУ, хотя и напоминает по структуре белки, участвующие в свертывании крови. Этот белок широко распространен в тканях. Возможно, он синтезируется в любой растущей ткани. Связывается с коллагеном и аппатитом.
Тромбоспондин.Белок широко распространен в организме, выделен из тромбоцитов и обнаружен в костях. Состоит из трех субъединиц, ММ 150000 Да. Имеет последовательность АРГ-ГЛУ-АСП, что позволяет ему связываться с поверхностями клеток. Он связывается и с другими белками костной ткани.
Участники процесса минерализации в специализированных видах соединительной ткани
Важным компонентом межклеточного матрикса являются минеральные соединения
Специализированные виды соединительной ткани (костная ткань, дентин, цемент и зубная эмаль) характеризуются высоким содержанием минерального компонента, главной составной частью которого являются фосфорнокислые соли кальция. Образование и распад минерального компонента тесно связаны с обменом кальция и фосфора в организме. В межклеточном матриксе кальций выполняет лишь одну функцию - структурную. В то же время, кальций минерального компонента межклеточного матрикса является депо для внутриклеточного кальция, где он выполняет роль посредника в механизмах внутриклеточного переноса сигналов, поступающих к клетке.
Между внутри- и внеклеточным пространствами существует градиент концентрации кальция
Концентрация кальция во внеклеточной жидкости составляет около 5 ммоль/л и является жестко регулируемой величиной. Внутриклеточная концентрация ионов кальция, наоборот, колеблется от 0,1 до 10 мкмоль/л, во внутриклеточных органеллах - от 1 до 20 мкмоль/л. При таком 5000-10000 кратном различии концентраций создаются условия для возникновения трансмембранных электрических градиентов.
Кальций выполняет важную роль в клетке. Он принимает участие в (1) формировании нейромышечной возбудимости, (2) свертывании крови, (3) процессах секреции, (4) транспорте через мембраны и (5) межклеточных контактах, (6) активности ферментов. (7) Он является посредником в действии гормонов и медиаторов. Кроме того, (8) кальций и фосфор обеспечивают процессы минерализации. Для выполнения всего комплекса этих функций требуется надежная регуляция уровня кальция в жидкостных пространствах организма. Нарушения гомеостаза кальция отмечаются у 3% всех госпитализированных людей.
В организме содержится примерно 1 кг кальция. 99% этой массы сосредоточено в костях, где вместе с фосфатами кальций формирует кристаллы гидроксиапатита - неорганического компонента скелета. Кость является достаточно динамической тканью. Процессы распада и образования костной ткани протекают постоянно. Основная масса кальция обычно не участвует в обменных процессах. Только около 1% его вовлекается в метаболизм, выполняя важную роль источника кальция для внеклеточной жидкости.
В плазме кальций находится в 3 формах (рис. 3.1.1): (1) в виде комплексов с органическими кислотами; (2) связанный с белками; (3) в форме ионов.

Рис. 20.18.Распределение ионов кальция в крови
Около 6% всего кальция входит в состав комплексов с цитратом, фосфатом и другими анионами, а оставшийся примерно поровну делится между кальцием, связанным с белками, и свободным кальцием (ионизированный кальций). Концентрация ионизированного кальция в плазме крови составляет 1,1-1,3 ммоль/л. Именно он у животных, птиц и пресноводных рыб является биологически активной формой кальция. В организме нет защиты от резких колебаний уровня кальция. Если он падает, нарастает возбуждение ЦНС, и могут развиться судороги. Наоборот, значительное увеличение концентрации кальция может приводить к смерти от мышечного паралича и комы.
Плазма крови пересыщена ионами кальция и фосфора. При этом белки плазмы выполняют защитную роль, предупреждая эктопическую кальцификацию. Колебания уровня белков сопровождаются и колебаниями уровня кальция. Например, при уменьшении альбуминов на 1 г/дл уровень кальция снижается на 0,8 мг/дл, и наоборот, при повышении уровня альбуминов увеличивается концентрация кальция. Такая связь с белками зависит от рН. Ацидоз способствует образованию ионизированных форм кальция, а алкалоз благоприятствует связыванию кальция белками. Последнее обстоятельство объясняет развитие судорог при гипервентиляционном синдроме (алкалоз).
В кальциевый гомеостаз включаются 3 гормона
Паратиреоидный гормон (ПТГ) – молекула его представляет собой пептид (ММ 9500), состоящий из 84 аминокислотных остатков. Вся биологическая активность этого гормона принадлежит N-концевому отделу (1-34 аминокислоты). 25-34 аминокислотные остатки отвечают за связывание с рецептором. ПТГ синтезируется в форме предшественника, в состав молекулы которого входит 115 аминокислотных остатков. Это, так называемый, пре-про-ПТГ. Про-ПТГ имеет 6 дополнительных основных аминокислот, функция которых неизвестна. В аппарате Гольджи происходит удаление сигнального пептида. Оттуда новообразованный ПТГ может переноситься для хранения, разрушения, или секретироваться в кровь.
Ведущая роль в расщеплении ПТГ принадлежит печени. Почки участвуют в выделении продуктов его распада. Секреция гормона в кровь зависит от уровня ионов кальция. При увеличении его от 4 мг/дл до 10,5 мг/дл в крови пропорционально снижается количество ПТГ. Присутствие биологически активного гормона в плазме при концентрации кальция выше 10,5 мг/дл характерно для гиперпаратиреоидизма.
Количество секреторных гранул в паращитовидных железах обычно мало и для поддержания максимальной секреции их хватает только на 1,5 часа. Для сравнения, запаса гормонов в островковом аппарате поджелудочной железы хватает на несколько дней, а в щитовидной железе - на несколько недель.
Органами мишенями для ПТГ являются почки и костная ткань. Здесь клетки снабжены специальными рецепторами, с которыми связывается этот гормон.
Участие ПТГ в поддержании баланса кальция обусловлено его прямым действием на костную ткань. Усиливается растворение костной ткани, включая органическую и неорганическую фазы. В результате оттуда кальций устремляется в кровоток. Кроме того, ПТГ стимулирует образование активной формы витамина Д (кальцитриол). Кальцитриол индуцирует образование в клетках кальций связывающих белков, которые увеличивают всасывание кальция из кишечника, снижают выведение его с мочой. Конечный эффект заключается в нарастании уровня кальция в крови.
Влияя на выход кальция из костей, паратирин одновременно увеличивает и выход фосфатов, при этом происходит усиление выведения фосфатов почками. То есть, ПТГ, увеличивая уровень кальция, снижает концентрацию фосфатов. Тем самым предотвращается пересыщение ими крови.
Кальцитриол [1,25(OH)2-D3]. Подробную информацию о структуре, свойствах и обмене кальцитриола можно найти в соответствующих разделах учебника. Здесь мы лишь напомним, что кальцитриол - гормон, который ускоряет перенос кальция против градиента концентрации в эпителии кишечника. Продукция кальцитриола зависит от концентрации кальция в сыворотке крови, соотношения кальция и фосфора, необходимых для образования костной ткани.
Связывают кальцитриол многие клетки, но наиболее хорошо изучено влияние его на клетки кишечника, почек и остеобласты. Там локализованы рецепторы для кальцитриола. Они относятся к семейству стероидных рецепторов и имеют в своем составе домен, связывающийся с ДНК. Образование гормон-рецепторного комплекса приводит к усилению синтеза РНК и кальций связывающего белка.
Кальцитонин.Представляет собой пептид, включающий 32 аминокислотных остатка, секретируемый парафоликулярными клетками щитовидной железы. Для проявления действия его необходима вся молекула. Секреция гормона пропорционально увеличивается при нарастании концентрации кальция от 9,5 до 15 мг/дл. Глюкагон и пентагастрин усиливают секрецию. Органом-мишенью гормона является кость. Под влиянием кальцитонина уменьшается резорбция кости, при этом снижается высвобождение кальция и фосфора. Гормон повышает поступление фосфора в кость, а кальций поступает туда уже вторично. Биохимический механизм такого явления до настоящего времени неясен.
Фосфаты кальция – природные минералы и основа минерального компонента межклеточного матрикса
Ортофосфаты кальция - соли трехосновной фосфорной кислоты. Поэтому они могут быть в форме однозамещенных (H2PO4-), двузамещенных (HPO42-) или фосфат ионов (PO43- ). В состав тканей зубов, костей и дентина входят соли HPO42-, или PO43-. Пирофосфаты встречаются в зубных камнях. В растворах ион пирофосфата оказывает существенный эффект на кристаллизацию некоторых ортофосфатов кальция. Предполагается, что этот эффект важен для контроля величины кристаллов в костях, содержащих небольшие количества пирофосфатов.
Все фосфорнокислые соли кальция представляют собой белые порошки, которые слабо- или нерастворимы в воде, но растворяются в разбавленных кислотах.
Известно множество природных форм фосфатов кальция
Витлокит– одна из форм безводного фосфата трикальций фосфата -Ca3(PO4)2, содержит дивалентные ионы (Mg2+, Mn2+или Fe2+) которые входят в состав кристаллической решетки. Образует ромбические кристаллы. Около 10% фосфата в нем находится в форме HPO42-. В организме встречается редко. Обнаружен в составе зубных камней и в зонах кариозного повреждения эмали.
Монетит (CaHPO4) ибрушит(CaHPO4.2H2O) - вторичные соли фосфорной кислоты. Также редко встречаются в организме. Брушит обнаружен в составе дентина, зубных камней. Монетит кристаллизуется в форме треугольных пластинок, но иногда бывают палочки и призмы. Кристаллы брушита имеют клиновидную форму. Растворимость кристалов монетита зависит от рН. Она быстро увеличивается при рН ниже 6.0. Растворимость брушита в этих условиях также увеличивается, но в ещё большей степени. При нагревании брушит превращается в монетит. При хранении оба минерала гидролизуются в гидроксиапатит Ca10(PO4)6(OH)2.
Октокальций фосфат.Ca8(HPO4)2(PO4)4.5H2O представляет промежуточное связующее звено между кислыми фосфатами - монетитом и брушитом, и основной солью - гидроксиапатитом. Подобно брушиту и апатиту он входит в состав зубных камней. Как видно из формулы, октокальций фосфат содержит кислый фосфатный ион, но не имеет гидроксильных. Содержание воды также колеблется в широких пределах. По своей структуре он напоминает кристаллы апатита, имеет слоистую структуру с чередованием слоев соли толщиной 1,1 нм и слоев воды толщиной 0,8 нм. Учитывая тесную связь с апатитами, он играет важную роль в нуклеации апатитных солей.
Кристаллы октакальций фосфата растут в форме тонких пластинок до 250 мкм длиной. Подобно монетиту и брушиту октокальций фосфат нестабилен в воде и легко гидролизуется в апатит, особенно в теплом щелочном растворе. Низкие концентрации фтора (20-100 мкг/л) резко ускоряет скорость гидролиза. Это привело к предположению о том, что ионы фтора необходимы для отложения апатитов в плотных тканях.
Апатиты.Апатиты имеют общую формулу Ca10(PO4)6X2- где X фтор или OH. Фторапатиты широко распространены в природе, прежде всего, как почвенные минералы. Их даже используют для получения фосфора в промышленности. Гидроксиапатиты преобладают в животном мире. В частности, Они являются основной формой фосфата кальция костей и зубов.
Наряду с тем, что апатиты являются довольно устойчивыми соединениями, они легко обмениваются с окружающей средой. В результате в их составе могут появляться другие ионы (см. табл.19.8):
Таблица 20.8. Замещаемые ионы и заместители в составе апатитов
|
Замещаемые ионы |
Заместители |
|
PO43- |
AsO33-, HPO42-, CO2 |
|
Ca2+ |
Sr, Ba,Pb,Na,H2O,K, Mg |
|
OH- |
F, Cl, Br, J, H2O |
|
2ОН |
CO32-, O2- |
Преимущественным фактором, определяющим возможность замены, является размер атома. Схожесть в зарядах имеет второстепенное значение. Такой принцип замены носит название изоморфного замещения. Тем не менее, в ходе такого замещения поддерживается общее распределение зарядов по принципу: Сa10-х(HPO4)х(PO4)6-х(OH)2-х, где 0<х<1. Потеря в Ca2+частично компенсируется потерей OH-ионов и, частично - H+, присоединенных к фосфату.
Карбонатный апатит. Если основная соль кальция фосфата осаждается при комнатной температуре или температуре тела в присутствии карбонат иона или гидрокарбонат иона, то образующийся апатит будет содержать в своем составе несколько процентов карбоната или гидрокарбоната. Карбонат уменьшает кристалличность апатита и делает его более аморфным. Такая структура напоминает структуру апатитов костей или эмали.
Фторапатит (Ca10(PO4)6F2). Это наиболее стабильный из всех апатитов (температура плавления - 1680оС). Кристаллы фторапатита имеют гексагональную форму: ось a=0,937нм, c=0,688 нм. Плотность кристаллов составляет 3,2 г/см3.
В водной среде реакция взаимодействия фтора с фосфатами кальция зависит от концентрации фтора. Если она сравнительно невысока (до 500 мг/л), то образуются кристаллы фтораппатита:
Ca10(PO4)6OH2 + 2F Ca10(PO4)6F2 + 2OH-
При высоких концентрациях фтора (>2 г/л) кристаллы не образуются:
Ca10(PO4)6OH2 + 20F 10 CaF2 + 6PO43- + 2OH-
Фтор резко уменьшает растворимость гидроксиапатитов в кислой среде. Таким же, но значительно меньшим эффектом обладают ионы цинка, олова. Наоборот, повышение растворимости наблюдается в присутствии ионов цитрата, карбоната, магния.
Стронциевый апатит. Учитывая вышеуказанные замены в кристаллической решетке апатитов, стронций может вытеснять или заменять вакантные места для кальция. Это приводит к нарушению структуры кристаллов. В Забайкалье, вдоль берегов небольшой реки Уров, описано заболевание, получившее название уровская болезнь. Оно сопровождается короткопалостью у людей и поражением костного скелета у животных. В местности, загрязненной радионуклидами, неблагоприятное значение стронциевого апатита для организма человека связано с возможностью депонирования радиоактивного стронция.
Принципы минерализации костной ткани
Элементы кристаллической решетки апатитов могут обмениваться с ионами раствора, окружающего кристалл
Кристаллы апатитов, образуясь в растворах, могут изменяться за счет обмена с ионами, находящимися в этом растворе. В живых системах это свойство апатитов делает их высокочувствительными к ионному составу крови и межклеточной жидкости, который, в свою очередь, зависит от характера пищи и состава потребляемой воды. Сам процесс обмена элементов кристаллической решетки протекает в несколько этапов, каждый из которых имеет свою скорость.
Первый этаппротекает довольно быстро, в течение нескольких минут. Это обмен между гидратной оболочкой кристалла и подвижной жидкостью, в которую погружен кристалл. Он ведет к повышению концентрации отдельных ионов в непосредственной близости кристалла. В этом этапе участвуют многие ионы, разные по размерам и свойствам.На втором этапеидет обмен между ионами гидратной оболочки и поверхностью кристаллов. Здесь происходит отрыв элементов с поверхности кристалла и замена их на ионы гидратной оболочки. В этот процесс включаются ионы фосфорной кислоты, кальция, фтора, стронция, натрия и другие равные им по размерам ионы. Продолжительность этапа составляет несколько часов. Наконец,на третьем этапепроисходит проникновение ионов вглубь кристаллов. Это медленный процесс. Он может проходить в форме изоморфного замещения или заполнения вакантных мест. Он длится месяцами и годами.
Образование кристаллов начинается с нуклеации
Минерализация широко распространена в животном мире. У позвоночных в основе минерализации костного скелета лежит образование кристаллов с участием фосфата кальция. В патологических условиях свыше 20 других солей могут подвергаться кристаллизации (мочевые, желчные, зубные камни).
Внеклеточная жидкость, из которой происходит осаждение соли, представляет пересыщенный раствор фосфата кальция. Процесс осаждения можно разделить на 2 стадии: вначале идет нуклеация, т.е. образование плотного остатка, а затем - рост кристаллов из ядра.
Различают 2 типа нуклеации. Если нуклеация идет в пересыщенном растворе без участия другой фазы, то ее называют гомогенной нуклеацией. Если нуклеацию инициирует другая фаза (часто, твердая фаза), то процесс называют гетерогенной нуклеацией. Второй механизм встречается чаще, поскольку трудно создать чисто однофазный раствор. В обоих типах нуклеации ядра кристаллов небольшие, от 0.5 до 2 нм в диаметре.
Процесс гомогенной нуклеации может быть представлен следующим образом. Вначале некоторое число ионов образует пары или триплеты. Такие же кластеры образуют соседние ионы. Они могут объединяться между собой. Такие кластеры неустойчивы, они быстро распадаются и вновь образуются. Если имеется пересыщенный раствор, могут возникнуть кластеры с размером радиусов выше R крит5, которые могут стать источниками дальнейшего роста кристаллов.
В ходе гетерогенной нуклеации рост кристаллов АХ может иметь место, если в супернасыщенный раствор добавить какой-то другой кристалл S. Образование кластера определенный величины (ядра) на поверхности S включает поверхностную адсорбцию, диффузию на поверхности и последующее включение в кластер. Матрица S при этом может играть роль направляющей в образовании кристаллов АХ. Такой феномен называют эпитаксисом, а процесс образования критических кластеров называют эпитаксичекой нуклеацией.
Рост ионных кристаллов
Механические свойства таких сложных структур как кость и эмаль, состоящих из органических и неорганических компонентов, зависят от величины кристаллов. В отличие от нуклеации, для которой требуется значительное пересыщение ионов в растворе, рост кристаллов требует значительно более низких концентраций участников. При этом используются другие механизмы, которые включают так называемый спиралевидный рост. На образовавшемся ядре возникают спиралевидые структуры, рост которых идет по обычному принципу добавления новых ионов. Шаг такой спирали равен высоте одной структурной единицы кристалла.
Рост кристалла очень чувствителен к присутствию других ионов и молекул, которые выполняют роль ингибиторов кристаллизации. Причем, их концентрация может быть небольшой. Эти молекулы оказывают влияние не только на скорость, но на форму и направление роста кристаллов. С другой стороны, если эти молекулы добавить к другой системе, в которой кристалл растворяется, степень растворения обычно не изменяется. Некоторые комплексные неорганические ионы, ингибирующие рост кристаллов, способны уменьшать и скорость их растворения. Предполагают, что такие соединения адсорбируются на поверхности кристалла и тормозят адсорбцию других ионов. Такими веществами являются, например, гексаметафосфат натрия, который тормозит преципитацию карбоната кальция. Пирофосфаты и полифосфаты, полифосфонаты и некоторые белки слюны тормозят рост кристаллов и нуклеацию гидроксиапатитов.
Расположение атомов и молекул в кристалле можно исследовать при помощи рентгеноструктурного анализа кристаллических решеток. Как правило, частички располагаются в кристалле симметрично. Частички, из которых построен кристалл, называются элементарными ячейками кристалла. Сеточка, образуемая ячейками, называется матрицей кристалла. Имеется семь разных категорий ячеек кристаллов и значит семь типов кристаллов: триклинные, моноклинные, орторомбические, тригональные, тетрагональные, гексагональные и кубические.
Минерализация в тканях - сложный, постоянно протекающий процесс
Наиболее ранняя теория минерализации тканей была предложена в 1923 году. В соответствии с ней для образования кристаллов в тканях важным является локальное высвобождение фосфата при участии активной щелочной фосфатазы из органических молекул. Однако эта теория не могла объяснить высокую активность фермента во многих неминерализующихся тканях.
Когда к 1958 году было показано, что внеклеточная жидкость пересыщена солями фосфата кальция, стало ясно, что кальцификации должна предшествовать нуклеация. После выяснения важности гетерогенного типа нуклеации (см.выше) первым предполагаемым кандидатом на роль неподвижной фазы стал коллаген, а рост кристаллов гидроксиапатита стали представлять по механизму эпитаксиса.
Считается, что не сам коллаген, а молекулы, которые могут связываться с ним, служат инициаторами минерализации. На роль таких молекул претендуют протеогликаны, гликозаминогликаны, белки, содержащие -карбоксиглутаминовую кислоту, или фосфопротеины. Например, хондрокальцин является кальций связывающим белком, который локализован в минерализирующемся фронте хряща. Остеонектин - фосфогликопротеин из костной ткани, связывая гидроксиапатит и коллаген одновременно, может обеспечивать нуклеацию апатита из раствора фосфата кальция. Другие белки, найденные в кальцифицирующихся тканях и связывающие кальций, также могут иметь отношение к минерализации тканей.
В соответствии с данными электронной микроскопии в зонах минерализации выявляются внеклеточные мембраносвязанные тельца, содержащие кристаллы апатита. Предполагается, что именно эти пузырьки являются зонами нуклеации, а коллагеновые волокна лишь пространственно ориентируют рост кристаллов. Установлено, что пузырьки содержат липиды и активную фосфатазу. Считают, что фосфатаза увеличивает локальную концентрацию фосфора, катализируя расщепление органических фосфоросодержащих соединений. Однако такие пузырьки не были обнаружены при минерализации эмали, дентина или цемента.
ЗУБЫ – СЛОЖНЫЙ ОРГАН, ПРОИЗВОДНОЕ ЭПИТЕЛИЯ И СОЕДИНИТЕЛЬНОЙ ТКАНИ
Общая характеристика тканей зуба
З убы
представляют довольно сложно устроенный
орган, состоящий из разных тканей,
отличающихся по строению и происхождению.
В состав зубов входят три вида плотных
тканей: эмаль, дентин и цемент, а также
разновидность рыхлой соединительной
ткани, входящей в пульпу зуба.
убы
представляют довольно сложно устроенный
орган, состоящий из разных тканей,
отличающихся по строению и происхождению.
В состав зубов входят три вида плотных
тканей: эмаль, дентин и цемент, а также
разновидность рыхлой соединительной
ткани, входящей в пульпу зуба.
Рис. 20.19. Схематическое изображение тканей зуба
Особенностью эмали является то обстоятельство, что сразу после ее формирования она утрачивает клетки - главные носители жизни. Зрелая эмаль становится объектом воздействия различных факторов. Не имея своих клеток, она поддерживает нормальное состояние в течениедлительного времени. Эмаль отличается еще и тем, что это самая твердая ткань. По шкале твердости она приближается к кварцу.
Основу зуба составляет дентин. Эта часть зуба менее минерализована. В дентине, в отличие от эмали, имеются клетки, одонтобласты, которые покрывают внутреннюю часть зуба, его полость. Эти клетки позволяют дентину сохранять способность к регенерации в течение всей жизни зуба.
Таблица 19.9. Главные компоненты твердых тканей зуба
|
Компоненты |
Эмаль |
Кость |
Дентин | |||
|
Незрелая |
Зрелая |
Вес % |
Вес % | |||
|
Вес % |
Объем % |
Вес % |
Объем % | |||
|
Неорганические вещества |
37 |
16 |
96 |
88 |
70 |
72 |
|
Органические вещества |
19 |
20 |
0,1 |
0,3 |
22 |
20 |
|
Вода |
44 |
64 |
3,9 |
11,7 |
остатки |
остатки |
|
Основной органический компонент |
Амелогенины и энамелины |
Нерастворимые белки |
коллаген
|
коллаген | ||
|
Неорганический компонент |
Апатитные фосфаты кальция
|
Апатитные фосфаты кальция | ||||
|
Плотность, г/см3 |
1,45 |
2,9-3,0 |
2,01-2,05 |
2,0-2,30 | ||
|
Размеры кристаллов |
Уплощенные гексагоны, около 30 нм в поперечнике, в длину 0,1-5 мкм и более |
50х20х20 нм | ||||
Таблица 19.10. Основные компоненты зрелой эмали человека
|
Компонент |
Содержание, весовые % |
|
Са |
33,6-39,4 |
|
Р |
16,1-18 |
|
СО2 |
1,95-3,66 |
|
Натрий |
0,25-0,90 |
|
Магний |
0,25-0,56 |
|
Хлор |
0,19-0,30 |
|
Калий |
0,05-0,30 |
Корень зуба покрыт тонким слоем цемента, который по многим показателям не отличается от костной ткани. Корень зуба прочно вставляется в костную ткань и прикрепляется перидонтальными связками.
До прорезывания зубов эмаль покрыта мембраной, содержащей бесклеточный слой (толщина 1 мкм) и слой (толщина10 мкм), который состоит из клеток, производивших эмаль. Эта мембрана после прорезывания быстро разрушается, а зубы покрываются кутикулой, состоящей из органической матрицы слюнного происхождения и десквамированного эпителия. На поверхности её находятся бактерии. Синтезируемые ими продукты и мертвые бактерии создают так называемые бляшки. Бляшки могут кальцифицироваться с образованием зубных камней.
Главные компоненты твердых тканей приведены в таблице 19.9. Большую часть зрелой эмали составляют неорганические вещества (96%). В незрелой формирующейся эмали их намного меньше - всего 5%, в эмали молочных зубов - 80%. На долю органических молекул приходится 1,5-2,0%, 18-20% и 20%, соответственно.
Вода составляет 2-3% для зрелой и до 20% - для незрелой эмали. Она там находится в связанном состоянии с органическими и минеральными компонентами. Основная масса неорганических компонентов представлена кристаллами гидроксиапатита (75%), карбонатного апатита (12%), фторапатита (1%) и других форм апатитов. Имеются и аморфные участки неорганического матрикса.
Кроме солей фосфата кальция в составе эмали обнаружены свыше 30 разных элементов. Вторым по популярности после кальция является магний (0,3-0,9%). В относительно больших количествах присутствуют цинк (20-25 мг на 100 г сухого остатка), железо (от 2 до 40 мг на 100 г). Минеральный состав эмали может колебаться в зависимости от характера питания, но процентное соотношение кальция, фосфора и карбоната довольно постоянно. Содержание стронция, свинца и некоторых других микроэлементов в эмали колеблется и зависит от количества их в почве данной местности.
Минеральные вещества неравномерно распределены в эмали. Поверхностные слои более плотные. Они содержат меньше воды, карбонатов, больше фтора. Следует заметить, что минеральные компоненты неравномерно распределены и в самом зубе. Их количество уменьшается в направлении от поверхности к зоне перехода эмали в дентин. Наоборот, количество органических компонентов увеличивается в том же направлении, хотя на поверхности эмали их доля несколько выше.
Органические компоненты эмали
В созревающей эмали содержатся разные по свойствам белки. Их можно разделить на 2 основные группы: амелогенины и энамелины. По мере созревания эмали соотношение этих белков меняется. Если вначале основная масса белков представлена амелогенинами (90%), то впоследствии они постепенно разрушаются и увеличивается доля энамелинов.
Амелогенины содержат в своем составе большое количество остатков ПРО, ЛЕЙ, ГИС, ГЛУ. В них отсутствуют гидроксипролин и цистеин, характерные для коллагена и кератинов. Молекулярная масса их не превышает 30000 Да. Они гидрофобны и склонны к агрегации. Белки, выделенные из разных видов животных, имеют схожий аминокислотный состав, что связывают с их участием в механизмах минерализации. В ходе минерализации они, по-видимому, расщепляются, потому что по мере созревания увеличивается доля низкомолекулярных амелогенинов. Точные детали этого процесса неизвестны, но из незрелой эмали была выделена пептидаза со специфическим действием на амелогенины.
В настоящее время путем клонирования генов, кодирующих амелогенины, удалось установить первичную структуру этих белков. Интересно, что первые 33 аминокислоты на N-конце всех амелогенинов, выделенных из разных видов животных, были одинаковыми. В местах обнаруженных отличий сохранялся принцип, когда гидрофобные участки заменялись на неполярные, а полярные - на полярные. Тем самым сохраняются возможности формирования одинаковых пространственных структур, которые обеспечивают процессы минерализации.
Энамелины- группа кислых белков с молекулярной массой 50000-70000 Да. Они сильно гликозилированы (много гексозаминов - 4% и нейраминовой кислоты - 4%). Мало известно об их аминокислотном составе и пространственной структуре. Недавно было установлено, что вторичная структура энамелинов представлена преимущественно-структурой.
Помимо белков из созревающей эмали выделены пептиды, липиды, моносахариды. Пептиды эмали, кислые по своим свойствам, по аминокислотному составу напоминают энамелины. Созревание эмали сопровождается значительным снижением содержания органических компонентов. Почти 100-200 кратное снижение содержания белков при созревании сопровождается значительным изменением аминокислотного состава. Предполагается, что процесс созревания сопровождается распадом амелогенинов и задержкой распада энамелинов. Энамелины, при этом, прочно присоединяются к кристаллам апатита.
Наружная поверхность эмали содержит меньше белков, чем внутренняя часть. Белки и пептиды, расположенные снаружи, более растворимы в воде.
Химический состав неорганического компонента эмали
Содержание кальция и фосфора в эмали составляет 33,6-39,4 и 16,1-18,0 весовых %, соответственно. В направлении от поверхности зуба к дентину их концентрация снижается. Обычно для кальция она снаружи составляет по массе 37,8 %, а внутри - 34,5 %, для фосфатов - 18 и 15 %, соответственно. При этом соотношение Са/Р сохраняется постоянным (2,1 и 2,3 - весовое и 1,62-1,78 - молярное соотношение). Такая же закономерность распределения концентрационного градиента в эмали относится к хлоридам (табл.4.1.2). А вот содержание карбонатов, натрия, магния и железа в эмали, наоборот, растет в направлении дентина. Интересно, что подобное распределение обнаружено и в непрорезавшихся зубах. Свинец присутствует в низких концентрациях и также накапливается на поверхности. Медь и стронций распределяются равномерно по всей эмали.
Существуют разные представления о молекулярной организации зрелой эмали. Согласно одному из них, предложенному российским биохимиком Петровичем, основой эмали является белковая матрица. Важное место в ее формировании отводится выделенному из эмали Са-связывающему белку (Са-СБ) с молекулярной массой 20000 Да. Трехмерная сеть эмали (рис.4.3.1) образуется путем объединения в пространстве молекул Са-СБ при помощи ионов кальция. Эта сеть становится зоной нуклеации для ориентированного роста кристаллов апатита (ГА). Сеть, образованная молекулами Са-СБ, фиксирована на волокнах амелогенинов.
Р ис.
20.20.Зона нуклеации для роста
кристаллов гидроксиаппатита в эмали
ис.
20.20.Зона нуклеации для роста
кристаллов гидроксиаппатита в эмали
Кристаллы апатитов эмали отличаются от кристаллов других плотных тканей своими размерами (1600 Х 400 ангстрем по сравнению с 640 Х 40 ангстрем для костной ткани). В свою очередь, кристаллы объединяются в призмы. Межпризматические пространства заполнены органическими молекулами и водой. После удаления минеральных компонентов остается тонкая сеть органической матрицы.
По-видимому, образование эмали представляет единый процесс формирования органической матрицы, при участии амелогенинов, и минерализации. После прорезывания зубов эмаль покрыта тонким слоем клеток (10 мкм), который быстро (в первые же минуты) разрушается и сменяется органической кутикулой, образуемой органическими молекулами слюны и продуктами эпителия слизистой.
Компоненты дентина
Дентин - основная составная часть зуба. Он содержит до 70% минеральных веществ,17% органических веществ и 13% воды. Неорганические компоненты представлены кристаллами гидрокси- и фторапатитов, а также аморфным фосфатом кальция.
Таблица 19.11 Органические компоненты дентина и костей
|
Компоненты |
Дентин |
Кость |
|
Органические: |
весовые % | |
|
Коллаген |
17.5-18.5 |
21.2 |
|
Остаточный белок |
0.2 |
0.24 |
|
Лимонная кислота |
0.86-0.89 |
0.8-0.9 |
|
Молочная кислота |
0.15 |
|
|
Липиды |
0.044-0.36 |
0.1 |
|
Хондроитин сульфат |
0.2-0.6 |
0.19 |
|
Сиалопротеин |
|
0.19-0.28 |
|
Кислый гликопротеин |
|
0.074-0.105 |
|
Пептиды |
|
0.13 |
|
Неорганические |
|
|
|
Вода |
5 |
3-4 |
|
Зола |
71.5-72.4 |
70 |
|
Двуокись углерода |
3.0 |
4.0 |
Являясь разновидностью соединительной ткани, дентин содержит присущий этой ткани органический матрикс. Главными компонентами его являются коллаген и протеогликаны. Коллаген дентина, как и в костях, относится к первому типу. Следует отметить, что в предентине образуется избыток α1цепей, что может быть причиной синтеза особого типа коллагена - [α 1 (I)]3. Однако его не обнаруживают после прорезывания зубов.
В отличие от эмали клетки дентина, одонтобласты, функционируют на протяжении всей жизни зуба. Они образуют тонкий слой, выстилающий полость зуба. Отростки клеток пронизывают дентин до сочленения его с эмалью, формируя дентиновые канальцы. Благодаря жизнедеятельности клеток формирование дентина может продолжаться и после прорезывания зубов. В результате образуется вторичный дентин, который заполняет полость зуба и доставляет неудобства при лечебных вмешательствах. Вторичный дентин менее минерализован и содержит больше коллагена. Дентиновые канальцы становятся проводниками зубного ликвора и выполняют, в этом смысле, трофическую функцию.
Важное место в механизмах образования вторичного дентина отводят неколлагеновым белкам дентина. Их строение недостаточно изучено, но установлено, что в ходе формирования вторичного дентина при кариесе их состав и количество меняются в первую очередь. К неколлагеновым белкам относят, в частности, протеогликаны. Преимущественным гликозаминогликаном в их составе является хондроитин-4-сульфат. В меньших количествах обнаружены хондроитин-6-сульфат, гиалуроновая кислота и др. Их соотношение варьируют в зависимости от возраста. Содержание протеогликанов выше в предентине, чем в дентине. Это связано с наличием в предентине ферментов, разрушающих протеогликаны.
Важное место среди неколлагеновых белков дентина занимают фосфопротеины. Эти белки богаты серином, аспарагиновой кислотой, эстерифицированным фосфатом, которые придают белкам кислые свойства. В свою очередь, кислые свойства придают таким белкам способность связываться с кальцием. Они появляются в предентине перед началом минерализации и располагаются на линии фронта минерализации.
В дентине, по сравнению с костной тканью, содержится значительно меньше белков, содержащих γ-карбоксиглутаминовую кислоту. Что касается других органических соединений, то их содержание довольно низкое. Так, количество липидов составляет 0,1 весовых %. Гистохимически показано присутствие фосфолипидов в зоне кристаллизации, хотя роль их в этом процессе мало известна.
Содержание магния в дентине в три раза превышает таковую в костях. Количество карбонатов в дентине выше, чем в эмали. Содержание фтора больше в области, граничащей с пульпой. С возрастом уровень фтора увеличивается.
Несмотря на то, что главным минеральным компонентом дентина является гидроксиапатит, суммарный химический состав его не совпадает с формулой гидроксиапатита. Так, отношение Са/Р для апатита составляет 1.667, а в дентине оно колеблется от 1,5 до 1,7. В дентине присутствуют небольшое количество воды и ионы, которых нет в гидроксиапатите. Ничего удивительного в таком несовпадении нет. Дело в том, что в дентине, помимо гидроксиапатита, присутствует так называемая аморфная (некристаллическая) фаза, включающая фосфат и (или) карбонат кальция. Кроме того, на поверхности кристаллов гидроксиапатита адсорбируются другие ионы. В самой кристаллической решетке возможны замещения и вакансии (табл. 4.3.2)
Таблица 19.12. Возможное распределение ионов в неорганической фазе плотных тканей.
|
Аморфная фаза |
Ca2+, PO43-, CO32-, HCO3-, Mg2+ , |
|
Связываются с поверхностью |
Ca2+, PO43-, HPO42-, CO32-, HCO3 -, Mg2+, K+, вода, цитрат |
|
Замещения и вакансии |
Ca2+,Na+,Sr2+, вакантное место, PO43+, HPO42-, CO32-, HCO3- OH-, Cl, F, CO32-, вода |
Цемент
По химическому составу является разновидностью плотных форм соединительной ткани. 68-70% его массы составляют неорганические соединения, представленные разными формами апатитов. 17-20% приходится на долю органических молекул: коллагена, протеогликанов, липидов и т.д. Оставшиеся 10-15% занимает вода. Цемент прочно соединен с дентином, неравномерно покрывая его в области корня зуба. Снаружи цемент прочно связан с тканями связочного аппарата зуба.
Пульпа
Представляет разновидность рыхлой соединительной ткани. Она слегка уплотняется по направлению к корневой части зуба. Плотная часть пульпы более устойчива к токсинам и микроорганизмам. Пульпа выполняет важную трофическую функцию, а также принимает участие в защитной и репаративной функциях тканей зуба. В составе пульпы обнаружено около 5% неорганических веществ, 40% органических и около 60% воды.
Доцент кафедры биологической химии, Коваль А. Н. ___________
19.10.2006
Министерство здравоохранения Республики Беларусь
УО «Гомельский государственный медицинский университет»
Кафедра биологической химии
Обсуждено на заседании кафедры (МК или ЦУНМС)
Протокол № _________________200__года
ЛЕКЦИЯ по биологической химии
наименование дисциплины
для студентов _2__ курсалечебногофакультета
Тема
Время 90 мин.
Учебные и воспитательные цели:
1.
2.
3. и т.д.
ЛИТЕРАТУРА
1.
2.
3. и т.д.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1. Мультимедийная презентация
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
|
№ п/п |
Перечень учебных вопросов |
Количество выделяемого времени в минутах |
|
1. |
|
|
|
2. |
|
|
|
3. |
|
|
|
и т.д. |
|
|
Всего 90 мин







