
- •Вопрос 1.
- •Дополнительная информация
- •Особенности метаболизма почек.
- •Механизм образования мочи.
- •Моча. Физиологические составные части мочи.
- •Неорганические составные части мочи.
- •Органические составные части мочи.
- •Патологические составные части мочи.
- •Камни в почках.
- •Гомеостатическая функция печени. Клеточный состав, функциональная и метаболическая гетерогенность гепатоцитов (перипортальные и перицентральные клетки).
- •Гомеостаз гормонов. Функциональные пробы печени в связи с ее ролью в обмене.
- •Метаболизм ксенобиотиков основные этапы (поступление, транспорт, детоксикация, конъюгация, выведение).
- •Особенности структуры и функции основных элементов нс – нейрона и нейроглии
- •Понятие о гемато-энцефалическом барьере
- •Особенности обмена углеводов
- •Особенности обмена липидов
- •Метаболические основы электрогенеза. Метаболизм медиаторов в норме и при патологии. Роль антиоксидантов, антигипоксантов, протекторов мембран.
- •Биохимические основы некоторых нервно-психических заболеваний
- •Биохимические механизмы повреждения мозга в результате инсульта
- •Депонирование амилоидного -протеина имеет отношение к патогенезу болезни Альцгеймера
- •Основные функции мышечной ткани (локомоторная, регуляторная и метаболическая). Особенности метаболизма мышечной ткани.
- •Гипокинетический синдром, основы патогенеза
- •Автономность мышечной ткани (запас субстратов, кислорода, макроэргов, набор ферментов, стабилизирующих атф. Субстраты метаболизма
- •Цикл пуриновых нуклеотидов
- •Пути утилизации атф в мышце
- •Характеристика и роль специфических белков мышечной ткани TnC, TnI, TnT, тропомиозина, актомиозина.
- •Механизм электромеханического сопряжения (теория мышечного сокращения).
- •Мышечное расслаблениеМеханизм расслабления. Роль атф-аз, атф.
- •Тетания и трупное окоченение. Ригорный комплекс
- •Гладкие мышцы
- •Метаболизм белков и аминокислот в мышцах
- •Биохимические основы развития сердечной недостаточности (сн)
- •Вопрос 1. Излагается содержание.
- •Вопрос 2. И т.Д.
Тетания и трупное окоченение. Ригорный комплекс
Тетания, состояние чрезмерного мышечного сокращения, иногда развивается при длительной, повторной и суммирующейся стимуляции мышц. Причиной является истощение АТФ и других высокоэнергетических фосфатов, которые помогают поддерживать нормальный уровень АТФ. К высокоэнергетическим фосфатам в данном случае относятся другие нуклеозид трифосфаты (НТФ), креатин фосфат (КФ) и АДФ (см. уравнения 5,6 и 7). Эти реакции катализируют нуклеозид дифосфокиназа, креатин киназа и аденилат киназа, соответственно.
НТФ + АТФ НДФ + АТФ Уравнение 5
КФ + АДФ Креатин + АТФ Уравнение 6
АДФ + АДФ АМФ + АТФ Уравнение 7
Тетаническая стимуляция приводит к нарастанию кальция в саркоплазме и уменьшению АТФ. В результате при сильном мышечном сокращении кальций связан с тропонином-С, но нет АТФ, достаточного для перекачки кальция в цистерны СР и разрыва актомиозиновых поперечных мостиков. Тогда митохондрии получают преимущественную возможность для закачки кальция в свой матрикс. Тем самым создаются условия для удаления кальция, связанного с тропонином-С; места связывания миозина на тонких нитях закрываются, и мышца переходит в расслабленное состояние. Однако отсутствие АТФ оставляет миозин в низкоэнергетическом конформационном состоянии. Поэтому новые циклы мышечной стимуляции хотя и приводят к сокращению мышц, но сила его невелика. Об этой физиологической реакции говорят, как о мышечном утомлении.
Смерть выравнивает все реакции. Одним из первых наступает ионное равновесие во всех отсеках организма из-за потери ионными насосами своих источников энергии. В мышцах это приводит к перемещению кальция из цистерн и извне клетки в саркоплазму. Там его концентрация достигает высокого уровня, что вызывает конформационные изменения в тропонин-тропомиозиновом комплексе. Эти изменения таковы, что места связывания на тонких нитях становятся доступны для миозина. Развивающаяся в результате некотролируемая сократительная активность ускоряет процесс истощения источников АТФ, где все или почти все молекулы миозина вовлечены в поперечно связанные актомиозиновые комплексы. Такое состояние развивается в мышцах вскоре после смерти. Оно обусловлено большим количеством поперечных связей между толстыми и тонкими нитями и известно как трупное окоченение.
Гладкие мышцы
Несмотря на то, что модель скольжения толстых и тонких нитей достаточно адекватно отражает механизм сокращения во всех мышечных группах, имеются значительные различия между поперечно-полосатой и гладкой мускулатурой. Это вытекает хотя бы из того факта, в гладких мышцах потеря тропонина не приводит к утрате сократительной способности, она продолжает регулироваться уровнем цитозольного кальция. Объяснение пришло позже, когда установили, что в регуляцию перемещения тропомиозина гладких мышц к - и от мест связывания миозина на тонких нитях вовлечен белок, связывающий Са2+/кальмодулин. Белок назваликальдесмон. Было установлено, что он участвует в регуляции перемещения тропомиозина гладких мышц к - и от центров связывания миозина на тонких нитях.
В общих чертах, картина выглядит следующим образом. Увеличение уровня цитозольного кальция приводит к повышенному его связыванию с кальмодулином. В свою очередь, комплекс кальция с кальмодулином связывает кальдесмон. Тем самым кальдесмон отщепляется от своего места связывания на тонких нитях. Одновременно наблюдается изменение местоположения тропомиозина в спиральной бороздке F-актина и активируется актомиозиновая АТФ-аза. Когда количество кальция уменьшается, комплекс его с кальмодулином диссоциирует; кальдесмон отщепляется от этого комплекса и соединяется с тонкими нитями. Соответственно, ингибируется активность актомиозиновой АТФ-азы. В сущности, кальдесмон здесь выполняет функцию тропонина в качестве зависимого от кальция (Са2+/кальмодулина) регулятора местонахождения тропомиозина на тонких нитях.
Другой отличительной особенностью гладких мышц является наличие в составе миозина уникальной короткоцепочечной полипептидной цепи, получившей название «легкая цепь Р». Эта субъединица может находиться в фосфорилированном и дефосфорилированном состоянии. Присоединение к ней остатка фосфорной кислоты катализирует специальный фермент – киназа легкой цепи миозина, которая также зависит от комплекса Са2+/кальмодулин. В отсутствие этого комплекса гладкие мышцы неподвижны, киназа неактивна, а легкие Р-цепи нефосфорилированы. Повышение концентрации этого комплекса приводит к активации киназы легких цепей миозина, соответственно, к фосфорилированию легких Р-цепей и сокращению. Дело в том, что для сокращения гладких мышц необходимы фосфорилирование легких Р-цепей миозина и отщепление кальдесмона от тонких нитей. Цепь вышеперечисленных событий, причастных к сокращению гладких мышц, приведена на рис.17.12.
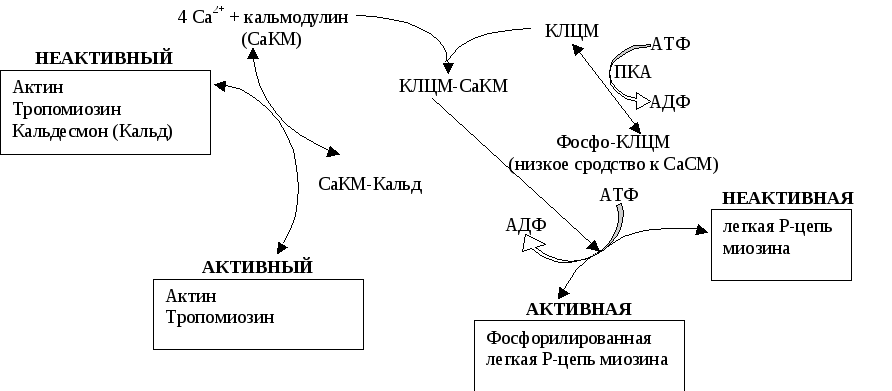
Рис.17.12. Молекулярный механизм сокращения гладких мышц
Увеличение концентрации Са2+до 10-5моля вызывает образование комплекса кальция с кальмодулином (СаКМ), который активирует тонкие нити за счет связывания кальдесмона (Кальд) и освобождая места связывания миозина на тонких нитях. СаКМ также связывает и активирует киназу легкой цепи миозина (КЛЦП). Активная киназа катализирует фосфорилирование легкой цепи-Р миозина, в результате активируется актомиозиновая АТФ-азная активность головок миозина. Связывание адреналина с-адренорецепторами увеличивает количество цАМФ и, следовательно, активность зависимой от цАМФ протеинкиназы (ПКА). В результате снижается сродство МЛЦК к СаКМ, тем самым регулируется сила сокращений, вызванных увеличенным уровнем цитозольного кальция.
Источники энергии для мышечного сокращения
Помимо тех путей образования АТФ, которые показаны в уравнениях 5,6 и 7, этот макроэрг может синтезироваться в ходе гликолиза, путем субстратного фосфорилирования, и при тканевом дыхании (окислительное фосфорилирование) (рис.17.13). Энергию для этого могут поставлять глюкоза, жирные кислоты и кетоновые тела.


Рис.17.13. Источники
энергии для мышечного сокращения![]()
![]()
![]() При неинтенсивной
мышечной работе эти субстраты расщепляются
до конечных продуктов, СО2и Н2О,
а для этого необходим кислород. С
увеличением силы и длительности мышечных
сокращений потребность в кислороде
увеличивается. При этом запасов
предварительно синтезированной АТФ
хватает не более, чем на 1с. Самым быстрым
процессом, способным осуществить
поставку АТФ в этих условях, является
расщепление креатин-фосфата2с помощью креатин киназы. Однако запасов
креатин-фосфата хватает только на
несколько секунд интенсивной мышечной
работы.
При неинтенсивной
мышечной работе эти субстраты расщепляются
до конечных продуктов, СО2и Н2О,
а для этого необходим кислород. С
увеличением силы и длительности мышечных
сокращений потребность в кислороде
увеличивается. При этом запасов
предварительно синтезированной АТФ
хватает не более, чем на 1с. Самым быстрым
процессом, способным осуществить
поставку АТФ в этих условях, является
расщепление креатин-фосфата2с помощью креатин киназы. Однако запасов
креатин-фосфата хватает только на
несколько секунд интенсивной мышечной
работы.
![]() Пожалуй, самым
важным резервом энергии в мышцах
является гликоген, который синтезируется
здесь в период покоя и составляет 2% от
мышечной массы. Глюкоза, которая
высвобождается из гликогена в ходе его
фосфоролитического расщепления,
расходуется на синтез АТФ. Это обеспечивают
процессы анаэробного гликолиза или
окислительного фосфорилирования.
Расщепление гликогена в мышцах находится
под гормональным контролем. Адреналин
активирует его за счет образования
цАМФ и последующей активации киназы
фосфорилазы. Увеличение концентрации
кальция во время мышечного сокращения
также приводит к активации гликоген
фосфорилазы.
Пожалуй, самым
важным резервом энергии в мышцах
является гликоген, который синтезируется
здесь в период покоя и составляет 2% от
мышечной массы. Глюкоза, которая
высвобождается из гликогена в ходе его
фосфоролитического расщепления,
расходуется на синтез АТФ. Это обеспечивают
процессы анаэробного гликолиза или
окислительного фосфорилирования.
Расщепление гликогена в мышцах находится
под гормональным контролем. Адреналин
активирует его за счет образования
цАМФ и последующей активации киназы
фосфорилазы. Увеличение концентрации
кальция во время мышечного сокращения
также приводит к активации гликоген
фосфорилазы.
![]() Очень
непродолжительный период в поддержании
необходимого уровня АТФ участвует
аденилаткиназа (миокиназа). Фермент
катализирует образование АТФ и АМФ из
двух молекул АДФ.
Очень
непродолжительный период в поддержании
необходимого уровня АТФ участвует
аденилаткиназа (миокиназа). Фермент
катализирует образование АТФ и АМФ из
двух молекул АДФ.
![]() Естественно,
что среди всех этих процессов самым
эффективным является окислительное
фосфорилирование. Именно оно обеспечивает
потребность сердечной мышцы в АТФ для
своей постоянной работы. Поэтому
сердечная мышца так чувствительна к
любым нарушениям доставки к ней
кислорода. Необходимо отметить, что
всем мышцам, в которых преимущественным
путем образования АТФ является
окислительное фосфорилирование,
требуется много кислорода. Чтобы
обеспечить его бесперебойное поступление,
в таких мышцах присутствует оксимиоглобин
в качестве своеобразной формы
депонирования кислорода. Наличие
миоглобина придает им красную окраску
("красные мышечные волокна").
Естественно,
что среди всех этих процессов самым
эффективным является окислительное
фосфорилирование. Именно оно обеспечивает
потребность сердечной мышцы в АТФ для
своей постоянной работы. Поэтому
сердечная мышца так чувствительна к
любым нарушениям доставки к ней
кислорода. Необходимо отметить, что
всем мышцам, в которых преимущественным
путем образования АТФ является
окислительное фосфорилирование,
требуется много кислорода. Чтобы
обеспечить его бесперебойное поступление,
в таких мышцах присутствует оксимиоглобин
в качестве своеобразной формы
депонирования кислорода. Наличие
миоглобина придает им красную окраску
("красные мышечные волокна").
В тех мышцах, в которых потребности в АТФ удовлетворяются, главным образом, за счет гликолиза, миоглобина нет. Поэтому они имеют белую окраску ("белые мышечные волокна"). Именно в белых мышечных волокнах сосредоточены большие запасы гликогена. В функциональном плане, различия между красными и белыми мышечными клетками заключаются в том, что в белых волокнах образование АТФ происходит в сравнительно коротком метаболическом пути (гликолизе) за счет субстратного фосфорилирования. В красных мышечных волокнах путь от субстрата (к примеру, та же глюкоза) до АТФ состоит из многих этапов (гликолизокислительное декарбоксилирование пируватаЦТКдыха-тельная цепь) и является более длительным процессом. Вот почему быстро работающие скелетные мышцы состоят преимущественно из использующих гликолиз белых мышечных волокон, в то время как медленно работающие мышцы, как например те, которые поддерживают тонус, используют окислительное фосфорилирование и являются красными.
