
- •Глава 11. Химическое равновесие в газах и растворах
- •11.1. Химическое равновесие. Условия химического равновесия
- •11.2. Закон действия масс
- •11.3. Уравнение изотермы химической реакции. Химическое сродство
- •11.4. Влияние внешних условий на положение равновесия. Принцип подвижного равновесия
- •11.5. Влияние температуры на химическое равновесие
- •11.6. Гетерогенные химические равновесия
- •11.7. Комбинирование равновесий
- •11.8. Химическое равновесие и тепловой закон Нернста
11.5. Влияние температуры на химическое равновесие
Количественную зависимость константы химического равновесия от температуры можно получить, исходя из уравнения Гиббса – Гельмгольца (4.65) и уравнения связи константы равновесия с изменением стандартной энергии Гиббса (11.20):
Gо=Н+Т (Gо/Т)р, (11.22)
Gо= –RT lnKр. (11.23)
Продифференцируем второе уравнение по температуре:
(Gо/Т)р= –RT lnKр–RT(lnKр/Т)р (11.24)
и подставим это значение и значение Gов уравнение (11.22):
– RT lnKр=Н–RT lnKр–RT2(lnKр/Т)р. (11.25)
Считая, что Крне зависит от давления, окончательно получим:
dlnKр/dT=Н/RT2. (11.26)
Уравнение (11.26), определяющее температурные изменения константы равновесия, называется уравнением изобары Вант-Гоффа. Аналогично можно получить уравнениеизохоры Вант-Гоффа:
dlnKс/dT=U/RT2. (11.27)
В уравнениях (11.26) и (11.27) величины HиUпредставляют собой тепловой эффект реакции при постоянном давлении или при постоянном объеме соответственно.
Как видно из этих уравнений, для эндотермических реакций (H> 0 илиU> 0) величинаdlnKр/dT> 0, т.е. при повышении температуры возрастает константа равновесия для эндотермической реакции, что согласуется с принципом подвижного равновесия.
При интегрировании уравнения (11.26) в широком интервале температур, получим:
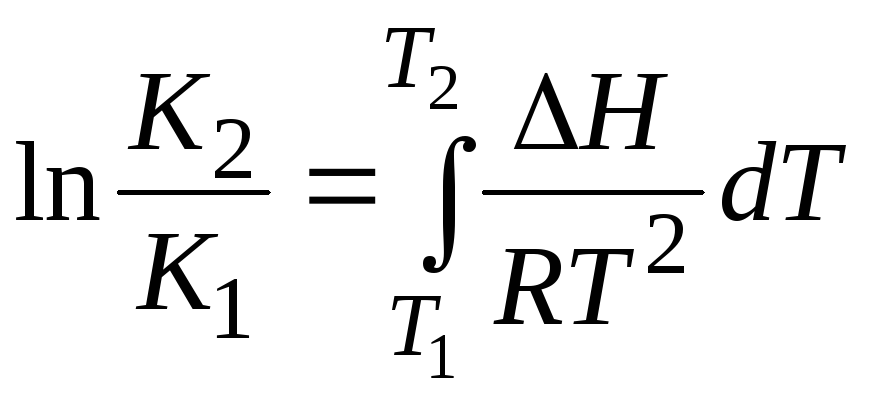 , (11.28)
, (11.28)
где K1иK2– константы равновесия при температурахT1иT2соответственно.
Точное решение этого уравнения возможно лишь при условии, что известна температурная зависимость теплового эффекта реакции. Ее можно рассчитать по уравнению Кирхгоффа
 , (11.29)
, (11.29)
Рис.11.1. Зависимость
констант
равновесия
от
температуры

В небольшом температурном интервале можно считать величину Нпостоянной, тогда интегрирование уравнения (11.26) приводит к зависимости:
lnKр=![]() +С, (11.30)
+С, (11.30)
где С– постоянная интегрирования.
Таким образом, логарифм константы равновесия является линейной функцией 1/T.
Если провести интегрирование в некотором интервале температур от T1доT2, то, считаяН= const, получим:
![]() . (11.31)
. (11.31)
11.6. Гетерогенные химические равновесия
Если химическое равновесие устанавливается в системе, в которой реагирующие вещества находятся в разных фазах, то такое равновесие называется гетерогенным. Это, например, реакции
FeO(тв) + CO(газ)LFe(тв) + CO2(газ),
NH4Cl(тв)LNH3(газ) + HCl(газ),
Fe(расплав) + H2S(газ)LFeS(растворвFe) + Н2(газ)
и множество других.
Условие химического равновесия (11.5) справедливо и для гетерогенного равновесия и позволяет найти выражение закона действия масс для этого случая.
Запишем уравнение гетерогенной химической реакции, в которой компоненты Аінаходятся в газовой фазе, а компоненты Вk– в жидкой или твердой фазах:
іАі+kВkL![]() +
+![]() (11.32)
(11.32)
Представим сумму химических потенциалов уравнения (11.5) в виде двух сумм - химических потенциалов газообразных компонентов (индекс i) и компонентов жидких и твердых растворов (индексk):
і і+k k= 0. (11.33)
Подставив в это
уравнение значения і=![]() (Т)
+RT lnfі (для газов) иk=
(Т)
+RT lnfі (для газов) иk=
![]() (p,T)
+RT lnak(для компонентов жидких и твердых
растворов), получим:
(p,T)
+RT lnak(для компонентов жидких и твердых
растворов), получим:
і![]() (Т)
+k
(Т)
+k![]() (p,T)
+RT іlnfі+RT klnak= 0 (11.34)
(p,T)
+RT іlnfі+RT klnak= 0 (11.34)
или
ln![]() +
ln
+
ln![]() =
–
=
–
![]() . (11.35)
. (11.35)
Обозначив произведение летучестей и активностей через Kfa, получим:
ln![]() =
lnKfa
= –
=
lnKfa
= –
![]() = ln
(p,T), (11.36)
= ln
(p,T), (11.36)
где (p,T) – некоторая постоянная при заданных давлении и температуре.
Константа гетерогенного химического равновесия
Kfa=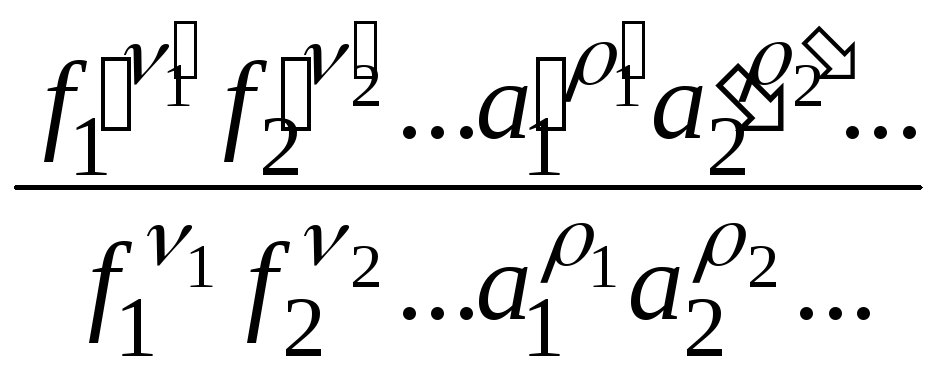 =
(p,T) (11.37)
=
(p,T) (11.37)
также является постоянной величиной при заданных pиT.
Если газовая фаза представляет собой смесь идеальных газов, а конденсированные фазы также являются идеальными жидкими или твердыми растворами, то парциальные равновесные летучести газов fiможно заменить соответствующими давлениямиpi, а равновесные активности компонентовakв жидкой и твердой фазах – их мольными долямиxk, тогдаKfa=Kpx.
В ряде случаев гетерогенных химических реакций твердые или жидкие фазы состоят из индивидуальных веществ, активности которых при постоянной температуре ak= const (xk= 1) и могут быть включены в константы равновесий. Тогда в уравнении костанты равновесия (11.37) будут фигурировать только парциальные летучести (парциальные давления для идеальных газов) компонентов в газовой фазе. Например, при разложении карбоната кальция твердыми фазами являются индивидуальные CaCO3и CaO, поэтому для реакции
CaCO3LCaO + CO2
константа равновесия
Kp=![]() . (11.38)
. (11.38)
Эту величину называют еще упругостью диссоциации; она увеличивается при повышении температуры. КогдаKp становится равной внешнему давлению, происходит бурное разложение вещества.
Константа равновесия гетерогенной реакции получения генераторного газа
С + CO2L2CO
Kp=![]() /
/![]() =х2Р/(1
–х), (11.39)
=х2Р/(1
–х), (11.39)
где x– мольная доля СО в газовой смеси, аP– общее давление.
