
- •Глава 11. Химическое равновесие в газах и растворах
- •11.1. Химическое равновесие. Условия химического равновесия
- •11.2. Закон действия масс
- •11.3. Уравнение изотермы химической реакции. Химическое сродство
- •11.4. Влияние внешних условий на положение равновесия. Принцип подвижного равновесия
- •11.5. Влияние температуры на химическое равновесие
- •11.6. Гетерогенные химические равновесия
- •11.7. Комбинирование равновесий
- •11.8. Химическое равновесие и тепловой закон Нернста
11.2. Закон действия масс
Если реакция протекает в газовой фазе, то химические потенциалы реагирующих веществ можно выразить через их парциальные давления или парциальные летучести:
і=![]() +RTlnpіабоі=
+RTlnpіабоі=![]() +RTlnfі. (11.7)
+RTlnfі. (11.7)
Полагая, что реагирующие вещества ведут себя как идеальные газы, подставим значения их химических потенциалов в уравнение (11.5), тогда в состоянии равновесия
і![]() +RTіlnpі= 0. (11.8)
+RTіlnpі= 0. (11.8)
Отсюда
іlnpі= –![]() =f(Т), (11.9)
=f(Т), (11.9)
т.е. іlnpізависит только от температуры. Заменив сумму логарифмов логарифмом произведения парциальных давлений, аf(T) – логарифмом некоторой функцииKр(T), получим:
ln![]() =
–
=
–![]() =
lnKр(Т) (11.10)
=
lnKр(Т) (11.10)
или
![]() =
=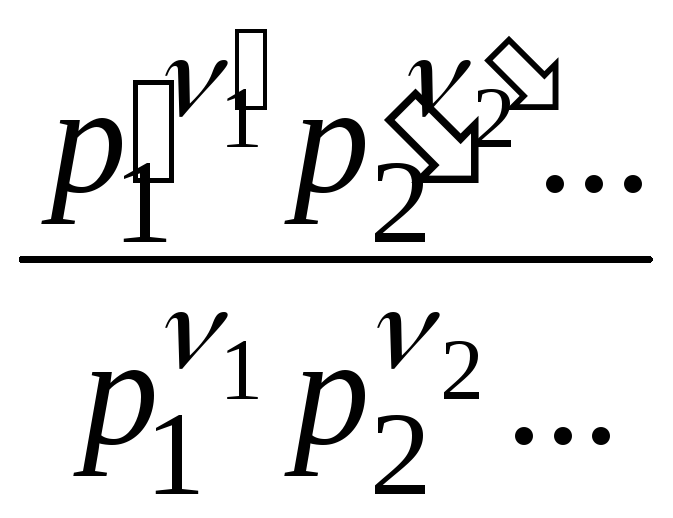 =Kр(Т). (11.11)
=Kр(Т). (11.11)
Величина Kр, выраженная через парциальные равновесные давления компонентов, зависит только от температуры и не зависит от суммарного давления и парциальных давлений компонентов в исходной смеси. При постоянной температуреKр= const.
Величина Kрназываетсяконстантой химического равновесия(или просто константой равновесия), а уравнение (11.11) представляет собой математическую записьзакона действия масс.
В случае реальных газов величина Kрменяется при изменении давления, поэтому для описания равновесия в этом случае пользуются константой равновесияKf, выраженной через равновесные парциальные летучестиfівместо парциальных давленийрі. . ВеличинаKfзависит только от температуры и не зависит от давления. По мере уменьшения давления величиныKриKfсближаются и прир0Kр=Kf.
Константу равновесия можно также выражать через числа молей nі, молярные концентрациисі или мольные долихі реагирующих веществ, исходя из связи между этими величинами и парциальными давлениями (Р – общее давление, V – общий объем системы):
рі=![]() RT=сіRT=хіР. (11.12)
RT=сіRT=хіР. (11.12)
Подставляя эти значения в уравнение закона действия масс (11.11), получим:
Kр=![]() =
=![]() =
=![]() =
=![]() . (11.13)
. (11.13)
Обозначим произведения
![]() ,
,![]() и
и![]() черезKn,KсіKх,
которые представляют константы
равновесия, выраженные через числа
молей, молярности или мольные доли
реагирующих веществ в равновесной
системе. Как видно из предыдущего
уравнения, связь между этими константами
равновесия определяется соотношениями:
черезKn,KсіKх,
которые представляют константы
равновесия, выраженные через числа
молей, молярности или мольные доли
реагирующих веществ в равновесной
системе. Как видно из предыдущего
уравнения, связь между этими константами
равновесия определяется соотношениями:
Kp
= Kn![]() =
Kс
=
Kс![]() =Kх
=Kх![]() , (11.14)
, (11.14)
где – разность между суммарным числом молей продуктов реакции и исходных веществ, т.е. алгебраическая сумма стехиометрических коэффициентов в уравнении химической реакции.
Как видно из уравнения (11.14), в общем случае численные значения констант равновесия Kp,Kn,KсиKхне совпадают и лишь при= 0, т.е. когда реакция протекает без изменения числа молей, константы равновесия имеют одинаковое значение, независимо от способа выражения состава.
Следует также иметь в виду, что величина константы равновесия зависит от способа записи уравнения химической реакции. Например, уравнение реакции синтеза аммиака можно записать в виде
3H2+ N2=2NH3
Тогда константа равновесия этой реакции рассчитывается как
Kp=
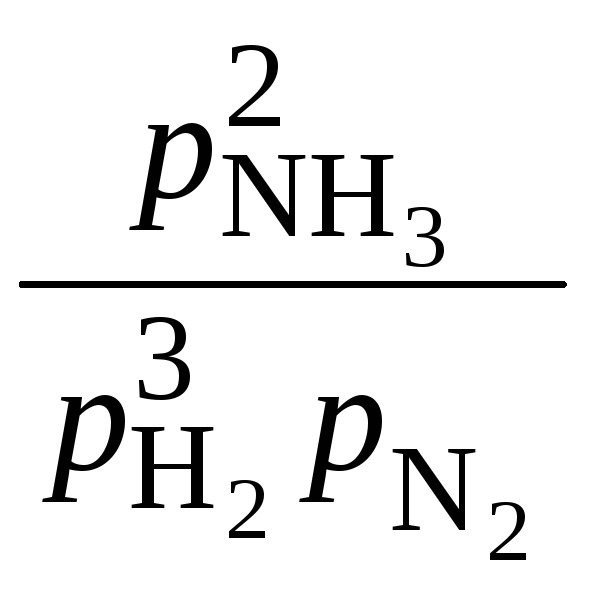 .
.
Уравнение этой же реакции можно представить в форме
3/2 Н2+ 1/2 N2LNH3
Константа равновесия этой реакции при такой записи
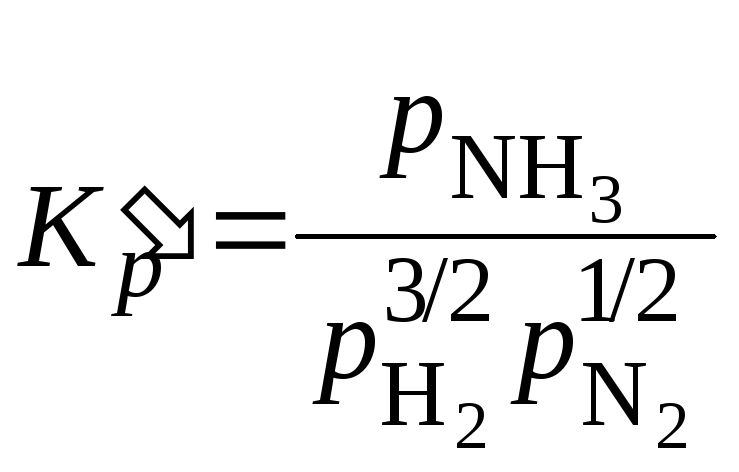 =
=
![]() .
.
Для обратной реакции разложения аммиака
2NH3 3H2+ N2
константа
равновесия
![]() =
1/Kp.
=
1/Kp.
11.3. Уравнение изотермы химической реакции. Химическое сродство
Энергия Гиббса системы, в которой протекает химическая реакция, изменяется ((іі< 0). Обозначим парциальные давления компонентов в неравновесной смеси черезРі. В соответствии с уравнением (11.4)
![]() =іі=і
=іі=і![]() +RTіlnРі. (11.15)
+RTіlnРі. (11.15)
Величина і![]() не зависит от того, в каком состоянии –
равновесном или неравновесном –
находится система, и связана согласно
уравнению (11.10) с константой равновесия:
не зависит от того, в каком состоянии –
равновесном или неравновесном –
находится система, и связана согласно
уравнению (11.10) с константой равновесия:
і![]() = –RTln Kp. (11.16)
= –RTln Kp. (11.16)
Тогда
![]() =
–RT lnKp+RT іlnРі. (11.17)
=
–RT lnKp+RT іlnРі. (11.17)
Если смесь компонентов с парциальными давлениями Ріимеет настолько большую массу, что изменение количества компонентов на величиныіпрактически не изменяет их парциальных давлений, то в уравнении (11.17) можно заменить значение (G/) на конечные изменения (G/). Положив= 1, получим:
Gp,T= –RT lnKp+RT іlnРі. (11.18)
В этом уравнении Gпредставляет собой изменение энергии Гиббса при химической реакции, в которой превращению подверглись стехиометрические количества реагирующих веществ, а само уравнение называетсяуравнением изотермы химической реакции.
По физическому смыслу
величина Gпредставляет собой максимальную полезную
работу реакции (G=![]() ),
поэтому уравнение (11.18) называют ещеуравнением максимальной полезной
работыхимической реакции.
),
поэтому уравнение (11.18) называют ещеуравнением максимальной полезной
работыхимической реакции.
Аналогично можно получить выражение для изменения энергии Гельмгольца (Сі – неравновесные концентрации):
FV.T = – RTlnKc + RTіlnСі, (11.19)
причем Gp,T=FV,T,
так как каждая из этих величин равна![]() .
.
Если парциальные давления всех участников реакции в неравновесной смеси равны единице (Рі= 1), то из уравнения (11.18) следует, что
![]() = –RT lnKp, (11.20)
= –RT lnKp, (11.20)
где
![]() представляет собой изменение стандартной
энергии Гиббса при реакции.
представляет собой изменение стандартной
энергии Гиббса при реакции.
Величины Gp,Tи![]() являются количественной меройхимического
сродства(стандартного химического
сродства) реагирующих веществ, т.е.
способности веществ вступать в химическое
взаимодействие друг с другом. Как видно
из уравнения (11.20), чем более отрицательное
значение приобретает величина
являются количественной меройхимического
сродства(стандартного химического
сродства) реагирующих веществ, т.е.
способности веществ вступать в химическое
взаимодействие друг с другом. Как видно
из уравнения (11.20), чем более отрицательное
значение приобретает величина![]() ,
тем больше становится величинаKp,
т.е. равновесие смещается в сторону
образования продуктов реакции.
,
тем больше становится величинаKp,
т.е. равновесие смещается в сторону
образования продуктов реакции.
