
Zadachi_2
.pdf
3. Наважку 0,5932 г скла розчинили у колбі місткістю 200 мл і довели дистильованою водою до риски. Потім 25 мл цього розчину помістили в іншу колбу місткістю 250 мл і знову довели водою до риски. Цей розчин фотометрували полум'яним фотометром, як і стандартні розчини NaCl. Визначте масову частку (%) Na2O у склі за результатами фотометрування:
|
Стандартні розчини |
Досліджуваний розчин |
||
|
|
|
|
|
І, мкА |
25 |
52 |
73 |
64 |
C(NaCl), мг/л |
15 |
30 |
45 |
? |
4. 10 мл дослiджуваного розчину густиною ρ = 1,034 г/см3 вмiстили у вимiрювальну колбу місткістю 100 см3 i довели дистильованою водою до риски. Цей розчин фотометрували в полум'ї, як і стандартні розчини Na+. Визначте масову частку (%) фосфору в досліджуваному розчині, якщо вiн знаходиться у виглядi Na2HPO4 за результатами фотометрування:
|
|
|
Стандартні розчини |
Досліджуваний розчин |
|
||||
|
|
|
|
|
|
|
|
|
|
|
І, мкА |
|
21 |
|
43 |
|
55 |
37 |
|
|
C(Na+), мг/л |
|
6 |
|
12 |
|
18 |
|
|
5. Під час аналізу |
сталі на |
вміст |
мангану за методом одного еталону |
||||||
мікрофотометром МФ–2 виміряно почорніння ліній гомологічної пари в спектрах еталону і досліджуваного зразка:
|
S(Fe) |
S(Mn) |
C(Mn), % |
|
|
|
|
Еталон |
2,31 |
1,04 |
0,584 |
Зразок |
2,35 |
1,97 |
? |
|
|
|
|
Визначте масову частку (%) мангану в зразку, якщо ΔS = 0 при С(Мn) = 0,012 % 6. При аналізі бронзи на вміст плюмбуму методом одного еталону
мікрофотометром МФ–2 виміряно фотострум від ліній гомологічної пари у
спектрах еталону і досліджуваного зразка: |
|
|
|||
|
|
|
|
|
|
|
|
І (Cu) |
|
І (Pb) |
С(Pb), % |
|
|
|
|
|
|
|
Еталон |
177 |
|
25 |
2,47 |
|
Зразок |
176 |
|
90 |
? |
Визначте масову частку (%) плюмбуму в зразку, якщо ΔS = 0 при С(Рb) = 0,21 %. 7. Під час аналізу глини на вміст кальцію методом трьох еталонів мікрофотометром МФ–2 виміряно почорніння ліній гомологічної пари у
спектрах еталонів і досліджуваного зразка: |
|
|
|||
|
|
|
|
|
|
|
|
|
Еталони |
|
Зразок |
|
|
1 |
2 |
3 |
|
|
|
|
|
|
|
|
S (A1) |
2,07 |
2,04 |
2,06 |
2,05 |
|
S (Ca) |
1,07 |
1,86 |
2,38 |
2,07 |
|
С (Са), % |
9,71 |
1,26 |
0,33 |
? |
|
|
|
|
|
|
11
Визначте масову частку (%) кальцію в зразку.
8. При аналізі каталізатора на вміст купруму методом трьох еталонів мікрофотометром МФ-2 виміряно фотострум від ліній гомологічної пари у спектрах еталонів і досліджуваного зразка:
|
|
Еталони |
|
Зразок |
|
|
|
|
|
|
1 |
2 |
3 |
|
I (Si) |
139 |
137 |
138 |
137 |
I (Cu) |
10 |
62 |
222 |
193 |
C (Cu), % |
4,8 |
2,02 |
0,51 |
? |
|
|
|
|
|
Визначте масову частку (%) купруму в зразку каталізатора.
9. Зробiть обгрунтований вибiр гомологiчної пари лiнiй для кiлькiсного визначення феруму в зразку дюралюмінію, користуючись табличними даними для спектральних лiнiй чистих елементiв:
|
Fe |
|
|
Al |
|
|
|
|
|
|
|
λ, Ǻ |
I |
E, eВ |
λ, Ǻ |
I |
E, eВ |
|
|
|
|
|
|
2450,59 |
10 |
6,31 |
2469,32 |
1 |
7,30 |
|
|
|
|
|
|
2502,50 |
10 |
6,15 |
2454,61 |
1000 |
7,29 |
|
|
|
|
|
|
2756,96 |
20 |
5,55 |
2891,98 |
20 |
4,44 |
|
|
|
|
|
|
3270,25 |
20 |
4,76 |
3427,39 |
1 |
5,71 |
|
|
|
|
|
|
3542,15 |
16 |
5,28 |
3637,84 |
2 |
5,75 |
|
|
|
|
|
|
3770,25 |
20 |
5,00 |
3746,21 |
2 |
3,20 |
|
|
|
|
|
|
4152,49 |
320 |
4,35 |
4232,62 |
2 |
2,39 |
|
|
|
|
|
|
4127,61 |
128 |
4,05 |
4220,56 |
2 |
4,09 |
|
|
|
|
|
|
Орієнтовний вміст феруму в зразку 1%–1,5 %. Вважайте, що iнтенсивнiсть лiнiй прямо пропорційна концентрацiї (коефiцiєнт самопоглинання b=1).
МОЛЕКУЛЯРНО-АБСОРБЦІЙНИЙ АНАЛІЗ
Питання для самостійної підготовки
1.Загальна характеристика фотометричних (абсорбційних) методів аналізу.
2.Основні переваги фотометричних методів аналізу.
3.Вимоги до реакцій, які використовуються в фотометричному аналізі для утворення забарвлених розчинів.
4.Основний закон світлопоглинання (закон Бугера-Ламберта-Бера).
5.Спектр поглинання і причина його утворення.
6.Визначення понять: а)коефіцієнт пропускання Т; б)поглинання (оптична густина) А; в)молярний коефіцієнт поглинання. Зв'язок між ними.
12

7. Умови застосування закону Бугера-Ламберта-Бера. Причини відхилення від нього.
8.Фактори, від яких залежить оптична густина, молярний коефіцієнт поглинання?
9.Оптимальний діапазон вимірюваних оптичних густин. Як збільшують (зменшують) оптичну густину та вибирають розмір (товщину) кювети?
10.Правило вибору довжини хвилі λ для фотометричних вимірювань.
11.Основні методи фотометричних вимірювань: а) порівняння (одного стандарту); б) калібрувального графіку; в) молярного коефіцієнту поглинання; г) добавок; д) диференційна фотометрія; е) фотометричне титрування.
12.Основні вузли і принципи роботи фотоелектроколориметрів.
13.Світлофільтри, їх призначення і вибір.
14.Суть нефелометричного і турбідиметричного методів аналізу.
15.Суть кінетичних методів аналізу.
Приклади розв’язування типових задач
Задача 1. Визначте молярний коефіцієнт поглинання забарвленого розчину солі кобальту, якщо оптична густина цього розчину при максимальному поглинанні монохроматичного випромінювання в кюветі товщиною 2 см дорівнює 0,42. Концентрація кобальту в розчині – 1,475 мг в 50 мл.
Розв’язок. Обчислюємо молярну концентрацію розчину кобальту, а потім за законом Бугера-Ламберта-Бера значення молярного коефіцієнту поглинання:
C |
|
m 1000 |
|
1,475 10 3 г 1000 |
0,0005 |
моль / л , |
|||||||
V M (Co) |
50 мл 58,9 г/моль |
||||||||||||
|
|
|
|
|
|
||||||||
|
|
A |
|
|
|
0,42 |
|
420 |
л |
|
. |
||
l C |
2 см 0,0005 |
|
моль |
|
|||||||||
|
|
моль/л |
|
см |
|||||||||
Задача 2. Молярний коефіцієнт поглинання забарвленого комплексу ніколу з α-бензоїлоксимом при λ=406 нм має значення ε=12000. Обчислити мінімальну концентрацію ніколу (мг/мл), яку можна визначити фотометрично у кюветі завтовшки 5 см, якщо мінімальне значення оптичної густини, при якому зберігається закон Бугера-Ламберта-Бера, – 0,020.
Розв’язок. Мінімальну молярну концентрацію ніколу визначають, виходячи із закону Бугера-Ламберта-Бера:
C |
|
|
Amin |
|
0,020 |
|
3,310 7 M . |
|
min |
l |
12000 |
5 |
|||||
|
|
|
|
|||||
|
|
|
|
|
Концентрація в мг/мл зв’язана з молярною співвідношенням:
Cмг / мл Смоль/л М(Ni)г / моль 3,310-7 58,7 2 10 5 г/л 2 10-5 мг/мл.
13
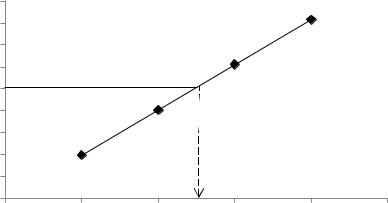
Задача 3. Яка товщина шару забарвленого розчину необхідна для послаблення світлового потоку у 10 разів? Коефіцієнт поглинання розчину дорівнює 0,333.
Розв’язок. Згідно закону Бугера-Ламберта інтенсивність світлового потоку послаблюється за залежністю:
I IO10 k l ,
де Іо- початкова інтенсивність потоку світла; І- інтенсивність світла, що пройшло через розчин; k – коефіцієнт світлопоглинання,
l – товщина поглинаючого шару, см.
Якщо обидві частини цього виразу поділити на Іо, прологарифмувати і
змінити знак на протилежний, то отримаємо: |
lg |
Io |
k l , |
||||||
|
|||||||||
|
|
|
|
|
|
|
|
I |
|
звідки |
l |
lg( Io / I ) |
|
lg10 |
|
3 cм. |
|
|
|
k |
0,333 |
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Задача 4. Для визначення ніколу в монетному сплаві наважку останнього 6,2501 г розчинили і після відповідної обробки довели об'єм розчину до 100,0 мл. При фотометруванні одержаного розчину значення оптичної густини становило 0,509. Стандартні розчини солі ніколу дали такі результати:
С (Ni), г/см3 |
0,01 |
0,02 |
0,03 |
0,04 |
|
|
|
|
|
А |
0,198 |
0,403 |
0,612 |
0,815 |
|
|
|
|
|
Визначте % вміст ніколу в зразку сплаву. |
|
|
|
||||||
Розв’язок. |
Будуємо |
калібрувальний |
графік |
в |
координатах |
А-С:: |
|||
A 0,9 |
|
|
|
|
|
|
|
|
|
0,8 |
|
|
|
|
|
|
|
|
|
0,7 |
|
|
|
|
|
|
|
|
|
0,6 |
Ax = 0,509 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
0,5 |
|
|
|
|
|
|
|
|
|
0,4 |
|
|
|
|
|
|
|
|
|
0,3 |
|
|
|
|
|
|
|
|
|
0,2 |
|
|
|
|
|
|
|
|
|
0,1 |
|
|
|
|
С (Ni)x = 0,025 г/см3 |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
0 |
0,01 |
0,02 |
0,03 |
0,04 |
0,05 |
|
|
|
|
|
|
|
|
|
С (Ni), г/см3 |
|
|
|
Концентрація ніколу в досліджуваному розчині Сх(Ni)=0,025 г/см3, а його маса : m(Ni)=Сх(Ni)·Vколби=0,025·100=2,5 г.
Масова частка (%) ніколу в сплаві становить: Ni |
2,5 |
|
100% 40,0 % . |
|
|
|
|||
6,2501 |
||||
|
|
|||
14

Задача 5. Визначте масову частку (%) вольфраму в дроті, якщо після розчинення його наважки 3,0789 г в колбі об’ємом 250 мл значення оптичної густини одержаного розчину становило 0,384. При фотометруванні розчину з вмістом вольфраму 3,50 мг/л значення оптичної густини дорівнювало 0,545.
Розв’язок. Згідно методу стандартів: Cx (W ) |
Ax |
Cст |
|
0,384 |
3,5 2,47мг / л. |
||||||
Aст |
0,545 |
||||||||||
|
|
|
|
|
|
|
|
|
|||
Тоді |
m(W ) |
Cx (W ) V (колби) |
|
2,47 250 |
0,6175 г. |
|
|
|
|
||
1000 |
1000 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||
Масова частка (%) вольфраму в дроті становить: W 0,61753,0789 100% 20,06 %. Задача 6. Розрахуйте масу феруму в 250 мл водопровідної води за результатами фотометрування методом добавок. Оптична густина 50 мл досліджуваної води становить 0,35. Величина оптичної густини такого ж досліджуваного розчину з додаванням стандартного розчину з вмістом феруму 0,010 моль/л , виміряна в тих самих умовах, складає 0,63. Вважати, що об'єм
розчину після добавки феруму не змінюється.
Розв’язок. За формулою методу добавок розраховуємо концентрацію феруму в досліджуваному розчині води :
Cx Cст |
Ax |
0,010 |
0,35 |
0,0125 моль/л. |
|
A |
А |
0,63 0,35 |
|||
|
x доб |
х |
|
|
|
Масу феруму у водопровідній воді встановлюємо із співвідношення:
m(Fe 2 ) |
C |
x |
V |
колби |
М (Fe 2 ) |
|
0,0125 250 55,85 |
0,1745 г. |
|
|
|
1000 |
1000 |
||||
|
|
|
|
|
|
|||
Задача 7. Розрахуйте вміст меркурію (мг/л) в 10 мл аналізованого розчину за результатами фотометрування методом добавок. Оптична густина досліджуваного забарвленого розчину, приготованого з 2 мл аналізованого розчину, дорівнює 0,22. Величина оптичної густини такого ж досліджуваного розчину з додаванням 10 мкг меркурію, виміряна в тих самих умовах, складає 0,64. Вважайте, що об'єм розчину після добавки меркурію не змінюється.
Розв’язок. Оскільки об’єм розчину після додавання добавки не змінюється, то можна використати спрощений варіант формули методу добавок:
mx mст |
Ах |
10 |
0,22 |
5,24 мкг . |
Ах доб Ах |
0,64 0,22 |
Ця маса меркурію міститься в 2 мл розчину, а у 10 мл: m=mx∙(Vк /Vп)=5,24·(10/2)=26,2 мкг.
Вміст меркурію в розчині рахуємо як:
C |
mx |
|
26,2 мкг |
2,62 |
мкг/мл 2,62 мг/л. |
|
V |
10 мл |
|||||
|
|
|
|
15

Задача 8. Наважку 5,4567 г солі Мора Fe(NH4)2(SO4)2∙6Н2О розчинили в колбі об’ємом 250 мл. Методом фотоколориметричного титрування було встановлено, що на взаємодію з 25 мл цього розчину витрачається 2,45 мл стандартного розчину калій дихромату з концентрацією C(1/6 K2Cr2O7) 0,45 моль/л. Визначте вміст Fe2+ в аналізованій пробі солі Мора.
Розв’язок. В основі визначення лежить реакція:
6 Fe2+ + Cr2O72- + 14 H+ = 6 Fe3+ + 2 Cr3+ + 7 H2O.
Масу Fe2+ в розчині встановлюємо із співвідношення:
|
C(1/6 K |
Cr O ) V |
т.е. |
M(Fe2 ) |
|
V (колби) |
0,45 2,45 55,85 |
|
250 |
|
||
m(Fe) |
|
2 2 7 |
|
|
|
|
|
|
|
|
0,6157 г. |
|
|
1000 |
|
|
|
V (піпетки) |
1000 |
25 |
|||||
Масова частка феруму у солі Мора: |
|
|
|
0,6157 |
100% 11,28 % . |
Fe |
|
||||
|
|
5,4567 |
|
||
|
|
|
|
||
Задача 9. Для визначення феруму |
в розчині його пробу об’ємом 20 мл |
||||
фотометрично відтитрували при довжині хвилі λ=540 нм розчином КMnO4 з титром за ферумом 0,04537 г/мл, одержавши при цьому такі результати:
V(КMnO4), мл |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
7,0 |
|
|
|
|
|
|
|
|
А |
0,00 |
0,00 |
0,055 |
0,174 |
0,281 |
0,392 |
0,497 |
|
|
|
|
|
|
|
|
Обчисліть вміст феруму у досліджуваному розчині (г/мл). |
|||||
Розв’язок. |
|
|
|
|
|
Будуємо криву фотометричного титрування в координатах А - VКMnO4: |
|||||
A 0,6 |
|
|
|
|
|
0,5 |
|
|
|
|
|
0,4 |
|
|
|
|
|
0,3 |
|
|
|
|
|
0,2 |
|
|
|
|
|
0,1 |
|
|
|
|
|
0 |
|
|
|
|
|
-0,1 |
0 |
2 |
4 |
6 |
8 |
|
|
|
V т.е. = 2,5 мл |
V(КMnO4), мл |
|
З кривої титрування за точкою перегину визначаємо об’єм титранту в точці еквівалентності: V(КMnO4) т.е.= 2,5 мл.
Маса феруму визначається за формулою:
m(Fe) TKMnO4 / Fe V (KMnO4 )т.е. 0,04537 2,5 0,1134 г ,
а його концентрація в розчині: |
С |
m(Fe) |
|
0,1134 |
0,00567 г /мл. |
|
|
||||
|
|
Vр-ну |
20 |
|
|
16
Задачі для самостійного розв’язування
1. Визначте молярний коефіцієнт поглинання забарвленого розчину солі купруму, якщо відомо, що оптична густина забарвленого розчину при максимальному поглинанні монохроматичного випромінювання в кюветі з товщиною шару 1 см становить 0,27. Концентрація купруму в розчині становить 0,12 мг в 100 мл розчину.
2. Знайдіть товщину поглинаючого шару для фотометрування забарвленого розчину феруму заліза з молярним коефіцієнтом світлопоглинання 4 103 л/(моль см) при концентрації феруму 2 мг в 50 мл розчину. Оптимальне значення оптичної густини 0,43.
3.Іон двовалентного феруму утворює з фенантроліном комплекс червоного кольору з молярним коефіцієнтом поглинання 1 104 л/(моль см). Розрахуйте значення оптичної густини розчину з концентрацією Fe2+ 1,87 10-5 моль/л, якщо товщина кювети 5 см.
4.Молярний коефіцієнт поглинання забарвленої сполуки феруму
становить 8350 л/(моль см). Визначте концентрацію заліза (г/л) в досліджуваному розчині, якщо оптична густина забарвленого розчину, приготованого з 10 мл досліджуваного розчину в мірній колбі об'ємом 100 мл і виміряна в кюветі з товщиною шару 1 см, мала значення 0,755.
5. Яка товщина шару забарвленого розчину необхідна для послаблення падаючого світлового потоку у 8 разів? Коефіцієнт поглинання розчину дорівнює 0,845.
6. Визначте коефіцієнт поглинання забарвленого розчину, якщо відомо, що при проходженні через шар цього розчину товщиною 5 см, початкова інтенсивність світлового потоку зменшилась в 5 разів.
7. Визначте масову частку (%) феруму в солі Мора, якщо її наважку 1,4503 г розчинили, додали необхідні реактиви і довели об’єм розчину до 250 мл. При фотометруванні цього розчину значення оптичної густини становило 0,567. При фотометруванні еталонних розчинів солі феруму були одержані дані:
С, мг/л |
2 |
4 |
6 |
8 |
10 |
12 |
|
|
|
|
|
|
|
А |
0,162 |
0,333 |
0,502 |
0,666 |
0,842 |
0,985 |
|
|
|
|
|
|
|
8. Визначте вміст вольфраму в розчині (г/л), якщо значення його оптичної густини становило 0,538. Для розчину з вмістом вольфраму 2,45 мг/л значення оптичної густини дорівнювало 0,345.
9. Визначте масу купруму в 500 мл досліджуваного розчину в г, якщо при його фотометруванні значення оптичної густини становило 0,462. Оптична
17
густина стандартного розчину з вмістом купруму 4 10-3 моль/л мала значення
0,596.
10.Кювета об'ємом 10 мл заповнена розчином визначуваної речовини, значення оптичної густини для якої 0,65. При додаванні в розчин 1,0 мл стандартного розчину з концентрацією 5 мкг/л значення оптичної густини збільшилось до 0,80. Розрахуйте концентрацію речовини в досліджуваному розчині.
11.Розрахуйте вміст фенолу в 50 мл аналізованого розчину за результатами фотометрування методом добавок. Оптична густина досліджуваного забарвленого розчину, приготованого з 5 мл аналізованого розчину, дорівнює 0,45. Величина оптичної густини такого ж досліджуваного розчину з додаванням 100 мкг фенолу, виміряна в тих самих умовах, складає 0,85. Вважати, що об'єм розчину після добавки фенолу не змінюється.
12.Методом фотоколориметричного титрування було встановлено, що на
10 мл розчину солі Мора витрачається 1,50 мл робочого розчину з концентрацією C(1/5 КMnO4) 0,05 моль/л. Визначте вміст (г/л) Fe2+ в аналізованому розчині солі Мора.
ЕЛЕКТРОХІМІЧНІ МЕТОДИ АНАЛІЗУ
ПОТЕНЦІОМЕТРІЯ, КУЛОНОМЕТРІЯ, КОНДУКТОМЕТРІЯ
Питання для самостійної підготовки
1.Суть потенціометричних методів аналізу. Відмінність між стандартними і реальними окисно-відновними потенціалами.
2.Рівняння Нернста. Зміст величин, які в нього входять. Принципова схема установки для вимірювання потенціалу.
3.Які електроди називають: а) електродами І, ІІ і ІІІ роду; б) індикаторними електродами; в) електродами порівняння. Вимоги до них. Наведіть приклади.
4.Характеристика водневого, скляного, хлоридно-срібного і каломельного електродів.
5.Характеристика електронообмінних та іонообмінних електродів.
6.Суть методу прямої потенціометрії. Схема установки, основні індикаторні електроди. Визначення рН розчину в потенціометрії.
18
7.Принцип роботи нормального елемента Вестона та його застосування потенціометрії.
8.Опишіть методи потенціометричного титрування, основані на реакціях нейтралізації, окиснення-відновлення, осадження, комплексоутворення. Наведіть приклади (реакції, електроди, криві титрування, розрахунки).
9.Вимоги до реакцій що використовуються в потенціометричному титруванні.
10.Суть кондуктометричних методів аналізу. Дайте визначення понять: електрична провідність, питома електрична провідність, еквівалентна електрична провідність, гранична електрична провідність, закон Кольрауша.
11.Схема установки для вимірювання електричної провідності.
12.Суть методу прямої кондуктометрії. Особливості, переваги та недоліки методу.
13.Вплив на електричну провідність: а) природи електроліту і розчинника; б) концентрації електроліту; в) температури.
14.Суть методу кондуктометричного титрування? Вкажіть особливості, переваги та недоліки методу.
15.Вигляд кривих кондуктометричного титрування для реакцій: а) кислотноосновної взаємодії; б) осадження; в) комплексоутворення. Від чого він залежить?
16.Методи кондуктометричного титрування, основані на реакціях: нейтралізації, окиснення-відновлення, осадження, комплексоутворення. Наведіть приклади.
17.Основні закони кулонометричних методів аналізу.
18.Принципова схему кулонометричної установки.
19.Умови використання електрохімічних реакцій в кулонометричному аналізі.
20.Суть методу кулонометрії при постійній силі струму.
21.Приклади кулонометричного титрування: а) електроґенерованими окисниками або відновниками; б) з використанням реакцій осадження,
комплексоутворення та нейтралізації.
22. Опишіть, у чому суть прямої кулонометрії, її переваги та недоліки.
23.Фіксування точки еквівалентності в кулонометричному аналізі. Наведіть приклади.
24.Вимоги ставляться до реакцій, що використовуються в кулонометрії. Вихід за струмом.
25.Процедура кулонометричного визначення натрій тіосульфату електроґене-
рованим йодом.
28. Кулонометрія при контрольованому потенціалі.
19

Приклади розв’язування типових задач
Задача 1. Обчисліть масову частку (%) нітратів у зразку, якщо його наважку 24,4911 г розчинили у воді, об’єм довели до 100,0 мл і в одержаному розчині виміряли потенціал нітрат-селективного електроду Ех = 1,14 мВ. У стандартних розчинах з концентрацією С(NO3-) електродні потенціали нітратселективного електроду, виміряні відносно хлоридно-срібного електроду, мали значення:
|
С(NO3-), моль/л |
1 |
0,1 |
0,01 |
0,001 |
|
|
Е, мВ |
3,10 |
2,24 |
1,23 |
0,32 |
|
|
|
|
|
|
|
|
Розв’язок. За даними калібрування необхідно |
побудувати графік у |
|||||
координатах Е рС(NO3-) (pC=-lgC), з якого можна визначити вміст нітратйонів в досліджуваному розчині:
3,5 |
|
|
|
|
|
|
|
Е, мВ 3 |
|
|
|
|
|
|
|
2,5 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
1,5 |
Ex = 1,14 мВ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
0,5 |
|
pCx (NO |
-) = 2,1 |
|
|
|
|
|
|
|
|
|
|||
0 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
0 |
0,5 |
1 |
1,5 |
2 |
2,5 |
3 |
3,5 |
|
|
|
|
|
|
pC (NO3-) |
|
рСх(NO3-) = 2,10, а Сх(NO3-) = 10-2,1= 0,0079 М. Маса нітратів обчислюється за формулою :
m(NO ) |
C(NO ) V (колби) M (NO ) |
|
|
0,0079 100 62 |
0,04898 г , |
||||
3 |
3 |
= |
|
|
|
||||
|
|
|
|
|
|||||
3 |
1000 |
|
|
|
1000 |
|
|||
|
|
|
|
|
|||||
а масова частка нітратів у зразку |
|
0,04898 |
|
100% 0,20 % . |
|||||
24,4911 |
|||||||||
|
|
|
|
|
|
||||
Задача 2. Побудуйте криву потенціометричного титрування в координатах pH-V та визначте концентрацію метиламіну СН3NH3OH в моль/л та г/мл, якщо при титруванні 20,0 мл досліджуваного розчину цієї основи 0,2233 М розчином хлоридної кислоти одержали такі результати :
V(HCl), мл |
10,0 |
12,0 |
14,0 |
14,5 |
14,9 |
15,0 |
15,1 |
15,5 |
16,0 |
|
|
|
|
|
|
|
|
|
|
рН |
10,42 |
10,12 |
9,56 |
9,28 |
8,42 |
5,90 |
3,24 |
2,38 |
2,10 |
|
|
|
|
|
|
|
|
|
|
Розв’язок. Вказаний процес титрування відбувається за реакцією:
СН3NH3OH + HCl ↔ СН3NH3Cl + H2O.
20
