
- •Лекція №1. Предмет і завдання біохімії
- •Загальні уявлення про обмін речовин
- •Хімічний склад живого організму
- •Клітина – основа структури живих систем
- •Історія розвитку біохімії
- •Лекція № 2 Білкові речовини
- •Функції білків
- •Класифікація амінокислот
- •Властивості амінокислот
- •Кольорові реакції на амінокислоти
- •Методи визначення амінокислот
- •Будова білків
- •Фізико-хімічні властивості білків
- •Шляхи виділення та розділення білків
- •Методи визначення білка
- •Класифікація білків
- •Природні пептиди
- •Лекція № 3 Нуклеїнові кислоти
- •Властивості і будова днк
- •Будова і функції рнк
- •Нуклеозиди і нуклеотиди
- •Назви нуклеозидів та нуклеотидів
- •Лекція № 4 Вітаміни
- •Жиророзчинні вітаміни
- •1(138), 10(245) Вітаміни групи а (антиксерофтальмічний фактор).
- •Водорозчинні вітаміни
- •1(162), 10(277) Вітамін с (аскорбінова кислота)
- •Вітаміноподібні речовини
- •Антивітаміни, антиметаболіти, антибіотики
- •Лекція № 5 Вуглеводи
- •Моносахариди
- •10(216), 11Окремі представники моносахаридів
- •Дубильні речовини
- •Полісахариди
- •Лекція № 6 Ліпіди
- •Характеристика промислових жирів
- •Лекція № 7. Ферменти
- •Будова ферментів
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Класифікація і номенклатура ферментів
- •Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання Оксидоредуктази
- •Трасферази
- •Гідролази
- •Ізомерази
- •Локалізація ферментів у клітині
- •Лекція № 8 Обмін речовин
- •Способи живлення організмів
- •Теорія біологічного окислення
- •Анаеробний розклад вуглеводів
- •Гліколіз
- •Види бродіння
- •2.Пропіоновокисле бродіння.
- •3.Маслянокисле бродіння
- •4.Ацетонобутилове бродіння.
- •5.Метановебродіння.
- •7.Спиртове бродіння.
- •Аеробний розклад вуглеводів
- •Енергетичний ефект повного розщеплення глюкози
- •Пентозний цикл (пентозофосфатний або гексозомонофосфатний шлях)
- •Гліоксилатний цикл
- •Фотосинтез
- •Біосинтез вуглеводів
- •Обмін ліпідів Розпад ліпідів
- •Окислення гліцерину
- •Окислення насичених жк
- •Енергетика -окислення жк
- •Α-окислення жк
- •Біосинтез ліпідів Біосинтез гліцерину
- •Біосинтез жк
- •Біосинтез тригліцеридів
- •Зміна жирів при зберіганні
- •Основні перетворення ліпідів
- •Обмін нуклеїнових кислот Розпад нк
- •Синтез нк
- •Обмін білків Розпад білків
- •Перетворення амінокислот
- •Нейтралізація і виведення аміаку з організму
- •Орнітиновий цикл
- •Біосинтез амінокислот
- •Біосинтез білків
- •Взаємозв’язок процесів обміну речовин у живому організмі
- •Література
Властивості амінокислот
10(51) 1. Виділені з білків амінокислоти – це безбарвні, кристалічні речовини, переважна більшість яких добре розчинна у воді і погано розчинна в органічних розчинниках.
5(30), 10(51), 1(33) 2. Наявність аміногрупи в -положенні надає другому атому вуглецю асиметричність, внаслідок чого амінокислоти мають оптичні ізомери, тобто є оптично активними сполуками. Це означає, що амінокислоти здатні обертати площину поляризованого променю світла. Якщо амінокислота обертає промінь праворуч, вона є правообертаючою і позначається знаком плюс (+), а якщо – ліворуч, то лівообертаючою і позначається знаком мінус (-).
Конфігурацію амінокислот визначають у порівнянні з гліцериновим альдегідом. Відомо 2 його форми: D та L. Якщо розташування атома водню біля вуглецю в α-положенні амінокислоти подібне до розташування водню в тому самому положенні D-гліцеринового альдегіду, то амінокислота належить до D- ряду. Якщо розташування атома водню амінокислоти відповідає L-формі ГА, то і амінокислота належить до L - ряду.

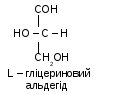
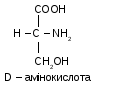
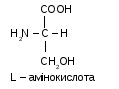
Для кожної амінокислоти існує два стереоізомери. Деякі амінокислоти мають два центри асиметрії, тому утворюють чотири стереоізомери (треонін, цистин, ізолейцин).
Амінокислоти, що входять до складу білка належать лише до L- ряду. Амінокислоти D ряду в природі зустрічаються рідко і виявлені лише у деяких м/о. Амінокислоти L та D-ряду відрізняються також і за смаком: перші – гіркі, другі – солодкі.
6(3) Оптично неактивний лише гліцин, оскільки не має асиметричного атома С.
Суміш речовин L та D-ряду називаються рацемічними, така суміш не є оптично активною.
3. Дисоціація. 10(53) Всі амінокислоти у водних розчинах дисоціюють та існують у вигляді біполярних іонів:
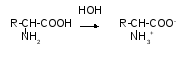
Такий іон має два протилежні заряди – негативний, утворений внаслідок відщеплення позитивно зарядженого протона від карбоксильної групи, і позитивний, утворений внаслідок приєднання протона до аміногрупи.
5(30) Молекули таких амінокислот в цілому електронейтральні. Лише молекули амінокислот, що мають дві аміногрупи та дві карбоксильні групи, в розчині заряджені позитивно або негативно, в залежності від того який заряд переважає.
3(20) В зв’язку з амфотерним характером амінокислот, в залежності від рН середовища, вони проявляють кислотні або лужні властивості. В кислому середовищі (при наявності надлишку Н+) дисоціація карбоксильної групи пригнічується і молекула амінокислоти стає заряджена позитивно.
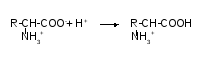
У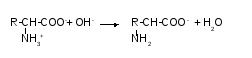 лужному середовищі під дією ОН-
іонів дисоціація амінних груп пригнічується
і молекула амінокислотами стає заряджена
негативно.
лужному середовищі під дією ОН-
іонів дисоціація амінних груп пригнічується
і молекула амінокислотами стає заряджена
негативно.
4. 3(20) Солеутворення амінокислот. Внаслідок своєї амфотерності амінокислоти можуть утворювати солі як з кислотами, так і з лугами. Крім того, амінокислоти з катіонами важких металів можуть утворювати внутрішньо комплексні солі з різною розчинністю у воді.
5. Реакція зі спиртами (етерифікації):
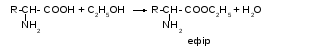
3(20), 5(32) 6. Декарбоксилування:

7. Реакція з азотистою кислотою (Ван-Слайка)
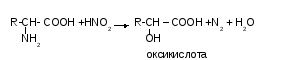
5(32), 12(26) Реакція з азотистою кислотою супроводжується виділення азоту, за кількістю якого можна судити про кількість амінокислоти.
8. Реакція з формальдегідом (формольне титрування) - формальдегід зв’язує аміногрупу, утворюючи метиленову похідну амінокислоти, яку відтитровують лугом. Це реакція Сьоренсена, яка застосовується для кількісного визначення амінокислот.
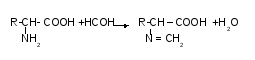
9. 12(26), 11 Взаємодія з вуглеводами. Амінокислоти вступають у реакцію з відновлюючими цукрами (містять групу =С=О). При цьому із амінокислоти утворюється відповідний альдегід, який має певний запах, що зумовлює аромат багатьох харчових продуктів. Із цукру утворюється фурфурол або оксіметилфурфурол. Останні знову можуть вступати у реакцію з амінокислотами, даючи темнозабарвлені продукти, що називаються меланоїдинами. Їх утворення пояснює потемніння багатьох харчових продуктів від час виготовлення, сушки та зберігання.
Особливо інтенсивно такі реакції відбуваються при підвищеній температурі, яка має місце при висушуванні продуктів: овочів, фруктів, солоду, при випіканні хліба, упарюванні цукрових розчинів, пряженні молока, ферментації тютюну тощо.
10. Утворення полімерів. Амінокислоти вступають у реакцію одна з одною утворюючи полімерні сполуку. Утворений зв’язок називається пептидним.
