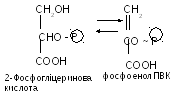- •Лекція №1. Предмет і завдання біохімії
- •Загальні уявлення про обмін речовин
- •Хімічний склад живого організму
- •Клітина – основа структури живих систем
- •Історія розвитку біохімії
- •Лекція № 2 Білкові речовини
- •Функції білків
- •Класифікація амінокислот
- •Властивості амінокислот
- •Кольорові реакції на амінокислоти
- •Методи визначення амінокислот
- •Будова білків
- •Фізико-хімічні властивості білків
- •Шляхи виділення та розділення білків
- •Методи визначення білка
- •Класифікація білків
- •Природні пептиди
- •Лекція № 3 Нуклеїнові кислоти
- •Властивості і будова днк
- •Будова і функції рнк
- •Нуклеозиди і нуклеотиди
- •Назви нуклеозидів та нуклеотидів
- •Лекція № 4 Вітаміни
- •Жиророзчинні вітаміни
- •1(138), 10(245) Вітаміни групи а (антиксерофтальмічний фактор).
- •Водорозчинні вітаміни
- •1(162), 10(277) Вітамін с (аскорбінова кислота)
- •Вітаміноподібні речовини
- •Антивітаміни, антиметаболіти, антибіотики
- •Лекція № 5 Вуглеводи
- •Моносахариди
- •10(216), 11Окремі представники моносахаридів
- •Дубильні речовини
- •Полісахариди
- •Лекція № 6 Ліпіди
- •Характеристика промислових жирів
- •Лекція № 7. Ферменти
- •Будова ферментів
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Класифікація і номенклатура ферментів
- •Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання Оксидоредуктази
- •Трасферази
- •Гідролази
- •Ізомерази
- •Локалізація ферментів у клітині
- •Лекція № 8 Обмін речовин
- •Способи живлення організмів
- •Теорія біологічного окислення
- •Анаеробний розклад вуглеводів
- •Гліколіз
- •Види бродіння
- •2.Пропіоновокисле бродіння.
- •3.Маслянокисле бродіння
- •4.Ацетонобутилове бродіння.
- •5.Метановебродіння.
- •7.Спиртове бродіння.
- •Аеробний розклад вуглеводів
- •Енергетичний ефект повного розщеплення глюкози
- •Пентозний цикл (пентозофосфатний або гексозомонофосфатний шлях)
- •Гліоксилатний цикл
- •Фотосинтез
- •Біосинтез вуглеводів
- •Обмін ліпідів Розпад ліпідів
- •Окислення гліцерину
- •Окислення насичених жк
- •Енергетика -окислення жк
- •Α-окислення жк
- •Біосинтез ліпідів Біосинтез гліцерину
- •Біосинтез жк
- •Біосинтез тригліцеридів
- •Зміна жирів при зберіганні
- •Основні перетворення ліпідів
- •Обмін нуклеїнових кислот Розпад нк
- •Синтез нк
- •Обмін білків Розпад білків
- •Перетворення амінокислот
- •Нейтралізація і виведення аміаку з організму
- •Орнітиновий цикл
- •Біосинтез амінокислот
- •Біосинтез білків
- •Взаємозв’язок процесів обміну речовин у живому організмі
- •Література
Трасферази
5(61) Найважливішими представниками цього класу є:
1. Фосфортрансферази (кінази) здійснюють перенесення фосфатного залишку від АТФ на різні речовини і, навпаки, від фосфорильованої речовини на АДФ з утворенням АТФ. Ці процеси мають велике значення в енергетичному обміні. Фосфорилювання глюкози за рахунок АТФ є першим і обов’язковим етапом всіх процесів перетворення цього вуглеводу.
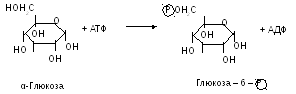
10(207) Стрептокіназу та урокіназу застосовують для розсмоктування тромбів.
2. 10(196), 12(135) Глікозилтрансферази каталізують перенесення залишків вуглеводів.
До цього підкласу належать ферменти фосфорилази, які каталізують перетворення крохмалю чи глікогену у глюкозо-1-фосфат за участі фосфорної кислоти, тобто перенесення глюкозильного залишку на фосфорну кислоту. В результаті відбувається взаємоперетворення вуглеводів. Такий процес розкладу поліцукридів називається фосфоролізом. Він аналогічний гідролізу, але роль води виконує фосфорна кислота. На відміну від гідролаз фосфорилази здійснюють і зворотний процес - синтез складних вуглеводів, переносячи залишки моноцукрів від їх фосфорних ефірів на вуглеводи.
3. Ацилтрансферази беруть участь в перенесенні залишків органічних кислот, головним чином залишку оцтової кислоти - ацетилу (СН3СО-). Цей процес є важливим етапом аеробного окислення вуглеводів, а також окислення та синтезу жирних кислот. Небілкова частина ацилтрасфераз називається коферментом ацилювання (КоА), складається із похідного АДФ, залишку пантотенової кислоти та тіоетаноламіну. Активна частина коферменту - сульфгідрильна група тіоетаноламіну - SH, тому кофермент ацилювання позначають також символом SН - КоА. Кислотні залишки приєднуються до сульфгідрильної групи завдяки макроергічному зв’язку, наприклад: СН3СО S-КоА (ацетил - КоА) 1(161).

4. 12(134) Метилтрансферази – каталізують перенесення метальних груп. Це має велике значення в процесі синтезу холіну, що є складовою частиною лецитинів. Холін регулює жировий обмін у тваринному організмі.
5. 12(132) Амінотрасферзи – каталізують реакції пере амінування (перенесення аміногрупи з амінокислоти на кетокислоту). Амінотрансферази містять як кофермент вітамін В6.
Гідролази
5(62), 12(137), 1(127) Найбільше значення мають естерази, глікозидази, пептидгідролази, амідази:
1. Естерази здійснюють гідроліз та синтез складних ефірів.
R -CO-O-R1
+ HOH RCOOH + R1OH
-CO-O-R1
+ HOH RCOOH + R1OH
R – залишок кислоти, R1 – залишок спирту.
Найбільш важливими є:
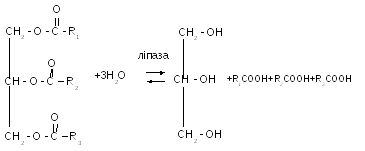
12(138) - ліпаза каталізує гідроліз та синтез жирів. Ліпази діють на складно ефірний зв’язок між гліцерином та ВЖК. В організмі тварин найактивніша ліпаза міститься у соці підшлункової залози та у печінці. У рослинах буває в розчинному та нерозчинному вигляді. Нерозчинна ліпаза міститься у насінні рицину, оптимум її дії відповідає рН 3,6. Ліпаза інших олійних культур, злакових, мікроорганізмів належить до розчинних, оптимум її дії відповідає рН 8. При підвищеній вологості , температурі ліпаза швидко розщепляє гліцериди, що веде до прогіркання продуктів.
R1, R2, R3 – радикали ВЖК.
12(139) - пектаза (пектинестераза) каталізує гідроліз пектинових речовин. Пек таза розщепляє складно ефірний зв’язок з утворенням вільної полігалактуронової кислоти та метилового спирту.
12(140) - фосфатази – гідролізують складні ефіри фосфорної килоти.
Г люкозо-1-Р
Глюкоза + Н3РО4
люкозо-1-Р
Глюкоза + Н3РО4
2. Глікозидази (карбогідрази) розщеплюють глікозидні зв’язки, здійснюючи гідроліз вуглеводів та інших глюкозидів.
R -O-R1
+ HOH ROH + R1OH
-O-R1
+ HOH ROH + R1OH
R – залишок вуглеводу, R1 – залишок вуглеводу або речовини не вуглеводної природи (аглікон).
Поділяються на олігази, що гідролізують олігосахариди та поліази, що гідролізують полісахариди другого порядку.
12(142), 5(62) Представники олігаз:
- -глюкозидаза (мальтаза) розщеплює -глюкозидний зв’язок в дисахаридах мальтозі та цукрозі:

Мальтаза має велике значення в хлібопеченні. У цьому виробництві однією з біохімічних стадій, що обумовлюють якість хліба, є процес зброджування мальтози дріжджами. Останні повинні мати високу мальтазну активність. Цим вимогам задовольняють спеціальні хлібопекарні дріжджі;
- -глюкозидаза (целобіаза) розщеплює -глюкозидні зв’язки в дисахаридах, наприклад, в целобіозі:

- -галактозидаза (мелібіаза) розщеплює -галактозидний зв’язок в мелібіозі та рафінозі. Цей фермент має важливе промислове значення. Спиртове виробництво, що використовує меласу, несе суттєві збитки із-за того, що рафіноза, що міститься в цій сировині, не зброджується повністю дріжджами. Дріжджі містять -фруктозидазу і не виробляють -галактозидазу. Внаслідок цього вони відщеплюють від рафінози лише фруктозу. Частина молекули, що залишилася (мелібіоза) не гідролізується і не піддається подальшому перетворенню на спирт. Це може бути вирішено двома шляхами: отриманням спеціальних рас дріжджів, що мають -галактозидазну активність чи застосування ферментного препарату -галактозидази;
- -галактозидаза (лактаза) розщеплює -галактозидний зв’язок в лактозі:
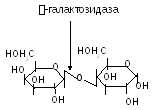
Цей фермент, окрім виконання важливої ролі в живому організмі застосовується в промисловості. При виготовленні продуктів з молока (морозиво тощо) для покращення їх смакових та інших якостей доцільним є розщеплення лактози молока на моноцукри за допомогою -галактозидази;
- -фруктозидаза (сахараза, інвертаза) розщеплює -фруктозидний зв’язок в сахарозі та рафінозі:

Цей фермент відіграє велику роль в організмі людини та тварин, оскільки багато продуктів, які вони споживають, містять сахарозу. Необхідний і для багатьох промислових м/о, оскільки цукромістка сировина (меляса тощо) є найбільш поширеною сировиною мікробіологічної промисловості. Препарат інвертази (інвертин) застосовують в кондитерській промисловості.
Із поліаз найбільше значення мають :
- 12(145), 5(64) амілази - група ферментів, що гідролізують крохмаль. Встановлена наявність трьох амілаз.
Фермент -амілаза (тваринна амілаза, декстриногенамілаза), в організмі тварин її міститься більше, ніж у рослинах. Присутня у слюні, травному соці, що виділяється підшлунковою залозою, у пророслому зерні пшениці, жита, ячменю. Вона гідролізує крохмаль не повністю, утворюючи продукти з невеликою кількістю залишків глюкози - низькомолекулярні декстрини, а також невелику кількість мальтози та глюкози.
-амілаза (рослинна амілаза, сахарогенамілаза) міститься головним чином в рослинах (зерні пшениці, жита, ячменю, соєвих бобах). В натуральному зерні -амілаза знаходиться у вільному стані, а -амілаза зв’язана з білками і тому неактивна. Звільняється вона при проростанні зерна.
-амілаза гідролізує крохмаль до мальтози та високомолекулярних декстринів.
Ферменти - та -амілази гідролізують лише зв’язки 1 - 4. Фермент -амілаза діє на крохмаль невпорядковано, розщеплюючи зв’язки незалежно від місця їх розташування в молекулі, -амілаза діє на кожен другий зв’язок з боків вільних кінців молекули, утворюючи мальтозу, але в амілопектині дія її розповсюджується лише до розгалужень молекули. В результаті утворюються мальтоза та крупні декстрини (-декстрини). Якщо в середовищі присутня і -амілаза, то вона розщепляє крупні декстрини, забезпечуючи можливість подальшої дії -амілази. Присутність -амілази посилює активність -амілази. Отже, активність двох амілаз при їх спільній дії вище суми активностей кожної з них окремо, тобто тут має місце синергічна дія двох амілаз.

Розрізняються - та -амілази і чутливістю до температури та реакції середовища.
-амілаза більш стійка до підвищеної температуритемператури, але чутлива до підкислення рН середовища. Це використовується в хлібопекарній промисловості, де продукти дії -амілази - низькомолекулярні декстрини - знижують якість хліба.
12(146) Оскільки у пророслому зерні пшениці та жита міститься активна -амілаза, то в процесі бродіння тіста, яке замісили з борошна пророслого зерна, накопичується значна кількість декстринів, що надають хлібу низьку еластичність, заминаємість, недостатню пористість, неприємний смак. Оскільки -амілаза чутлива до зниження кислотності, то тісто замішують на рідких дріжджах або молочнокислих заквасках. Це забезпечує накопичення в тісті підвищеної кількості молочної кислоти, що пригнічує дію -амілази.
Але амілаза має і позитивне значення у хлібопекарській, пивоварній, спиртовій, текстильній промисловості. Бродіння тіста та накопичення в ньому СО2, що розрихлює його та надає хлібу рівномірну пористість та об’єм, залежать від присутності у тісті зброджених дріжджами цукрів, що, в свою чергу, залежить від швидкості накопичення мальтози під впливом амілази на крохмаль. Хоча надто енергійна дія -амілази пророслого зерна погіршує якість хліба.
Солод, що застосовується при виготовленні пива та оцукрюванню заторів у спиртовій промисловості, є джерелом активної амілази, що каталізує перетворення крохмалю в мальтозу.
5(65), 12(147) При спільній дії - та -амілаз крохмаль гідролізується на 85 - 95 %. Негідролізований крохмаль представляє собою залишки із зв’язками 1 - 6 і так звані аномальні структури, на які не діють ці ферменти. Розщеплення зв’язків 1 - 6 здійснює фермент оліго-1,6-глюкозидаза та амілопектин-1,6-глюкозидаза.
Глюкоамілаза (-1-4-глюканглюкоамілаза, -амілаза), яка гідролізує кожен 1 - 4-зв’язок з нередукуючих кінців молекули крохмалю, відщеплюючи залишки глюкози, а також розщеплюючи 1-6 зв’язки. Утворюється переважно глюкоза та невелика кількість декстринів. За допомогою цього ферменту отримують глюкозну патоку та кристалічну глюкозу.
13(64) При захворюванні на панкреатит (запалення підшлункової залози) збільшується активність амілаз.
3. Пептидгідролази (протеази, протеолітичні ферменти) гідролізують білки (протеїнази) та пептиди (пептидази).
R -CO-NH-R1
+ HOH RCOOH + R1NH2,
-CO-NH-R1
+ HOH RCOOH + R1NH2,
де R, R1 - залишки амінокислот, пептидів.
5(66), 12(150) Найбільше промислове значення серед протеїназ мають:
- пепсин - міститься в слизовій оболонці шлунку. кристалічний препарат має дуже високу активність: 1 г його за 2 години розкладає 50 кг звареного білку яйця та створожує 100 000 л молока. Дія пепсину специфічна: він гідролізує переважно пептидні зв’язки, що утворені аміногрупою тирозину та фенілаланіну. В організмі знаходиться у вигляді пепсиногену, вивільняється під впливом соляної кислоти.
10(206) Пепсин використовують для підкорми поросят віком 2 – 4 місяців, що підвищує середньодобові прирости та знижує використання кормів. Ферменти згодовують лише молодим тваринам, у яких ферментативні системи, що здійснюють травлення, розвинені недостатньо;
- трипсин - міститься у соці підшлункової залози. В організмі знаходиться у вигляді трипсиногену. Вивільняється під впливом ентерокінази. 10(206) Пепсин і трипсин використовують для лікування захворювань травного тракту;
- ренін - міститься в четвертому відділі шлунку теляти (сичузі), називається сичужним ферментом. Застосовується для створожування молока у виробництві сиру шляхом перетворення розчиненного білка казеїногену в нерозчинний осад казеїнату кальцію. 1 г сичужного ферменту досить для створожувння 4 550 л молока;
- хімотрипсин - міститься в підшлунковій залозі, діє на пептидні зв’язки, утворені карбоксильною групою тирозину та фенілаланіну.
13(66) Трипсин і хімотрипсин вживають для обробки ран, опіків, гангренозних уражень. Хімотрипсин – при гнійному запаленні легень. Ці ферменти розщеплюють білки загиблих клітин, що утворюють гній.
- папаїн - рослинний протеолітичний фермент. Отримують у вигляді сухого порошку з соку плодів динного дерева (Carica papaya). Мститься також в дріжджах. Активується сульфгідрильними сполуками. Особливу роль відіграє при цьому відновлений глутатіон. Він передає водень до окисленої форми ферменту, і, відновлюючи його, переводить у активний стан, що негативно впливає на зберігання дріжджів. відновлений глутатіон підвищує протеолітичну активність дріжджів, прискорюючи процес їх автолізу і зменшуючи цим їх термін зберігання. Для попередження цього необхідне переведення глутатіону в окислену форму шляхом підвищення кислотності середовища та додавання окислювачів.
12(149) Серед пептидаз поширені амінопептидази (розщепляють пептидний зв’язок, що знаходиться поряд із вільною аміногрупою), карбоксипептидази (розщепляють пептидний зв’язок, що знаходиться поряд із вільною карбоксильною групою).
13(67) За допомогою протеолітичних ферментів змінюють якісні показники борошна. Борошно з високим вмістом клейковини з твердих сортів пшениці найкраще для випікання хліба, але з нього не можна виготовити печиво або бісквіти. Обробка такого борошна протеазами приводить до часткового розщеплення білка, тому розширюється можливість використання борошна для кондитерських виробів, поліпшується їх якість, скорочується процес замішування.
10(205) Протеолітичні ферменти використовуються у м’ясній промисловості. Вони частково розщеплюють білки і прискорюють дозрівання м’яса, роблять його більш м’яким і ніжним, поліпшують смак, підвищують соковитість. Тривалість дозрівання м’яса скорочується в декілька разів.
- 11, 12(155) Амідази – каталізують гідроліз амідів (уреаза, аргіназа.
Ліази
5(67), 1(128) Найбільше значення мають енолаза, альдолаза, піруватдекарбоксилаза. Здійснюють найважливіші етапи розкладу глюкози в процесі бродіння та дихання.
– піруватдекарбоксилаза каталізує розщеплення ПВК на оцтовий альдегід та вуглекислий газ.
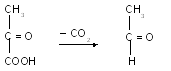
– альдолаза каталізує розпад фруктозодифосфата на фосфодіоксіацетон та фосфогліцериновий альдегід та зворотну реакцію.
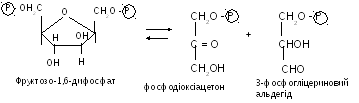
12(156) – енолаза каталізує перетворення фосфофгліцеринової кислоти у фосфоенолпіровиноградну: