
- •Лекція №1. Предмет і завдання біохімії
- •Загальні уявлення про обмін речовин
- •Хімічний склад живого організму
- •Клітина – основа структури живих систем
- •Історія розвитку біохімії
- •Лекція № 2 Білкові речовини
- •Функції білків
- •Класифікація амінокислот
- •Властивості амінокислот
- •Кольорові реакції на амінокислоти
- •Методи визначення амінокислот
- •Будова білків
- •Фізико-хімічні властивості білків
- •Шляхи виділення та розділення білків
- •Методи визначення білка
- •Класифікація білків
- •Природні пептиди
- •Лекція № 3 Нуклеїнові кислоти
- •Властивості і будова днк
- •Будова і функції рнк
- •Нуклеозиди і нуклеотиди
- •Назви нуклеозидів та нуклеотидів
- •Лекція № 4 Вітаміни
- •Жиророзчинні вітаміни
- •1(138), 10(245) Вітаміни групи а (антиксерофтальмічний фактор).
- •Водорозчинні вітаміни
- •1(162), 10(277) Вітамін с (аскорбінова кислота)
- •Вітаміноподібні речовини
- •Антивітаміни, антиметаболіти, антибіотики
- •Лекція № 5 Вуглеводи
- •Моносахариди
- •10(216), 11Окремі представники моносахаридів
- •Дубильні речовини
- •Полісахариди
- •Лекція № 6 Ліпіди
- •Характеристика промислових жирів
- •Лекція № 7. Ферменти
- •Будова ферментів
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Класифікація і номенклатура ферментів
- •Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання Оксидоредуктази
- •Трасферази
- •Гідролази
- •Ізомерази
- •Локалізація ферментів у клітині
- •Лекція № 8 Обмін речовин
- •Способи живлення організмів
- •Теорія біологічного окислення
- •Анаеробний розклад вуглеводів
- •Гліколіз
- •Види бродіння
- •2.Пропіоновокисле бродіння.
- •3.Маслянокисле бродіння
- •4.Ацетонобутилове бродіння.
- •5.Метановебродіння.
- •7.Спиртове бродіння.
- •Аеробний розклад вуглеводів
- •Енергетичний ефект повного розщеплення глюкози
- •Пентозний цикл (пентозофосфатний або гексозомонофосфатний шлях)
- •Гліоксилатний цикл
- •Фотосинтез
- •Біосинтез вуглеводів
- •Обмін ліпідів Розпад ліпідів
- •Окислення гліцерину
- •Окислення насичених жк
- •Енергетика -окислення жк
- •Α-окислення жк
- •Біосинтез ліпідів Біосинтез гліцерину
- •Біосинтез жк
- •Біосинтез тригліцеридів
- •Зміна жирів при зберіганні
- •Основні перетворення ліпідів
- •Обмін нуклеїнових кислот Розпад нк
- •Синтез нк
- •Обмін білків Розпад білків
- •Перетворення амінокислот
- •Нейтралізація і виведення аміаку з організму
- •Орнітиновий цикл
- •Біосинтез амінокислот
- •Біосинтез білків
- •Взаємозв’язок процесів обміну речовин у живому організмі
- •Література
Класифікація ферментів
1(127), 5(58), 10(191) 1. Оксидоредуктази - це ферменти, що каталізують окисно-відновні реакції, що лежать в основі біологічного окислення.
10(191) Цей клас поділяється на 19 підкласів, залежно від того, на які субстрати вони діють.
Так, виділяють підкласи оксидоредуктаз, що діють на групи – СН – ОН, СОН або СО, СН2 – СН2, СН – NН2, НАД.Н2 та НАДФ.Н2, на пероксид водню (каталаза – розкладає пероксид водню; пероксидаза – окислення речовин за участю пероксиду водню) тощо.
2. Трансферази - каталізують реакції міжмолекулярного перенесення різних атомів, груп атомів та радикалів.
Залежно від природи транспортованих груп поділяються на 8 підкласів: ті, що переносять одновуглецеві залишки (метилтрансферази); альдегідні та кетонні залишки; ацильні залишки (ацетилтрансферази); глікозильні залишки; азотисті групи (амінотрансферази); фосфатні групи тощо.
3. Гідролази - каталізують гідроліз, тобто розклад органічних речовин за участю води.
Клас поділяється на 11 підкласів: гідролази, які діють на складноефірні зв’язки або естерази (ліпаза, фосфатаза); глікозильні сполуки (амілази, целюлаза); пептидні зв’язки (пепсин, трипсин); С – N зв’язки, відмінні від пептидних (уреаза) тощо.
4. Ліази - каталізують негідролітичне розщеплення речовин з утворенням подвійних зв’язків, або приєднання груп атомів по місцю подвійних зв’язків.
Діють на зв’язки С-С (декарбоксилази), С-N, С-О (дегідратази) тощо.
5. Ізомерази - каталізують реакції ізомеризації.
Відомо 6 підкласів. Це рацемази (ізомеризація в сполуках з одним асиметричним атомом), епімерази (ізомеризація в сполуках з двома та більше асиметричними атомами), якщо ізомеризація включає внутрішньомолекулярне перенесення групи, фермент називається мутазою.
6. Лігази (синтетази) - каталізують синтез органічних речовин з використанням енергії розпаду АТФ або іншого нуклеозидтрифосфату.
Включають лігази, які утворюють С – О зв’язки; С – S (ацетил- КоА - синтетаза); С – N (пептидсинтетази); С – С (карбоксилази) .Оксидоредуктази. 3(80) Окислення - це процес відщеплення водню (протонів та електронів) від субстрату (донору) , а відновлення - процес приєднання їх до акцептора. Субстрат може окислюватись і внаслідок приєднання до нього кисню.
Характеристика окремих класів ферментів та їх промислове використання Оксидоредуктази
3(80), 5(58), 10(190) Належать до складних ферментів і виявляють каталітичну активність лише при наявності коферментів або простетичних груп, які визначають силу ферментативної дії, білкова частина визначає специфічність ферменту.
Найважливішими представниками цього класу є дегідрогенази, що каталізують перенесення водню;цитохроми, що каталізують перенесення електронів.
Небілковою частиною дегідрогеназ є у більшості випадків динуклеотиди. В залежності від виду динуклеотиду дегідрогенази поділяються на піридинові та флавінові.
1. Піридинові дегірогенази – небілковою частиною є нікотинамідаденіндинуклеотидом (НАД) або нікотинамідаденінди-нуклеотидфосфатом (НАДФ).
Піридинові дегідрогенази переносять водень не на кисень, а на інші акцептори, тому їх називають анаеробними.
1(215), 12(115) Коферменти НАД та НАДФ є динуклеотидами, в яких мононуклеотиди зв’язані між собою через залишки фосфорної кислоти. До складу одного з нуклеотидів входить амід нікотинової кислоти (вітамін РР), інший представляє собою АМФ.

НАД+
Каталізовані піридинзалежними дегідрогеназами реакції можна зобразити так:
Субстрат - Н2 + НАД+=субстрат + НАД.Н + Н+
Здатність НАД+ та НАДФ+ відігравати роль проміжного переносника водню пов’язана з наявністю в їх структурі аміду нікотинової кислоти. Зворотне гідрування - дегідрування (приєднання та віддача протона та електронів) цих коферментів представляють наступним чином (див. схему).
При перенесенні двох воднів від субстрату на НАД+ один з них включається у кофермент, а інший водень залишається в середовищі у вигляді H+. Для простоти відновлені форми НАД та НАДФ зображають символами НАДН2 та НАДФН2.

5(60) Піридинові дегідрогенази, активною групою яких є НАД беруть участь у спиртовому бродінні (алкогольдегідрогеназа), молочнокислому бродінні (лактатдегідрогеназа). Останнє лежить в основі отримання кисломолочних продуктів.
13(64), 10(207) Важливе значення мають ферменти в діагностиці різних захворювань. Зміна їх активнсті в крові порівняно з нормою є важливим показником патологічних змін в організмі. Цінність такої діагностики – висока специфічність та можливість визначення відхилень на ранніх стадіях хвороби. Так, у перші часи захворювання на інфаркт, коли ще ЕКГ не помічає ніяких змін, ферменти вже свідчать про початок хвороби (підвищується активність креатинкінзи та лактатдегідрогенази).
2. Флавінові дегідрогенази - небілковою частиною є флавінмононуклеотид (ФМН) або флавінаденіндинуклеотид (ФАД). Флавінові дегідрогенази також в основному анаеробні, але деякі можуть передавати водень безпосередньо на кисень, тоді їх називають аеробними.
1(216),12(118)Флавінові дегідрогенази містять похідні вітаміну В2.

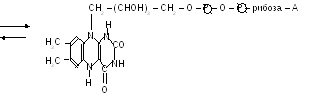
ФАД Н2
А – залишок аденіну.
ФМН та ФАД дуже міцно, на відміну від коферментів НАД та НАДФ, приєднані до ферменту (точніше, до апоферменту) і не відщепляються від нього ні на жодній із стадій каталітичного циклу.
Активною частиною молекули ФАД та ФМН є ізоаллоксазинове кільце рибофлавіну, до атомів якого можуть приєднуватись два атоми водню, тобто два електрони та два протони при відповідній внутрішньомолекулярній перебудові подвійних зв’язків.
12(119) Аеробні дегідрогенази, для яких акцептором водню слугує лише кисень повітря називають оксидазами. Важливим їх представником є поліфенолоксидаза, яка містить мідь. Цей фермент окислює поліфенольні сполуки. 13(54) Так, потемніння розрізаного яблука відбувається під впливом саме цього ферменту, який прискорює окислення органічних речовин з утворенням забарвлених продуктів.
1(219), 12(125), 10(337) 3. Перенесення електронів здійснює система цитохромів, яка складається з ряду геммістких білків (гемопротеїнів). В процесі тканинного дихання найбільш важливу роль відіграють цитохроми b, c1, c, a, аa3 (цитохромоксидаза). Всі вони містять простетичну гемінову групу, близьку до гему гемоглобіну (простетична група цитохрому b ідентична гему).
Ц итохроми
відрізняються не лише простетичними
групами, але і білковими компонентами.
В ході каталітичного процесу валентність
заліза, що міститься в цитохромах
оборотно змінюється (Fe2+
Fe3+)
итохроми
відрізняються не лише простетичними
групами, але і білковими компонентами.
В ході каталітичного процесу валентність
заліза, що міститься в цитохромах
оборотно змінюється (Fe2+
Fe3+)
В ланцюзі дихальних каталізаторів цитохроми розміщуються у певній послідовності:
цитохром b цитохром с цитохром а цитохром аа3.
Цитохроми b, с виконують функцію проміжних переносників електронів, а цитохром аа3 (цитохромоксидаза) є термінальним дихальним ферментом, що безпосередньо взаємодіє з киснем.
Цитохромоксидаза складається з 6 субодиниць, кожна з яких містить гемінову групу та атом міді. Очевидно, дві субодиниці складають цитохром а, а інші відносяться до цитохрому а3.
12(128) 4. Ліпоксигеназа (ліпоксидаза) широко розповсюджений у рослинах, каталізує окислення киснем повітря деяких ненасичених ВЖК та утворених ними ефірів.
Ліпогексиназа сої – глобулін, містить залізо.
5(61), 3(83), 10(206) До окисно-відновинх ферментів належать ферменти, що беруть участь у перенесенні водню: аскорбатоксидаза (окислює аскорбінову кислоту в дегідроаскорбінову кислоту); глюкозооксидаза (містить дві молекули ФАД, каталізує окислення глюкози до глюконової кислоти; глюкозооксидаза застосовується як антиокислювач для зв’язування кисню, що міститься в продуктах і запобіганню окислення м’яса, соків); поліфенолоксидаза (каталізує окислення фенолів до відповідних хінонів, спричинює потемніння поверхні розрізаного яблука, картоплі, потемніння плодів та овочів під час висушування); каталаза (небілковою частиною є залізопорфірин, використовується для розкладу пероксиду водню, що утворюється в результаті дії глюкозооксидази), на м’ясокомбінатах за допомогою каталази освітлюють кров, щоб добути безбарвну білкову суміш, яку використовують для виготовлення деяких ковбас і макаронних виробів; пероксидаза (каталізує процеси окислення органічних сполук за участю пероксиду водню).
13(62) Токсичність ціановодневої кислоти пояснюється тим, що вона є інгібітором багатьох ферментів, що містять метали. Вона зв’язує залізо, що входить до складу дихальних ферментів (наприклад, цитохромоксидази), внаслідок чого різко пригнічується дихання і організм гине.
