
- •Лекція №1. Предмет і завдання біохімії
- •Загальні уявлення про обмін речовин
- •Хімічний склад живого організму
- •Клітина – основа структури живих систем
- •Історія розвитку біохімії
- •Лекція № 2 Білкові речовини
- •Функції білків
- •Класифікація амінокислот
- •Властивості амінокислот
- •Кольорові реакції на амінокислоти
- •Методи визначення амінокислот
- •Будова білків
- •Фізико-хімічні властивості білків
- •Шляхи виділення та розділення білків
- •Методи визначення білка
- •Класифікація білків
- •Природні пептиди
- •Лекція № 3 Нуклеїнові кислоти
- •Властивості і будова днк
- •Будова і функції рнк
- •Нуклеозиди і нуклеотиди
- •Назви нуклеозидів та нуклеотидів
- •Лекція № 4 Вітаміни
- •Жиророзчинні вітаміни
- •1(138), 10(245) Вітаміни групи а (антиксерофтальмічний фактор).
- •Водорозчинні вітаміни
- •1(162), 10(277) Вітамін с (аскорбінова кислота)
- •Вітаміноподібні речовини
- •Антивітаміни, антиметаболіти, антибіотики
- •Лекція № 5 Вуглеводи
- •Моносахариди
- •10(216), 11Окремі представники моносахаридів
- •Дубильні речовини
- •Полісахариди
- •Лекція № 6 Ліпіди
- •Характеристика промислових жирів
- •Лекція № 7. Ферменти
- •Будова ферментів
- •Теорія ферментативного каталізу
- •Кінетика ферментативних реакцій
- •Властивості ферментів
- •Класифікація і номенклатура ферментів
- •Номенклатура ферментів
- •Класифікація ферментів
- •Характеристика окремих класів ферментів та їх промислове використання Оксидоредуктази
- •Трасферази
- •Гідролази
- •Ізомерази
- •Локалізація ферментів у клітині
- •Лекція № 8 Обмін речовин
- •Способи живлення організмів
- •Теорія біологічного окислення
- •Анаеробний розклад вуглеводів
- •Гліколіз
- •Види бродіння
- •2.Пропіоновокисле бродіння.
- •3.Маслянокисле бродіння
- •4.Ацетонобутилове бродіння.
- •5.Метановебродіння.
- •7.Спиртове бродіння.
- •Аеробний розклад вуглеводів
- •Енергетичний ефект повного розщеплення глюкози
- •Пентозний цикл (пентозофосфатний або гексозомонофосфатний шлях)
- •Гліоксилатний цикл
- •Фотосинтез
- •Біосинтез вуглеводів
- •Обмін ліпідів Розпад ліпідів
- •Окислення гліцерину
- •Окислення насичених жк
- •Енергетика -окислення жк
- •Α-окислення жк
- •Біосинтез ліпідів Біосинтез гліцерину
- •Біосинтез жк
- •Біосинтез тригліцеридів
- •Зміна жирів при зберіганні
- •Основні перетворення ліпідів
- •Обмін нуклеїнових кислот Розпад нк
- •Синтез нк
- •Обмін білків Розпад білків
- •Перетворення амінокислот
- •Нейтралізація і виведення аміаку з організму
- •Орнітиновий цикл
- •Біосинтез амінокислот
- •Біосинтез білків
- •Взаємозв’язок процесів обміну речовин у живому організмі
- •Література
Зміна жирів при зберіганні
16(118) При зберіганні насіння на оліє-жирових підприємствах, підготовці оліємісткого матеріалу до вилучення олії та олієдобуванні (пресування, екстракція) у ліпідному комплексі протікають складні хімічні та біохімічні процеси: гідроліз та окислення триацилгліцеринів, термічний розпад, вивільнення пов’язаних з білками та вуглеводами ліпідів, утворення нових ліпід-білкових та ліпід-вуглеводних комплексів. Змінюється і білковий комплекс, іде денатурація білків, гідролітичні процеси, змінюється їх поживна цінність. Все це впливає на хід технологічного процесу, якість отриманих продуктів.
Основні перетворення ліпідів
1. 16(33) Гідроліз ліпідів. Під впливом ферменту ліпази, кислот чи лугів триацилгліцерини гідролізуються з утворенням ЖК та гліцерину. Цей процес отримав назву омилення, оскільки утворюються солі ЖК – мила.
Такий розпад жирів та масел, ліпідів зерна, круп, м’яса, риби є однією з причин зниження їх якості і псування. Цей процес інтенсифікується при підвищенні вологості, температури. Цей процес також спостерігається при кулінарній обробці продуктів.
12(266) Так, при тривалому зберіганні масла та маргарину відбувається омилення жиру, вивільняється вільна масляна кислота, яка викликає появу неприємного запаху, який властивий цій кислоті.
2. Переетерифікація – обмін залишками ЖК між молекулами ацилгліцеринів або в межах однієї молекули. Цей процес дає змогу регулювати властивості жиру (температура плавлення, пластичність), тобто дозволяє отримувати жири із заданими для харчової технології властивостями без зміни їх жирокислотного складу.
3. Рослинну олію перетворюють у твердий жир шляхом гідрогенізації: приєднання водню по місцю подвійних зв’язків ненасичених жирних кислот. При цьому підвищується температура плавлення, твердість, змінюється пластичність, жири стають стійкими до окислення. Використовується при виробництві маргарину.
16(123) До складу маргарину входить також сквашене молоко, в основі отримання якого є біохімічний процес молочнокислого бродіння.
4. Харчове псування жирів.
3(91), 16(35) Під час тривалого зберігання жири набувають неприємного смаку і запаху - прогіркають. Прогіркання жирів – результат складних хімічних та біохімічних процесів. Буває ферментативне та неферментативне.
5(44), 3(91), 12(266) Жири, що містять ненасичені ЖК, піддаються окисленню в присутності повітря. Здатність жирів до окислення має негативне значення при зберіганні не лише жирів, але й інших продуктів рослинного та тваринного походження - борошна, круп.
Кисень активується ферментом ліпооксидазою, яка міститься в свіжих продуктах. Кисень приєднується по місцю подвійних зв’язків, утворюється ряд проміжних продуктів (перекиси, гідроперекиси).
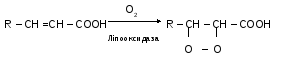
Потім іде розклад до альдегідів, альдегідокислот та кетонів, що мають неприємний запах та смак.
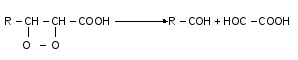
Також із пероксидів можуть утворюватись оксикислоти.
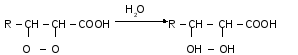
Пероксиди, реагуючи між собою або з ненасиченими ЖК, утворюють продукти полімеризації.
3(91) Під впливом кисню відбувається і висихання жирів, яке полягає в їх окисленні з утворенням води, вуглекислого газу, летких альдегідів та низькомолекулярних кислот. Окислений жир поступово густіє і покривається плівкою.
5(46) Лауреат Нобелівської премії Н.Семенов виявив, що під впливом світла при наявності кисню в жирах відбуваються вільнорадикальні процеси, в результаті чого також утворюються вищевказані продукти.
Під впливом кванту світла від молекули ненасиченої кислоти відщеплюяється радикал водню.
R
 – СН2
– СН = СН – СН2...
– СООН R
– СН
– СН = СН – СН2...
– СООН
– СН2
– СН = СН – СН2...
– СООН R
– СН
– СН = СН – СН2...
– СООН
При цьому утворюється вільний радикал ЖК, який приєднує атом кисню з утворенням перекисного радикалу.
R – СН
– СН = СН – СН2...
– СООН
– СН
– СН = СН – СН2...
– СООН
О – О”
Останній віднімає водень від наступної молекули ЖК і перетворюється у гідро перекис (–О – ОН), а з молекули жирної кислоти утворюється новий вільний радикал. Виникає ланцюгова реакція. Всі проміжні та кінцеві продукти вільно радикальних процесів шкідливі для здоров’я.
18(234), 12(267) Для запобігання окислення жирів до них додають антиокислювачі: вітамін Е (токофероли), фосфоліпіди. Вони у досить малих кількостях затримують прогорання.
12(267, 333) Значна частина антиоксидантів – феноли. Антиоксидантна активність фенольних сполук пояснюється наступним:
- фенольні сполуки зв’язують іони важких металів у стійкі комплекси, позбавляючи їх каталітичної дії;
- є акцепторами вільних радикалів, тобто фенольні сполуки “гасять” вільно радикальні процеси.
