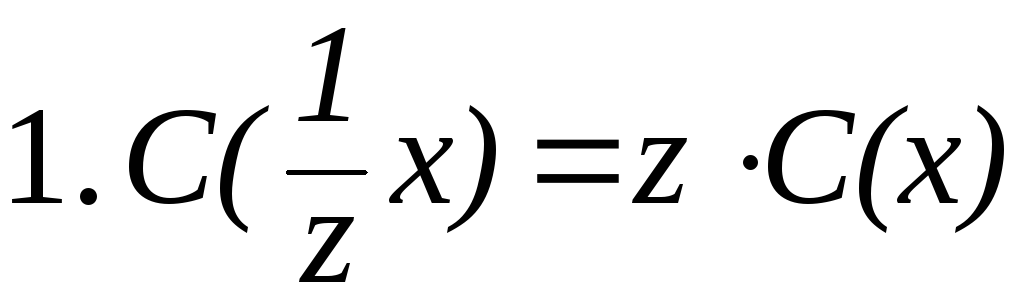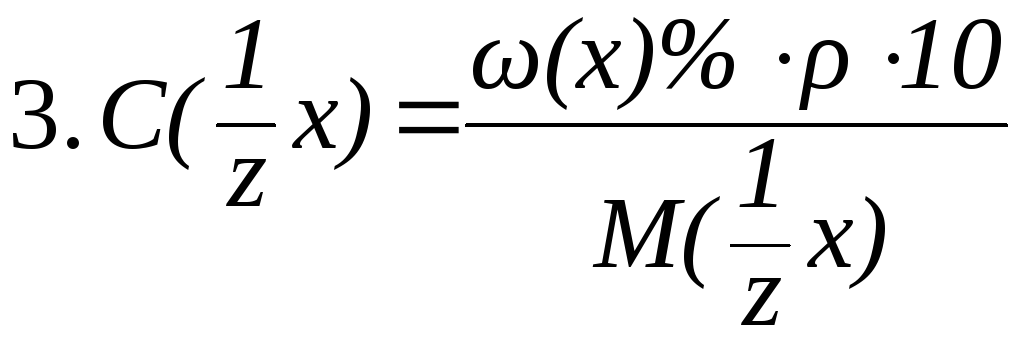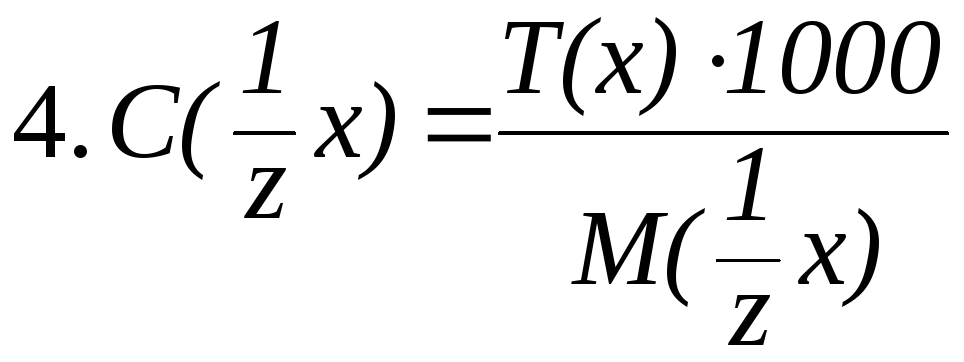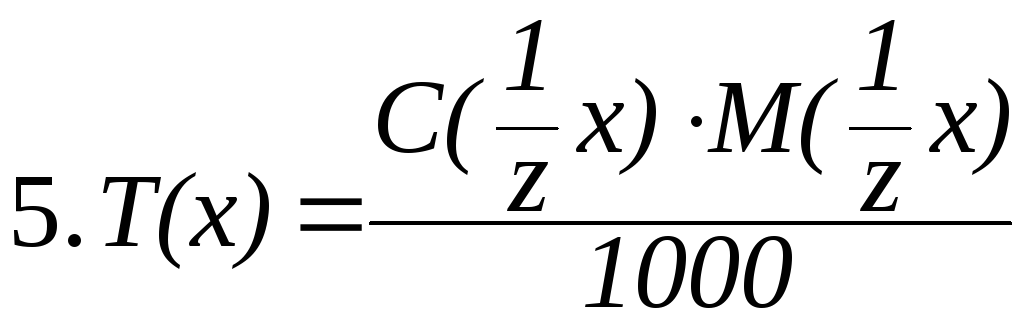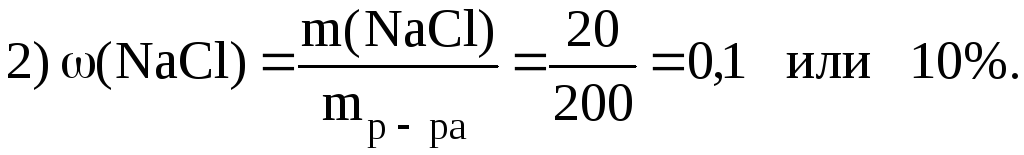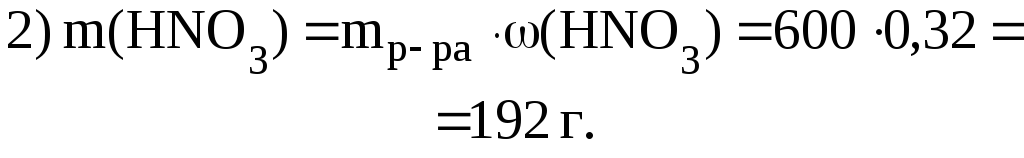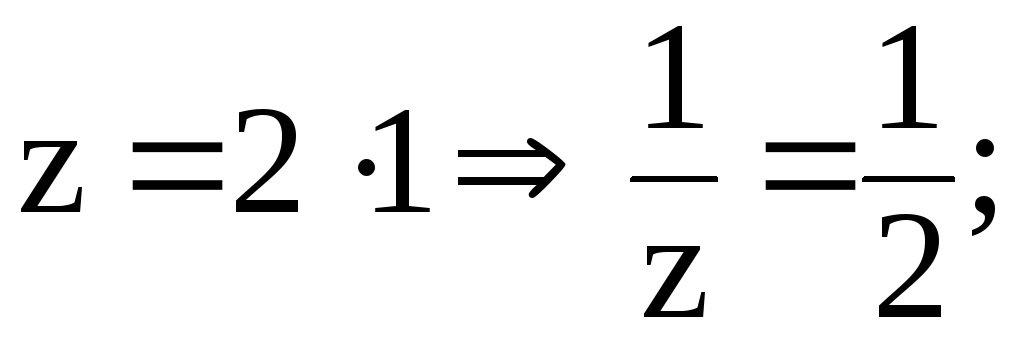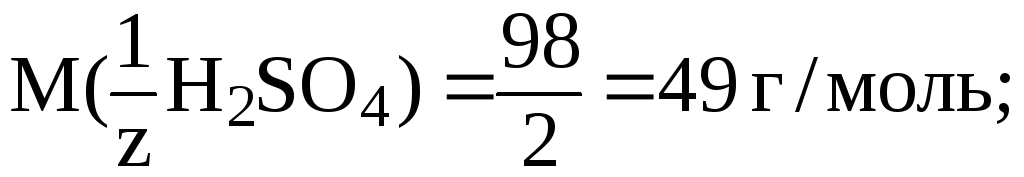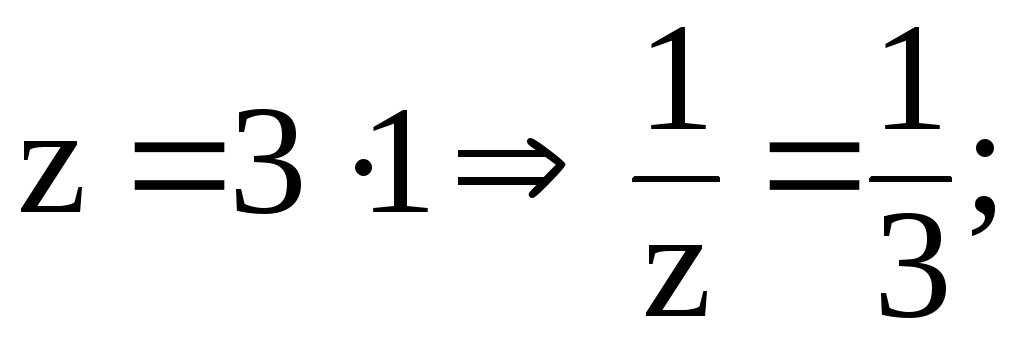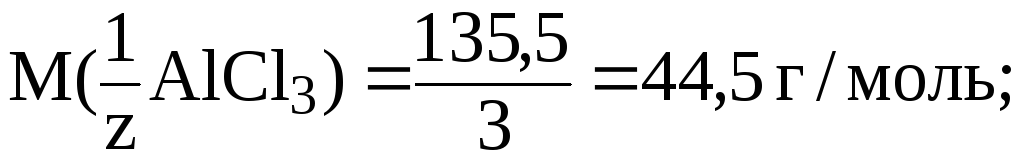- •Энергетика химических реакций
- •Основы термодинамики
- •Термохимические уравнения и расчеты
- •I следствие:
- •II следствие:
- •Направление протекания химических реакций
- •Эталоны решения задач
- •2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №6
- •Вариант №7
- •2) C6h12o6(кр.) 6o2(газ) 6co2(газ) 6h2o(жидк.).
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Основы химической кинетики Факторы, влияющие на скорость химической реакции
- •1. Зависимость скорости реакции от концентраций реагентов.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергия активации
- •Порядок и молекулярность реакции
- •Реакции I порядка
- •Механизмы протекания химических реакций
- •I закон фотохимии:
- •Ферментативный катализ
- •Эталоны решения задач
- •2 Моль/л a 1 моль/л b
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант № 15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Химическое равновесие
- •Термодинамика равновесных процессов
- •Кинетика равновесных процессов
- •Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задачи для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Растворы Общие сведения
- •Теории растворов
- •1. Физическая теория растворов.
- •2. Химическая теория растворов.
- •Основные способы выражения концентрации растворов
- •Связь между различными способами выражения концентрации растворов
- •Эталоны решения задач
- •4) Приготовление раствора аналогично задаче №6.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
Связь между различными способами выражения концентрации растворов
|
|
|
Эталоны решения задач
1. Вычислить массовую долю NaCl, если 20 г NaCl растворено в 180 г Н2О.
|
Дано: m(NaCl) 20 г m(Н2O) 180 г |
|
Решение.
1)
|
|
(NaCl) ? |
|
2. Вычислить массу воды, которую необходимо добавить к 200 г раствора NaCl с (NaCl) 2%, чтобы получить раствор с (NaCl) 0,9%.
|
Дано:
(NaCl) 2% (NaCl) 0,9% |
|
Решение. 1) в исходном растворе:
|
|
m(Н20) ? |
|
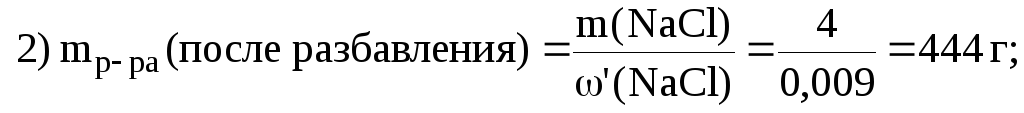
![]()
3. 500 мл раствора HNO3 с 1,2 г/мл с (HNO3) 32% разбавили 1 л Н2О. Найти массовую долю HNO3 в полученном растворе.
|
Дано:
(HNO3) 32% 0,32
V(Н2O) 1л 1000 мл |
|
Решение.
|
|
(HNO3) ? |
|
![]()
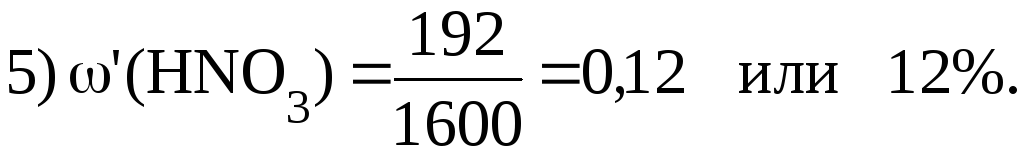
4. Из 10,6 г Na2CO3 приготовили 500 мл раствора. Вычислить молярную концентрацию C(Na2CO3).
|
Дано: m(Na2CO3) 10,6 г
|
|
Решение. 1) Mr(Na2CO3) 232 12 163 106; 2) M(Na2CO3) 106 г/моль; |
|
C(Na2CO3) ? |
|
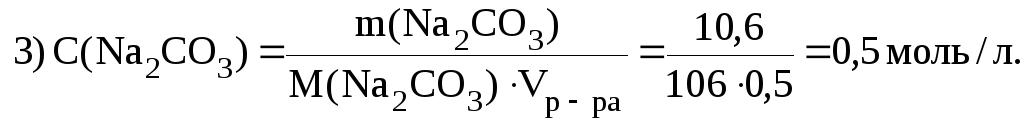
5. Имеется 200 мл раствора H2SO4 с C(H2SO4) 0,3 моль/л. Найти m(H2SO4) в растворе.
|
Дано:
C(H2SO4) 0,3 моль/л |
Решение. 1) M(H2SO4) 98 г/моль;
2) m(H2SO4)
C(H2SO4)M(H2SO4) 0,3980,2 5,88 г. |
|
m(H2SO4) ? |
6. Приготовить 200 мл раствора NaHCO3 с C(NaHCO3) 0,1 моль/л.
Пояснение: чтобы приготовить раствор, необходимо рассчитать массу содержащегося в нем растворенного вещества.
|
Дано:
C(NaHCO3) 0,1 моль/л |
|
|
m(NaHCO3) ? |
Решение.
1) по аналогии с предыдущей задачей:
m(NaHCO3)
с(NaHCO3)·M(NaHCO3)![]()
0,1·84·0,2
1,68 г;
0,1·84·0,2
1,68 г;
2) техника приготовления раствора:
а) взвесить на весах 1,68 г сухого NaHCO3.
б) через воронку перенести сухое вещество в мерную колбу вместимостью 200 мл.
в) добавить до метки на горлышке колбы дистиллированную воду.
7. В
200 мл раствора содержится 4,9 г H2SO4.
Рассчитать C(![]() H2SO4).
H2SO4).
|
Дано:
m(H2SO4) 4,9 г |
Решение. 1) найдем фактор эквивалентности H2SO4: a) число обменивающихся ионов H+ 2; б) заряд 1
2)
|
|
C( | |
|
|
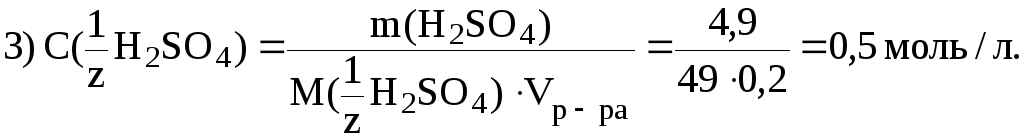
8. Приготовить
500 мл раствора А1С13
с C(![]() А1С13) 0,1 моль/л
из сухого вещества.
А1С13) 0,1 моль/л
из сухого вещества.
|
Дано:
с( |
Решение. 1) найдем фактор эквивалентности AlCl3: a) число ионов Al3+ 1; б) заряд 3
2)
|
|
m(AlCl3) ? | |
|
|
![]()