
- •Энергетика химических реакций
- •Основы термодинамики
- •Термохимические уравнения и расчеты
- •I следствие:
- •II следствие:
- •Направление протекания химических реакций
- •Эталоны решения задач
- •2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №6
- •Вариант №7
- •2) C6h12o6(кр.) 6o2(газ) 6co2(газ) 6h2o(жидк.).
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Основы химической кинетики Факторы, влияющие на скорость химической реакции
- •1. Зависимость скорости реакции от концентраций реагентов.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергия активации
- •Порядок и молекулярность реакции
- •Реакции I порядка
- •Механизмы протекания химических реакций
- •I закон фотохимии:
- •Ферментативный катализ
- •Эталоны решения задач
- •2 Моль/л a 1 моль/л b
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант № 15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Химическое равновесие
- •Термодинамика равновесных процессов
- •Кинетика равновесных процессов
- •Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задачи для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Растворы Общие сведения
- •Теории растворов
- •1. Физическая теория растворов.
- •2. Химическая теория растворов.
- •Основные способы выражения концентрации растворов
- •Связь между различными способами выражения концентрации растворов
- •Эталоны решения задач
- •4) Приготовление раствора аналогично задаче №6.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
4) Приготовление раствора аналогично задаче №6.
9. Приготовить
250 мл раствора H2SO4
с C(H2SO4) 0,1 моль/л
из раствора H2SO4
с (H2SO4) 10%.
![]()
1,056 г/мл.
1,056 г/мл.
|
Дано:
C(H2SO4) 0,1 моль/л (H2SO4) 10% 0,1 |
Решение. 1) найдем массу H2SO4 в приготовляемом растворе:
m(H2SO4)
C(H2SO4)·M(H2SO4)· |
|
|
2) найдем массу 10% раствора H2SO4, который содержит 2,45 г кислоты:
![]()

3)
найдем ![]() (H2SO4):
(H2SO4):
![]()
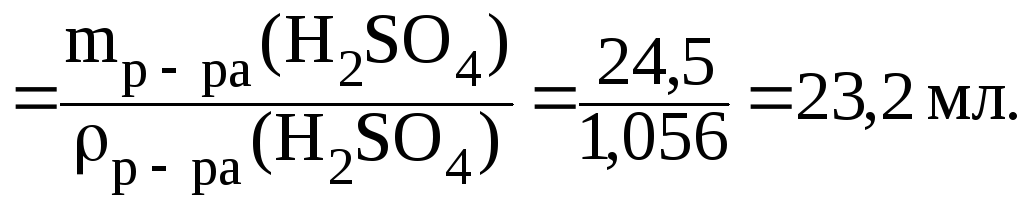
4) приготовление раствора:
а) отмерить мерным цилиндром 23,2 мл 10% р-ра H2SO4;
б) перенести его в мерную колбу вместимостью 250 мл;
в) добавить до метки дистиллированную воду.
10. Приготовить
100 мл раствора НС1 с C(![]() HCl) 0,1 моль/л
из раствора HCl
с (НС1)
5%;
1,02 г/мл.
HCl) 0,1 моль/л
из раствора HCl
с (НС1)
5%;
1,02 г/мл.
|
Дано:
c(
(HCl) 5% 0,05 |
|
|
|
Решение.
1) для
(HCl)
z 11 1,
![]() ,
следовательно:
,
следовательно:
M(![]() HCl) 36,5
г/моль;
HCl) 36,5
г/моль;
2) найдем массу HCl в приготовляемом растворе:
m(HCl)
c(![]() HCl)·M(
HCl)·M(![]() HCl)·
HCl)·![]()
0,1·36,5·0,1
0,365 г;
0,1·36,5·0,1
0,365 г;
3) найдем массу 5% раствора HCl, который содержит 0,365 г кислоты:
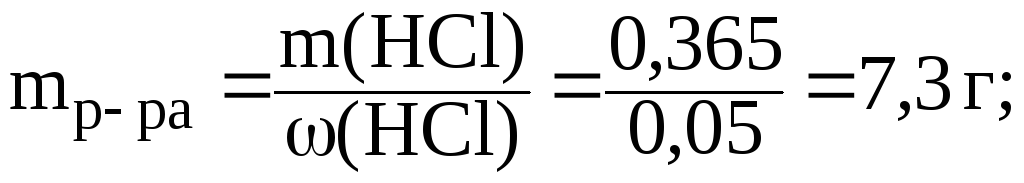
4) найдем
![]() (HCl):
(HCl):
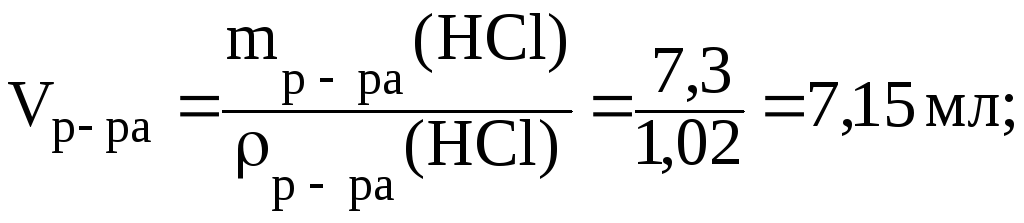
5) приготовление раствора аналогично предыдущей задаче.
11. c(Al2(SO4)3) 0,02
моль/л.
Найти
C(![]() Al2(SO4)3).
Al2(SO4)3).
|
Дано: C(Al2(SO4)3) 0,02 моль/л |
|
Решение. 1) найдем z для Al2(SO4)3: a) число ионов Al3+ 2; б) заряд 3: z 3·2 6
2)
так как C( C( |
|
C( | ||
|
|
12. Приготовить
250 мл раствора CuSO4
с C(![]() CuSO4)
= 0,1 моль/л из кристаллогидрата
CuSO4·5Н2О.
CuSO4)
= 0,1 моль/л из кристаллогидрата
CuSO4·5Н2О.
|
Дано:
C( |
|
|
m(CuSO4·H2O) ? |
Решение.
![]()
2) найдем массу безводного CuSO4 в растворе:
m(CuSO4)
C(![]() CuSO4)·M(
CuSO4)·M(![]() CuSO4)
CuSO4)
![]()
0,1·80·0,25
2 г;
0,1·80·0,25
2 г;
3) найдем массу кристаллогидрата, содержащего 2 г CuSO4:
M(CuSO4·H2O) 160 5·18 250 г/моль;
![]() ;
;
![]() .
.
4) приготовление раствора аналогично предыдущей задаче.
Вопросы для самоконтроля
1. Что такое раствор? Приведите примеры растворов, находящихся в разном агрегатном состоянии.
2. В чем заключается отличие химической теории растворов от физической?
3. Что такое количество вещества?
4. Что называют молярной массой?
5. Что такое химический эквивалент?
6. Что такое фактор эквивалентности?
7. Что называют молярной массой эквивалента?
8. Что такое массовая доля растворенного вещества? Какова ее размерность?
9. Что такое молярная концентрация? Какова ее размерность?
10. Что такое молярная концентрация эквивалента? Какова ее размерность?
11. Что такое моляльная концентрация? Какова ее размерность?
12. Что такое титр раствора? Какова его размерность?
13. Что такое мольная доля? Какова ее размерность?
9. Какими соотношениями связаны между собой выражения концентрации:
а) массовая доля и молярная концентрация;
б) массовая доля и молярная концентрация эквивалента;
в) молярная концентрация и молярная концентрация эквивалента?
