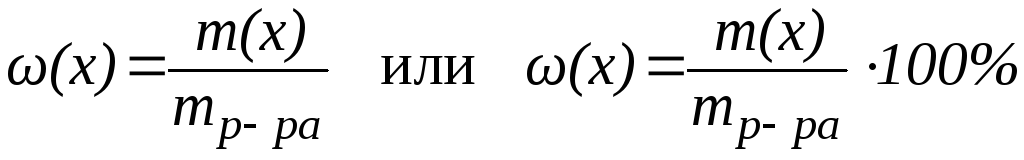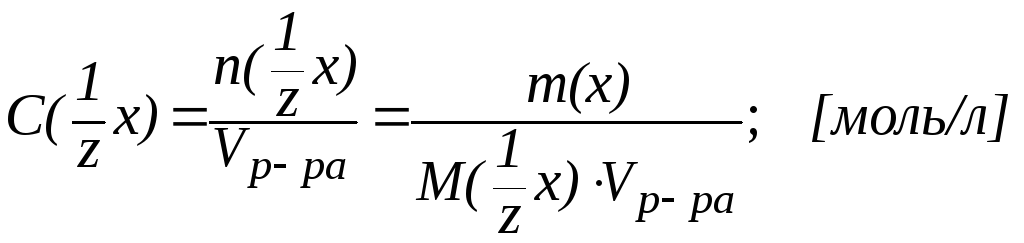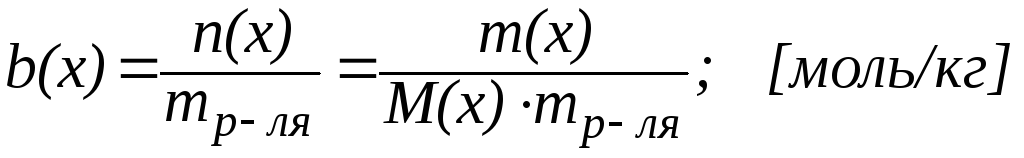- •Энергетика химических реакций
- •Основы термодинамики
- •Термохимические уравнения и расчеты
- •I следствие:
- •II следствие:
- •Направление протекания химических реакций
- •Эталоны решения задач
- •2C2h5oh(жидк.) c2h5oc2h5(жидк.) h2o(жидк.)
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №6
- •Вариант №7
- •2) C6h12o6(кр.) 6o2(газ) 6co2(газ) 6h2o(жидк.).
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Основы химической кинетики Факторы, влияющие на скорость химической реакции
- •1. Зависимость скорости реакции от концентраций реагентов.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергия активации
- •Порядок и молекулярность реакции
- •Реакции I порядка
- •Механизмы протекания химических реакций
- •I закон фотохимии:
- •Ферментативный катализ
- •Эталоны решения задач
- •2 Моль/л a 1 моль/л b
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант № 1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант № 15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Химическое равновесие
- •Термодинамика равновесных процессов
- •Кинетика равновесных процессов
- •Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задачи для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Растворы Общие сведения
- •Теории растворов
- •1. Физическая теория растворов.
- •2. Химическая теория растворов.
- •Основные способы выражения концентрации растворов
- •Связь между различными способами выражения концентрации растворов
- •Эталоны решения задач
- •4) Приготовление раствора аналогично задаче №6.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
2. Химическая теория растворов.
Химическая, или сольватная, теория растворов была предложена в 1887 г. Д.И. Менделеевым, который установил, что в реальном растворе присутствуют не только индивидуальные компоненты, но и продукты их взаимодействия. Исследования водных растворов серной кислоты и этилового спирта, проведенные Д.И. Менделеевым, легли в основу теории, суть которой заключается в том, что между частицами растворенного вещества и молекулами растворителя происходят взаимодействия, в результате которых образуются нестойкие соединения переменного состава, называемые сольватами или гидратами, если растворителем является вода. Главную роль в образовании сольватов играют непрочные межмолекулярные силы, в частности, водородная связь.
В этой связи следует принять следующую трактовку понятия «раствор»:
Раствором называется гомогенная система переменного состава, состоящая из двух и более компонентов и продуктов их взаимодействия.
Из данного определения следует, что растворы занимают промежуточное положение между химическими соединениями и смесями. С одной стороны, растворы однородны, что позволяет рассматривать их как химические соединения. С другой стороны, в растворах нет строгого стехиометрического соотношения между компонентами. Кроме того, растворы можно разделить на составные части (например, при упаривании раствора NaCl можно выделить соль в индивидуальном виде).
Основные способы выражения концентрации растворов
Количественный состав раствора чаще всего оценивают при помощи понятия концентрации, под которым понимают содержание растворенного вещества (в определенных единицах) в единице массы (объема) раствора (растворителя). Основными способами выражения концентрации растворов являются следующие:
1. Массовая доля вещества (x) это отношение массы данного компонента x, содержащегося в системе, к общей массе этой системы:
|
|
(1) |
Выражается в долях единицы или в %. Массовая доля компонента в % показывает, сколько г данного компонента содержится в 100 г раствора. Например, раствор NaCl с массовой долей 0,9% содержит 0,9 г NaCl в 100 г раствора.
2. Молярная концентрация раствора С(х) это отношение количества вещества компонента n(х) к объему раствора Vр-ра:
|
|
(2) |
Единицей количества вещества является моль, т. е. то количество вещества, которое содержит столько реальных или условных частиц, сколько атомов содержится в 0,012 кг изотопа С12. При использовании моля как единицы количества вещества следует знать, какие частицы имеются в виду: молекулы, атомы, электроны или другие. Молярная масса М(х) это отношение массы к количеству вещества (г/моль):

3. Молярная
концентрация эквивалента С(![]() x)
это отношение количества эквивалента
вещества n(
x)
это отношение количества эквивалента
вещества n(![]() x)
к объему раствора Vр-ра:
x)
к объему раствора Vр-ра:
|
|
(3) |
Химический эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять или высвобождать 1 ион водорода в кислотно-основных или ионообменных реакциях.
Так же, как молекула, атом или ион, эквивалент безразмерен.
Масса моля
эквивалентов называется молярной
массой эквивалента
М(![]() x).
Величина
x).
Величина ![]() называется
фактором
эквивалентности.
Она показывает,
какая доля реальной частицы вещества
соответствует эквиваленту. Для правильного
определения эквивалента вещества надо
исходить из конкретной реакции, в которой
это вещество участвует, например, в
реакции взаимодействия Н3РО4
с NaOH
может происходить замещение одного,
двух или трех протонов:
называется
фактором
эквивалентности.
Она показывает,
какая доля реальной частицы вещества
соответствует эквиваленту. Для правильного
определения эквивалента вещества надо
исходить из конкретной реакции, в которой
это вещество участвует, например, в
реакции взаимодействия Н3РО4
с NaOH
может происходить замещение одного,
двух или трех протонов:
1. H3PO4 + NaOH NaH2PO4 + H2O;
2. H3PO4 + 2NaOH Na2HPO4 + 2H2O;
3. H3PO4 + 3NaOH Na3PO4 + 3H2O.
В
соответствии с определением эквивалента,
в 1-й реакции замещается один протон,
следовательно, молярная масса эквивалента
вещества равна молярной массе, т. е.
z l
и 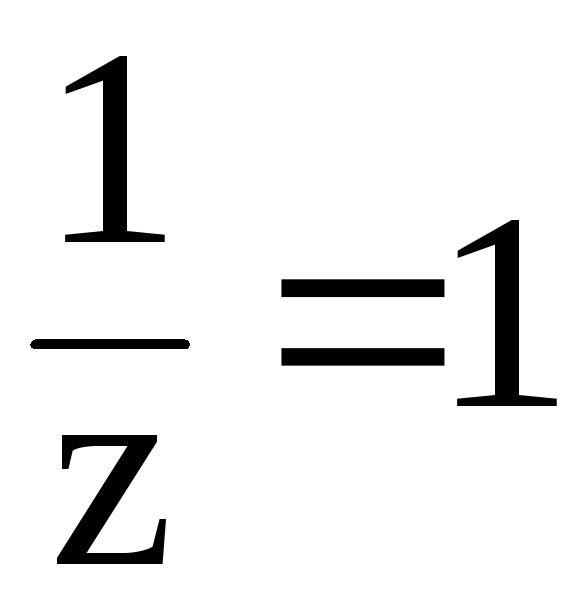 .
В данном случае:
.
В данном случае:
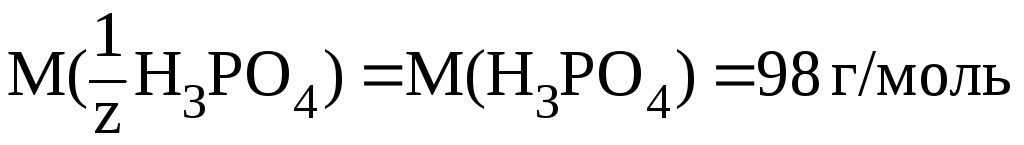 .
.
Во 2-й
реакции происходит замещение двух
протонов, следовательно, молярная масса
эквивалента составит половину молярной
массы Н3РО4,
т. e.
z 2,
а  .
Здесь:
.
Здесь:
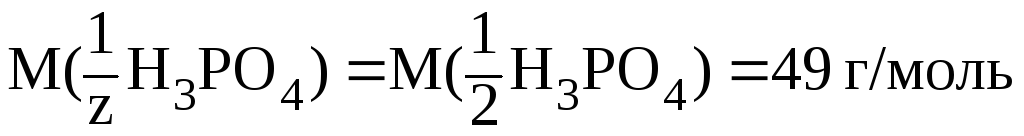 .
.
В 3-й реакции
происходит замещение трех протонов и
молярная масса эквивалента составит
третью часть молярной массы Н3РО4,
т.е. z 3,
a
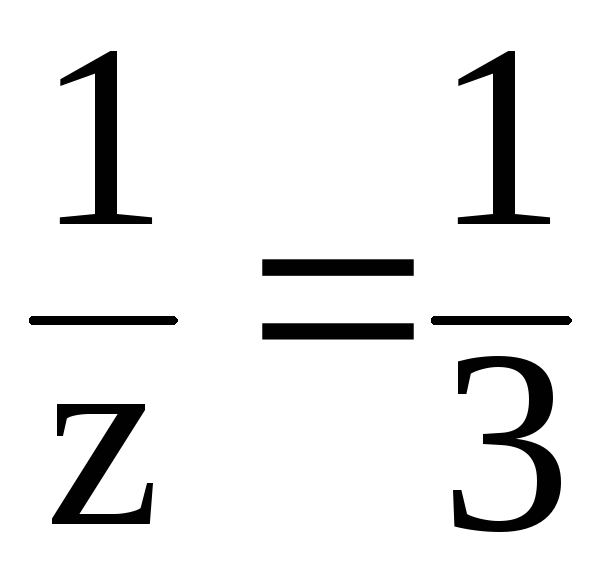 .
Соответственно:
.
Соответственно:
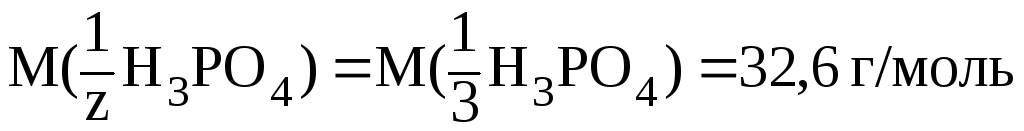 .
.
В реакциях обмена, где непосредственно не участвуют протоны, эквиваленты могут быть определены косвенным путем, введением вспомогательных реакций, анализ результатов которых позволяет вывести правило, что z для всех реакций равен суммарному заряду обменивающихся ионов в молекуле вещества, участвующего в конкретной химической реакции.
Примеры:
1. AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl.
Для AlCl3 обменивается 1 ион Al3+ с зарядом +3, следовательно, z = 13 = 3. Таким образом:

Можно также сказать,
что обмениваются 3 иона хлора с зарядом
1.
Тогда z = 31 = 3
и

Для AgNO3 z = 11 = 1 (обменивается 1 ион Ag+ с зарядом +1 или обменивается 1 ион NO3 с зарядом 1).
2. Al2(SO4)3 + 3BaCl2 = 3BaSO4 + 2AlCl3.
Для Al2(SO4)3 z = 23 = 6 (обменивается 2 иона Al3+ с зарядом +3 или 3 иона SO42 с зарядом 2). Следовательно,
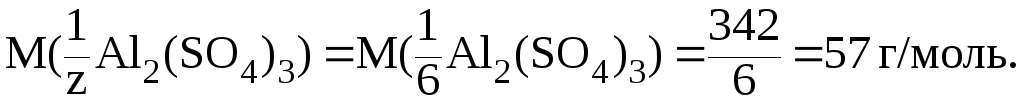
Итак,
запись С(![]() H2SO4)
= 0,02 моль/л означает, что имеется раствор,
в 1 л которого содержится 0,02 моль
эквивалента H2SO4,
а молярная масса эквивалента H2SO4
составляет при этом
H2SO4)
= 0,02 моль/л означает, что имеется раствор,
в 1 л которого содержится 0,02 моль
эквивалента H2SO4,
а молярная масса эквивалента H2SO4
составляет при этом
![]() молярной массыH2SO4,
т. е. 1 л раствора содержит
молярной массыH2SO4,
т. е. 1 л раствора содержит
![]() H2SO4.
H2SO4.
При
факторе эквивалентности  молярная концентрация эквивалента
равна молярной концентрации раствора.
молярная концентрация эквивалента
равна молярной концентрации раствора.
4. Титр Т(x) – это отношение массы вещества к объему раствора (в мл):
|
|
(4) |
5. Моляльная концентрация (моляльность) b(х) – это отношение количества растворенного вещества (в молях) к массе m растворителя:
|
|
(5) |
6. Мольная доля N(x) – это отношение количества вещества данного компонента, содержащегося в системе, к общему количеству веществ системы:
|
|
(6) |
Выражается в долях единицы или в %.
7. Коэффициентом растворимости вещества Р(x) называют максимальную массу вещества, выраженную в г, которая может раствориться в 100 г растворителя.